声波处理增强拟南芥的抗病性
2020-08-28艾干郑芷若张小艺朱海李田丽夏庆月窦道龙景茂峰
艾干 郑芷若 张小艺 朱海 李田丽 夏庆月 窦道龙 景茂峰


摘要:近期研究发现,声波可以激发植物的防衛反应,提高植物抗病性。然而,植物感知声波诱导抗病的分子机制还缺乏深入研究。选定特定频率和振幅的声波处理拟南芥,考察拟南芥与病原细菌丁香假单胞菌互作的影响。结果表明,声波预处理后植株叶片中的细菌生长量相比于对照组降低87.5%。利用转录组分析结果表明,拟南芥共有317个基因发生差异表达,其中有232个上调表达基因,85个下调表达基因,并且这些上调表达基因主要富集于防卫反应相关基因。实时定量PCR结果显示,2个防卫反应关键基因PR1和FRK1显著上调表达,说明声波处理可以通过激活拟南芥的基础防卫反应,增强植物对丁香假单胞菌的抗性。最后,利用MEME软件分析声波处理后上调表达的基因的保守转录元件,鉴定了 “AAXXAGAGAG”等3个特异性响应声波的转录元件。研究结果综合表明声波处理可以明显提高植物的抗性,这为把声波用于作物病害控制奠定了理论基础。
关键词:声波;植物抗病;拟南芥;丁香假单胞;防卫反应
中图分类号: S432.2 文献标志码: A
文章编号:1002-1302(2020)14-0125-06
植物没有动物类似的神经系统和运动器官,却须要适应复杂而多变的环境,因此在漫长的进化过程中,植物进化出多种复杂的机制感受周围环境的变化以调节自身生长发育。声波作为环境中的一种机械刺激,可以引起植物的多种复杂反应,包括触摸形态学建成[1]、开花、衰老、叶绿素含量、激素水平、气孔开闭以及生物和非生物胁迫抗性水平等[2]。有证据显示植物对自然声音有响应,比如,植物在处于蜜蜂产生特定频率的嗡嗡声中时会从花药中释放出花粉,这种行为被称作振动传粉[3]。通过“绿色音乐”(如鸟类和蟋蟀的“歌唱”等声音)处理后,大白菜中多胺和氧气吸收量的增加也证实了这一特性[4]。此外,还有证据表明植物可以选择性地响应特定频率的声波,例如菜青虫咀嚼声引起的振动可以诱导拟南芥的化学防御。然而,在同一研究中,叶蝉发出的声波却未能引发防御反应[5]。在 1 400 Hz 声波处理下,菊花显示出吲哚-3-乙酸的积累和脱落酸含量减少[6]。玉米幼根生长于特定声音频率(220 Hz)下,表现出趋音性[7]。上述研究表明植物已进化出了对声波的响应机制,有假说认为细胞骨架-质膜-细胞壁界面在声波感知中发挥了重要作用[4]。
在对水稻、小麦和番茄等作物的研究中,发现声波可以刺激种子萌发,增加果实数量,增长作物株高,增多作物分蘖数和提高作物产量[8]。声波的预处理甚至可以缓解水稻面临的干旱胁迫[9]。1 000 Hz 的声波处理会提高菊花、石斛和猕猴桃的品质[8]。有研究表明,拟南芥可以通过感知昆虫食草时产生的声波,从而引发系统化学防御[5];声波还可以诱导草莓的抗病性[10],增强拟南芥对灰霉菌的抗性[10-11]。声波是一种无污染、耗能少、适用性高的物理手段。依托声波处理的病害防控和生长调控技术可能是未来增加作物抗病性的一种简单且经济的方法,了解声波介导抗性的机制将能更好地指导农业生产。为了探索声波是否能诱导植物对半活体病原菌的抗性,并解析声波诱导植物抗性的机制,本研究以模式植物拟南芥和半活体模式病原菌丁香假单胞菌作为研究对象,研究声波处理对拟南芥抗丁香假单胞菌能力和基因表达的影响。由于植物响应声波的特异性,还对声波诱导后上调的基因进行保守转录元件的预测,鉴定3个特异性响应声波的转录元件。
1 材料与方法
1.1 供试菌株和植物材料
本研究中使用的植物材料拟南芥生长环境为22 ℃,10 h光照、14 h黑暗的人工气候室。
所用接种菌株为丁香假单胞菌菌株(Pst)DC3000,于含有相应抗性的KB培养液(蛋白胨 20 g,甘油10 mL,K2HPO4 15 g,MgSO4·7H2O 1.5 g,加水定容至10.0 mL)中摇菌后保存成20%的甘油菌于-70 ℃冷冻保存。丁香假单胞菌于 28 ℃ 培养箱中培养,由笔者所在实验室保存。
1.2 声波处理
参考前人研究结果[3,6],选择500 Hz、100 dB作为声波处理的频率和振幅。将生长30 d的拟南芥植株分别放入2个条件一样的光照培养箱中,在处理组的培养箱中放入一个音箱,持续播放电脑生成的500 Hz声波,并结合分贝仪将音量调整至 100 dB。对照组的培养箱不作处理。声波处理 30 min 后进行接种或转录组测序(RNA-seq)。
1.3 丁香假单胞菌接种分析
首先取Pst相应菌株,重新活化后挑取单克隆接种于KB液体培养基中,28 ℃过夜培养。4 000 r/min 离心5 min收集菌体。再用灭菌的去离子水悬起菌体洗涤3次。调整菌体浓度为 106 CFU/mL。然后选择声波处理过的和未处理的拟南芥植株,用去针头的1 mL注射器从叶片背面将菌液注满整个叶片。每株植物注射2张叶片作为1个样品,每次试验每种材料至少需要6个重复样品。接种完毕用纸擦干叶片表面残余菌液,3 d后剪取叶片并将2张叶叠在一起,用直径为0.74 cm的打孔器获取样品放于装有100 μL灭菌水的离心管中,磨碎样品后再加900 μL水稀释后取20 μL菌液涂布平板。2 d后统计平板上长出的菌落数。5 d后观察发病症状。
1.4 实时定量PCR
用液氮速冻声波处理后的拟南芥叶片,使用总RNA提取试剂盒提取RNA。采用D260 nm/D280 nm评估RNA样品质量。采用逆转录试剂盒将RNA反转录成cDNA。相对定量PCR采用试剂盒进行试验。相对定量PCR引物actin-F:5′-GGAACTGGAATGGTGAAGGCTG-3′,actin-R:5′-CGATTGGATACTTCAGAGTGAGGA-3′,PR1-F:5′-TGGTCACTACACTCAAGTTGTT-3′,PR1-R:5′-GCTTCTCGTTCACATAATTCCC-3′,FRK1-F:5′-TATATGGACACCGCGTATAGTG-3′,FRK1-R:5′-ATAAAACTTTGCGTTAGGGTCG-3′。
1.5 生物信息学分析
1.5.1 转录组测序 采用Illumina高通量测序平台对RNA样品进行转录组测序,得到双末端读长 (150 bp)的原始测序数据。为了使后续分析结果更加可靠准确,去除低质量数据和含有接头污染的数据。随后使用Tophat软件将测序读长匹配到拟南芥的基因上,得到拟南芥每个基因对应的读长数,并对其进行标准化,即采用每百万条读段中来自于某基因每千碱基长度的读段数(reads per kilobase per million mapped reads,RPKM)代表基因的转录表达水平。得到基因的RPKM之后,以2倍作为差异基因筛选条件,并通过Cufflinks软件进行统计学显著性分析,以P<0.05、差异表达倍数2倍以上为标准,得到显著差异表达的基因。
1.5.2 转录组和生物信息学分析 GO富集分析使用agriGO(http://systemsbiology.cau.edu.cn/agriGOv2/index.php)获得,MapMan分析使用MapMan软件(https://mapman.gabipd.org/)进行。
1.5.3 转录元件鉴定 提取转录组分析中上调表达基因的启动子区域(1 000 bp),利用MEME软件的默认参数进行保守motif鉴定。
2 结果与分析
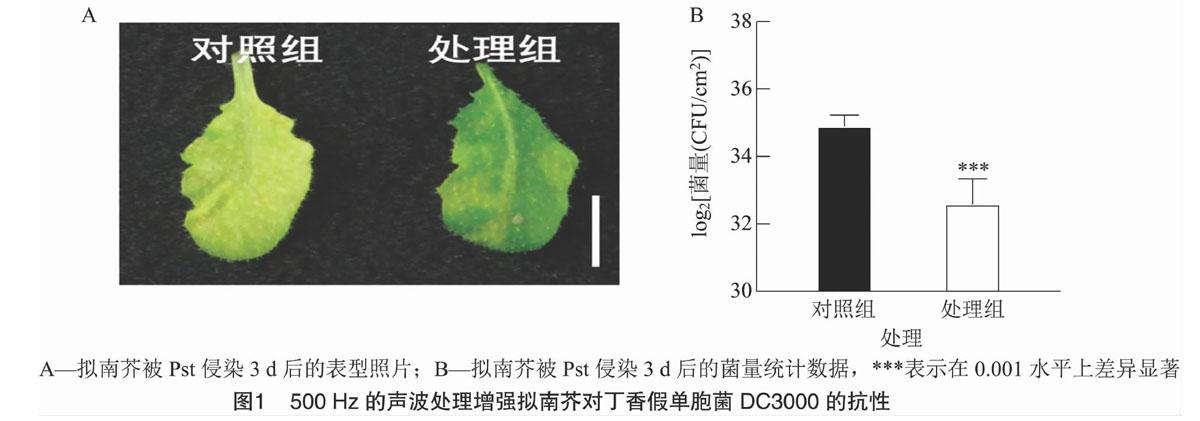
2.1 声波处理增强了拟南芥对丁香假单胞菌DC3000的抗性
为探究声波是否影响植物对病原菌的抗性,采用500 Hz恒定频率与100 dB恒定振幅处理拟南芥30 min。使用丁香假单胞菌DC3000分别接种对照组与处理组,并调查和统计拟南芥发病情况。结果显示,处理组中接种后的拟南芥叶片的症状较轻,而对照组的叶片已经发黄皱缩(图1-A),症状明显,说明该条件声波的预处理明显提高了拟南芥对丁香假单胞菌DC3000的抗性。同时,对叶片中细菌生长量进行进一步测定发现,声波预处理后的植株叶片中的细菌生长量相比于对照组降低87.5%(图1-B)。这表明声波处理可以明显增强拟南芥对丁香假单胞菌的抗性。
2.2 声波处理改变了拟南芥转录组谱
为进一步揭示声波促进植物对丁香假单胞菌抗性的机制,利用RNA-seq技术检测声波处理前后拟南芥的转录组变化。本试验对2个经过不同处理的样品进行转录本测序,处理组为500 Hz、100 dB声波处理30 min后的拟南芥,对照组为相同条件下未经声波处理的拟南芥。对照组与处理组测序后分别共获得44 395 768、45 668 332个过滤后数据读段。每个样品的过滤后数据与参考基因组的平均比对率为83%,表明测序结果可靠。对测序数据进行分析发现,声波处理后拟南芥共有317个基因发生差异表达(差异显著性小于0.05,差异倍数大于2),其中232个上调表达基因,85个下调表达基因(图2-A),约占拟南芥总基因数的0.8%。因为Ghosh等报道了在声波处理后,EXL1和HSPRO2等关键标志S基因上调表达[10],为验证本试验中 RNA-seq的可靠性,对声波处理的这2个标志基因进行定量试验。结果表明,EXL1在声波处理15、30、60 min后分别上调表达2.56、3.72、3.25倍,而HSPRO2在声波处理 15、30、60 min后分别上调表达2.32、56.72、3.45倍(图3-A)。这些结果与转录组测序结果一致。表明本试验样品处理和 RNA-seq结果较可靠。
通过GO富集分析对这些差异表达基因进行富集分析,结果表明它们主要富集于刺激反应(GO:0050896)、应激反应(GO:0006950)、化学刺激反应(GO:0042221)、有机物反应(GO:0010033)、生物刺激反应(GO:0009607)、其他有机体反应(GO:0051707)等重要生物学过程(图2-B)。转录组数据显示,声波处理后,拟南芥在刺激反应、应激反应和化学刺激反应等过程中上调基因富集明显,其抗逆反应相关的通路受到了影响。
2.3 声波处理激活了拟南芥的基础防卫反应
对上调表达的基因进行进一步的GO富集分析,找到富集差异基因的GO分类条目,寻找不同样品的差异基因可能与哪些基因功能的改变有关,结果表明,上调表达基因中防卫反应(GO:0006952)的通路顯著富集。利用MapMan软件对拟南芥受声波处理后的防卫通路进行分析发现,大量防卫相关基因上调表达,如病程相关蛋白基因PR1和植物防御素基因PDF1.2等拟南芥防卫反应的标志基因显著上调,分别上调表达19.62、60.21倍(图4)。另外,参与质体极性运输和脱落酸信号途径、调控植株抗病性的基因PCC1(ID:AT3G22231)上调表达18.84倍;几丁质酶等防卫基因,如CHI基因(ID:AT1G02360)上调表达17.23倍;NB-LRR基因(ID:AT3G04210、AT1G58170),分别上调表达252、2.49倍。上述结果初步显示声波处理激发了植物的抗病防卫信号途径,为了进一步验证此结果,利用定时定量PCR技术验证声波处理后PR1和PDF1.2基因分别在声波处理0、15、30、60 min后的表达量,结果表明PR1基因在处理15、30、60 min分别上调表达2.61、634、5.46倍;PDF1.2基因在声波处理后分别上调表达30.95、4.06、1.50倍;病原菌相关分子模式诱导的植物免疫(PAMP-triggered immunity,PTI)的关键基因FRK1同样上调表达,分别上调表达1.86、2.47、3.76倍(图3-B)。上述结果显示,富集在防卫反应相关通路的相关基因上调表达,表明声波处理可以激活拟南芥的基础防卫反应。
2.4 受声波诱导的基因启动子区域的保守元件的鉴定
为鉴定声波诱导的启动子区域的保守元件,分别将上调表达基因和下调表达基因的启动子区域(1 500 bp)进行提取,利用MEME软件分析受声波诱导上调表达的保守转录元件和受声波诱导下调的保守转录元件,结果显示在232个上调表达的基因中,有150个基因的启动子中含有“TXTXTXXTXX”保守元件(元件1),有114个含有“AAXAXXAAAA”保守元件(元件2),有48个含有“AAXXAGAGAG”保守元件(元件3)(图5-A),其中,10个基因共同含有这3个保守元件,65个基因同时含有第1个和第2个保守元件,16个基因同时含有第1个和第3个保守元件,17个基因同时含有第2个和第3个保守元件(图5-B);在83个下调表达基因的启动子中没有发现保守的序列元件。上述结果表明,植物中特异性响应声波的基因可能受转录因子结合特异的转录元件调控。
3 討论与结论
声波无害且易于操控,有可能是未来作物病害控制的一种值得尝试的简易方法。了解声波介导抗性机制将有助于更好地指导农业生产。前人研究发现,声波处理可以增强植物对灰霉的抗性。但是,对于声波处理所诱导的抗菌谱的广度和深度还是了解得不多。因此,本研究在拟南芥中明确了声波能够提高植物对细菌的抗性,同时通过转录组探究了其作用机制。在植物感知环境刺激后,许多信号以级联反应的方式传导,从而调整植物自身相关生命活动。刺激信号的获取、信号转导和分子生理反应是植物在刺激作用下依次发生的3个主要阶段。在本次研究中,拟南芥在声波处理后,差异表达的基因数量较少,说明声波处理对植物的影响并不大。但是,这些差异表达的基因大部分与抗性有关,说明声波处理可能特异性激活了植物的抗性反应,也解释了为什么声波处理会增强植物对细菌的抗性。植物防卫反应的激活常伴随着许多标志性事件,如钙瞬变[12]、活性氧爆发[13]、激素水平调整[10,14-15]、离子通道通透性变化[16-17]、转录组和蛋白质组改变[18]等,同时发生很多抗病反应标志基因的上调表达[10]。本研究的转录组测序结果揭示了与这些标志性细胞活动相关基因在表达谱中的巨大变化,如PR1、PDF1.2和FRK1等基因。定量验证也保证了转录组数据的可信度。同时,为寻找响应声波诱导的关键转录因子,本研究对差异表达的基因启动子进行MEME分析发现3个候选的保守原件,这为今后的研究打下了基础。
怎样在提高抗病性的同时不危害植物生长是一直以来的研究难点,植物抗病与生长往往是拮抗的,过度的免疫反应往往导致植物的正常生长受损,带来不必要的产量损失。而从植物防卫反应的标志基因PR1、PDF1.2和FRK1的诱导表达量来看,声波诱导的抗性比较微弱,同时足够植物抵抗细菌侵染。前人已经报道声波处理可通过“启动效应”提高植物水杨酸水平[10]。声波的本质是一种机械振动,最近的研究表明植物在声波处理后生长增强,且植株在声波处理后未发现任何细胞分裂素水平的变化[6]。此外细胞分裂素信号的负调节因子RAV1的表达量不变,也表明声波介导的响应可能与细胞分裂素无关[19]。这个发现为平衡植物抗性和植物生长提供了研究前景。
声波可以诱导植物的光谱抗性。在前期研究中,拟南芥可以感知昆虫食草时产生的声波震动,激活化学防御[5];声波处理后,拟南芥对灰霉的抗性也显著增加[10-11]。本试验验证了声波处理同样可以诱导植物对细菌的抗性。以上数据表明,声波增强植物的光谱抗性,包括昆虫、疫霉和细菌。这凸显出声波处理在植物病害控制方面的潜力。
通过本研究,揭示了500 Hz的声波处理可以促进拟南芥对丁香假单胞菌的抗性,并且激活了拟南芥的基础防卫反应。另外,也寻找到3个可能受声波诱导的保守元件候选,为今后的研究打下基础。值得注意的是,之前有研究报道,声波处理也可以促进拟南芥对死体病原菌的抗性[10],这表明声波引起的抗性可能是广谱的。同时声波引起的植物抗性反应相对较弱,对植物生长造成的危害就会相对较小。利用声波干预提高植物抗病性为实现绿色可持续农业提供了一个新的思路。然而,植物响应声波的分子机制是什么?下游调控通路是如何实现的?这些问题仍待解决,因此本领域须要更进一步的深入研究。
参考文献:
[1]Chehab E W,Eich E,Braam J. Thigmomorphogenesis:a complex plant response to mechano-stimulation[J]. Journal of Experimental Botany,2008,60(1):43-56.
[2]Qin Y C,Lee W C,Choi Y C,et al. Biochemical and physiological changes in plants as a result of different sonic exposures[J]. Ultrasonics,2003,41(5):407-411.
[3]Paul A L,Vallejo-Marín M. Whats the ‘buzz about? the ecology and evolutionary significance of buzz-pollination[J]. Current Opinion in Plant Biology,2013,16(4):429-435.
[4]Mishra R C,Ghosh R,Bae H. Plant acoustics:in the search of a sound mechanism for sound signaling in plants[J]. Journal of Experimental Botany,2016,67(15):4483-4494.
[5]Appel H M,Cocroft R B. Plants respond to leaf vibrations caused by insect herbivore chewing[J]. Oecologia,2014,175(4):1257-1266.
[6]Wang B C,Shao J P,Li B,et al. Soundwave stimulation triggers the content change of the endogenous hormone of the Chrysanthemum mature callus[J]. Colloids and Surfaces B:Biointerfaces,2004,37(3/4):107-112.
[7]Gagliano M,Mancuso S,Robert D. Towards understanding plant bioacoustics[J]. Trends in Plant Science,2012,17(6):323-325.
[8]Reda H H,Hou T Z,Yu-Feng L I,et al. Advances in effects of sound waves on plants[J]. Journal of Integrative Agriculture,2014,13(2):335-348.
[9]Jeong M J,Cho J I,Park S H,et al. Sound frequencies induce drought tolerance in rice plant[J]. Pakistan Journal of Botany,2014,46(6):2015-2020.
[10]Ghosh R,Mishra R C,Choi B,et al. Exposure to sound vibrations lead to transcriptomic,proteomic and hormonal changes in Arabidopsis[J]. Scientific Reports,2016,6:33370.
[11]Choi B,Ghosh R,Mayank A G,et al. Positive regulatory role of sound vibration treatment in Arabidopsis thaliana against Botrytis cinerea infection[J]. Scientific Reports,2017,7(1):43-56.
[12]Liu L,Sonbol F M,Huot B,et al. Salicylic acid receptors activate jasmonic acid signalling through a noncanonical pathway to promote effector-triggered immunity[J]. Nature Communications,2016,7 (1):1583-1592.
[13]Vos I A,Pieterse C J,Wees S V. Costs and benefits of hormone-regulated plant defences[J]. Plant Pathology,2013,62(S1):43-55. [HJ2mm]
[14]Ming W,Yang C Y,Wei S H. Enhancement of the differentiation of protocorm-like bodies of Dendrobium officinale to shoots by ultrasound treatment[J]. Journal of Plant Physiology,2012,169(8):770-774.
[15]Chung H S,Abraham J K,Gao X L,et al. Regulation and function of arabidopsis JASMONATE ZIM-domain genes in response to wounding and herbivory[J]. Plant Physiology,2008,146(3):952-964.
[16]Zhao H C,Wang B C,Liu B A,et al. The effects of sound stimulation on the permeability of K+ channel of Chrysanthemum callus plasma[J]. Colloids and Surfaces B:Biointerfaces,2002,26(4):329-333.
[17]Hamilton E S,Schlegel A M,Elizabeth S H. United in diversity:mechanosensitive ion channels in plants[J]. Annual Review of Plant Biology,2015,66(1):113-137.
[18]Klára K,Pavel V,Ilja T P,et al. Plant proteome changes under abiotic stress-contribution of proteomics studies to understanding plant stress response[J]. Journal of Proteomics,2011,74(8):1301-1322.
[19]Feng C Z,Chen Y,Wang C,et al. The Arabidopsis RAV1 transcription factor,phosphorylated by SnRK2 kinases,regulates the expression of ABI3,ABI4,and ABI5 during seed germination and early seedling development[J]. The Plant Journal,2014,80(4):654-668.
收稿日期:2019-08-23
基金項目:国家重点研发计划(编号:2018YFD0201003);国家自然科学基金(编号:31625023、31801715);江苏省自然科学基金(编号:BK20180518)。
作者简介:艾 干(1993—),男,江苏南京人,博士研究生,主要从事植物与微生物互作研究。E-mail:2016102010@njau.edu.cn。
通信作者:景茂峰,博士,副教授,主要从事植物与微生物互作研究。E-mail:jingmf@njau.edu.cn。
