桂花与石楠叶片中瞬时表达体系的建立试验初报
2020-08-19闵思源陈柏楠陈康杨妍曾祥玲
闵思源 陈柏楠 陈康 杨妍 曾祥玲
摘 要 木本植物的稳定遗传转化难以建立或所需时间长,而在这些木本植物中建立瞬时遗传转化可大大提高基因功能分析的效率。因此,使用根癌农杆菌介导的瞬时侵染技术,以桂花和石楠叶片为材料,以β-葡糖醛酸酶基因(β-glucuronidase,GUS)作为实验结果检测的报告基因,建立瞬时表达体系。结果发现,侵染过程中,农杆菌对于桂花和石楠叶片有一定的毒性,可加速叶片衰败;蔗糖溶液相对于水可减缓叶片衰败;GUS基因表达的蛋白质可能因为叶片木质化程度太高或叶片脱色后褐化而无法检测或者没有表达。本实验为进一步改进桂花和石楠的瞬时表达实验体系提供了借鉴。
关键词 桂花;石楠;瞬时表达;遗传转化
桂花是我国的十大传统名花之一,自古享有“独占三秋压众芳”的美誉。随着大量基因测序工作的完成,我国对于植物基因作用的研究也进入了更加深入的阶段。目前,对植物基因功能与作用的研究主要通过转基因技术、基因敲除、基因沉默等方法。瞬时表达是最近几十年来发展的一种高速、高效率的检测蛋白质表达的办法,随着相关研究不断深入,逐渐被广泛应用到生物科学各方面的发展研究中。植物基因瞬时表达体系的构建为简洁、快速研究启动子活性、基因功能和蛋白质定位等开辟了新的途径[1-3]。园林木本植物中的瞬时表达是基因功能检测鉴定的有效方法,相较于稳定的遗传转化系统而言,瞬时表达具有一定优势:1)简洁高效,可操作性强,不需要经过漫长的组织培养过程,能够一周甚至几天内转化基因;2)基因表达的水平较高;3)安全,因为被转移的基因没有被整合到基因组中,不会产生能够遗传的下一代,不会有基因飘移的生态风险[4-5]。基因瞬时表达技术是在比较短的时间跨度范围内将植物需要表达的目的基因转化到靶细胞中,在靶细胞内建立一种暂时能够高效表达的体系。其中,β-葡糖醛酸酶基因(β-glucuronidase,GUS)被作为报告检测基因广泛应用在瞬时表达系统中[6]。
农杆菌介导的瞬时表达方法已经发展成为一种高速、高效率的基因表达与分析的办法。它的原理是将目的基因嫁接在表达载体上,然后转化到根癌农杆菌中,采用农杆菌侵染的方法,以GUS和GFP作为报告基因,建立瞬时转化方法[7-8]。农杆菌菌液的浓度、菌液培养环境、细胞的基因型和叶片根茎的生理状态对基因瞬时表达都会有影响,实验过程中的温度、光照以及农杆菌菌液的类型也是影响瞬时表达的因素[9-10]。本研究拟在桂花和石楠叶片中探索瞬时表达体系,以期为桂花、石楠以及更多园林木本植物基因功能鉴定奠定基础。
1 材料与方法
1.1 实验材料
本实验采用园林木本植物四季桂和石楠叶片,于2020年4月底采集当年生枝条上的成熟叶片。载体采用携带35S启动子和GUS报告基因的pCAMBIA1391載体。
1.2 实验方法
1.2.1 农杆菌菌液的制备
把准备好的LB培养基分别加在两个消毒的锥形瓶中各5 mL,再用1 000 μL的移液枪各加入1 mL的硫酸卡那霉素(kana)抗生素,挑选培养基平板上单个含有β-葡糖醛酸酶基因(GUS)的菌落和单个含有P19基因的菌落到5 mL LB溶液的锥形瓶中,培养基用完必须密封好并放在4 ℃的条件下保存。将菌液放在恒温振荡器的摇床中在200 r·min-1、28 ℃条件下避光12 h左右过夜。待菌液浑浊,用500 mL的LB培养基加入硫酸卡那霉素溶液放入恒温振荡器的摇床中进行扩大培养,同样在200 r·min-1、28 ℃避光条件下培养12 h过夜。
1.2.2 瞬时侵染
将培养的菌液离心收集,然后用侵染液(10 mmol·L-1 MgCl2、10 mmol·L-1 MES、150 mmol·L-1 AS)悬浮菌液,调整OD600至0.5~1.0,室温静置2~3 h,用于侵染。将四季桂和石楠的叶片分别用8 mm、10 mm的打孔器各打出200个不带叶主脉的圆形小片。把打好的圆形小叶片放入准备好的菌液侵染液,然后放入真空箱,在0.7 MPa真空条件下保持5 min。把侵染的石楠和四季桂分成16组培养,分别用去离子水和5%蔗糖溶液培养,2 d后进行染色,实验各处理编号如表1所示。
1表示只用侵染液,无农杆菌;2表示用侵染液、P19;3表示用侵染液、GUS;4表示用侵染液和P19∶GUS=1∶1,下同1.2.3 GUS检测吸取1 mL X-gluc溶解液加入到X-gluc管中,彻底混匀至完全溶解,即配成X-gluc溶液。将处理好的叶片放入5 mL的离心管中,用配制好的GUS染色工作液完全覆盖材料,用锡箔纸包好后放入恒温振荡器的摇床中在100 r·min-1、37 ℃的条件下培养24 h。将侵染培养的叶片转入无水乙醇中,放入恒温振荡器的摇床中24 h过夜,再用75%的乙醇溶液放在摇床中继续脱水24 h然后用肉眼和显微镜进行观察。
2 结果与分析
2.1 叶片离体瞬时表达结果
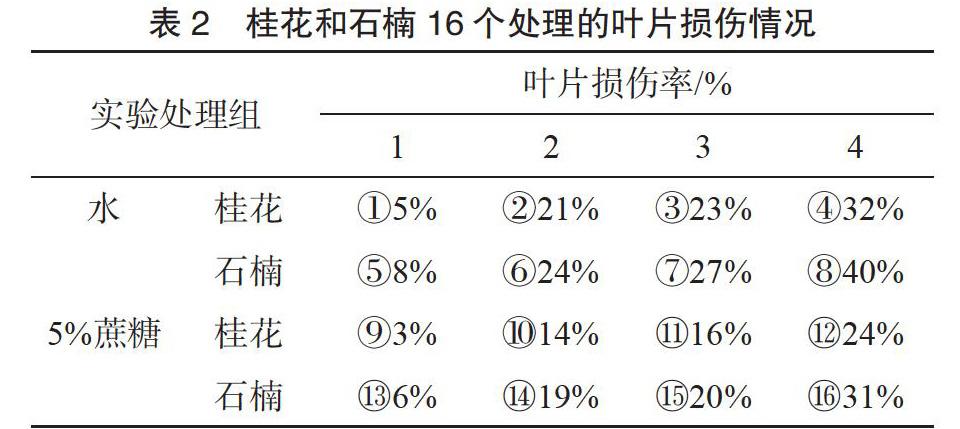
通过图1、图2和表2的比较可以看到桂花和石楠叶片在相同条件下的对比情况。石楠叶片相较于桂花而言木质化程度低,桂花叶片革质化严重。在侵染过程中,石楠相较于四季桂而言,叶片更容易褐化、衰败。另外,离体叶片的培养液选择对于叶片的生理活性有一定影响,从图2可以看出,不同培养条件下,叶片的褐化、衰败情况不同,农杆菌对于叶片有明显损害,凡是进行了农杆菌菌液侵染的叶片都比只用侵染液的叶片褐化、衰败更为严重。P19可抑制外源基因被植物内源免疫系统沉默,提高外源基因瞬时表达效率。但图2对比实验发现,是否加入P19基因对于叶片的损伤差异不大。
2.2 离体叶片GUS染色分析
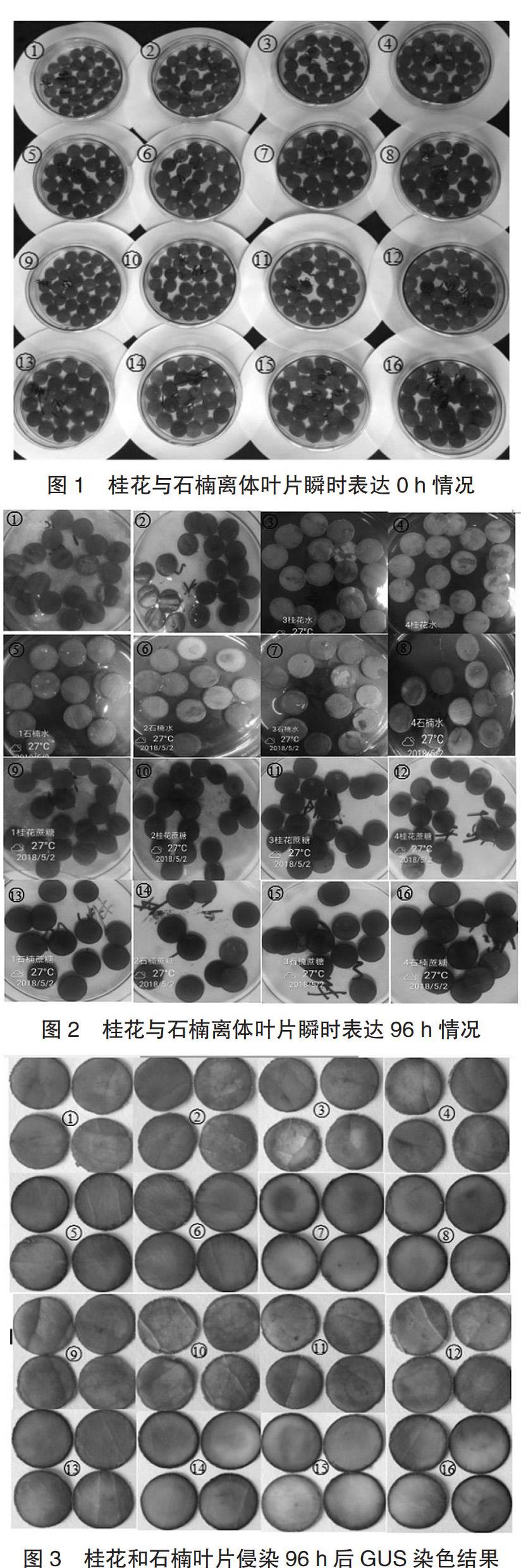
对侵染染色后的桂花和石楠叶片进行观察,如图3所示,未发现明显的蓝色或者淡蓝色斑点或者条纹出现,将16组侵染的叶片在显微镜下观察也没有发现有蓝色斑点或者条纹。未出现蓝色斑点可能是因为外源基因无法表达,也可能是因为外源基因表达十分微少,亦或叶片脱色后呈褐色状态,影响观察效果。因此,后期需要进一步改进和完善实验条件,增加处理因素,以明确影响桂花和石楠瞬时表达效果的原因。
3 结论与讨论
通过对实验现象的观察与分析发现,携带有外源基因的农杆菌会降低石楠和桂花叶片的生理活性,使叶片加速衰败。用去离子水培养侵染过的石楠和桂花叶片会比用蔗糖溶液培养的叶片衰败更快,说明蔗糖可较好保持立体叶片的生理活性。石楠和桂花叶片在用侵染液侵染后的培养过程中发现,石楠相较于桂花更容易受到农杆菌液的损伤,叶片细胞的衰败更明显,而桂花虽然也会受到农杆菌液的影响,但影响相对较小,可能是因为四季桂的叶片革质和木质化程度更高,对于农杆菌液带来的损害起到了一定的缓冲作用。在进行真空侵染时也发现,桂花叶片更难侵入农杆菌液。含有GUS基因和含有P19基因的农杆菌侵染液都会加速桂花和石楠叶片衰败。菌液无法用GUS染液染出蓝色,只有该质粒转化到植物细胞之后,GUS基因才能表达。
侵染4 d后的桂花和石楠叶片经过无水乙醇和75%乙醇两次脱水后无法用肉眼或者在显微镜下观察到明显的蓝色斑点或蓝色条纹,原因可能是多方面的:1)GUS基因无法在桂花和石楠叶片中满足表达条件;2)表达的蛋白质微量,无法用肉眼或者显微镜观察到;3)石楠和四季桂的叶片太厚无法观察;4)叶片褐化造成的颜色遮盖,具体原因还需进一步研究。目前,农杆菌介导的瞬时表达方法已经在烟草、拟南芥、莴苣、番茄、草莓、梨等多种植物中得到应用。虽然本研究没有在直观上检测到瞬时表达的GUS蛋白表型,但也为后续其他园林木本植物瞬时表达体系提供了一参考。
参考文献:
[1] 李军,赵爱春,王茜龄,等.桑树肌动蛋白MaACT3启动子的克隆及农杆菌介导的瞬时表达[J].中国农业科学,2012,45(4):625-632.
[2] 魏桂民,李德文,羅莉斯,等.马铃薯sgt3基因启动子克隆及其功能鉴定[J].甘肃农业大学学报,2016,51(5):32-38.
[3] 倪志勇,吕萌,王娟,等.棉花GhCAD6基因表达载体构建及GUS基因的瞬时表达[J].新疆农业科学,2010,47(1):20-24.
[4] 邱礽,陶刚,李奇科,等.农杆菌渗入法介导的基因瞬时表达技术及应用[J].分子植物育种,2009,7(5):1032-1039.
[5] 杨丽萍,金太成,徐洪伟,等.植物中瞬时表达外源基因的新型侵染技术[J].遗传,2013,35(1):111-117.
[6] 刘雪梅,王蕾,文添龙,等.农杆菌介导的棉花子叶瞬时表达系统的建立[J].植物学报,2014,49(5):587-594.
[7] 麻鹏达,周晓馥,秦波,等.Rubisco小亚基基因片段的亚克隆及其瞬时表达载体的构建[J].分子植物育种,2004(4):527-530.
[8] 韩林林,李俊华,赵喜亭,等.农杆菌介导的怀山药叶片瞬时表达方法的建立[J].河南师范大学学报(自然科学版),2016,44(6):135-139.
[9] 乔利仙,于新玲,隋炯明,等.农杆菌介导的花生遗传转化体系的优化[J].核农学报,2012,26(9):1244-1248,1358.
[10] 陈仲,廖维华,王静澄,等.影响农杆菌介导的杨树遗传转化技术的因素[J].植物生理学报,2014,50(8):1126-1134.
(责任编辑:刘昀)
