液相色谱-高分辨质谱测定贝类中软骨藻酸
2020-08-19吴祥庆余焘吴明媛黄国秋杨姝丽
吴祥庆 余焘 吴明媛 黄国秋 杨姝丽

摘要:软骨藻酸(DA)是一种由拟菱形藻属硅藻产生的神经毒素,可累积在贝类体内,食用受软骨藻酸污染的贝类产品可引起记忆丧失、眩晕、昏迷甚至死亡等症状。研究建立了贝类产品中软骨藻酸的液相色谱-高分辫质谱检测方法。以牡蛎和文蛤为研究对象,样品经甲醇提取、采用QuEChERS净化,经Hypersil GOLD C18色谱柱分离,乙腈和2mmol/L甲酸铵溶液(含0.2%甲酸)为流动相梯度洗脱,正离子全扫描+数据依赖二级扫描,提取一级谱图中准分子离子精确质量数定量,二级质谱图中特征离子精确质量数定性。结果表明,软骨藻酸在6min内出峰,定量限0.01mg/kg,在25~500μg/L线性良好,R2=0.9998,回收率为90.5%~106.3%,相对标准偏差(RSD)小于6.0%(n=6)。该方法简单、快速、灵敏度高,能满足贝类中软骨藻酸的刚定。
关键词:贝类;软骨藻酸;高分辨质谱
中图分类号:O657.6 文献标识码:A
文章编号:0439-8114(2020)09-0159-03
DOI:10.14088/j.cnki.issn0439-8114.2020.09.034
软骨藻酸(Domoic acid,DA)是一种兴奋性神经毒素。软骨藻酸由硅藻门的拟菱形藻属和菱形藻属产生,1958年首次从日本鹿儿岛县的大型藻类树枝软骨藻中分离出。贝类可富集藻类产生软骨藻酸,具有较强的耐受力。而软骨藻酸经食物链富集后,可引起哺乳动物较严重的中枢神经损害。软骨藻酸具有热稳定性,一般的烹饪过程并不能破坏软骨藻酸的毒性。人们食用含软骨藻酸的贝类,可引起记忆丧失、眩晕、昏迷甚至死亡等症状。根据中毒症状,软骨藻酸也被命名为失忆性贝毒。由软骨藻酸引起的中毒没有较好的疗法,无法完全恢复受损的海马结构或空间记忆能力。1987年加拿大爱德华王子岛东海岸发生因食用软骨藻酸污染的紫贻贝中毒事件,造成3人死亡,100多人中毒,其中12人病愈后记忆丧失长达18个月。研究发现,贝类中软骨藻酸含量达到40mg/kg可引起中毒,150mg/kg时有致命危险。产毒藻拟菱形藻广泛分布于全球海水中,中国沿海也有报道,对贝类产品食用安全的威胁不容忽视[1-5]。
检测贝类中软骨藻酸的方法主要有小鼠生物法、毛细管电泳法、薄层色谱法、液相色谱法等[6-10]。其中液相色谱法应用最广,但是背景干扰大、灵敏度较低、选择性不高。液相色谱一质谱联用法具有高选择性和高灵敏度的优点[11-16],本研究采用液相色谱-高分辨质谱对贝类中软骨藻酸进行检测,能够获得目标物的一级、二级精确质量数质谱图,具有很好的定性分析和定量检测效果。由于贝类样品基质复杂,本研究采用QuEChERS技术对提取液进行净化,降低了基质效应,提高了样品分析效率,为软骨藻酸的监测提供了技术支持,为贝类产品食用安全提供了可靠保障。
1 材料与方法
1.1 仪器与试剂
U3000液相色谱,美国赛默飞世尔公司Q Exae-live四极杆一静电场轨道阱高分辨质谱仪,美国赛默飞世尔公司;HM100均质器,北京格瑞德曼公司;Centrifuge 58048离心机,德国艾本德公司;旋涡混合器,美国Talboys公司;Synergy纯水仪,美国密理博公司。
标准品DA(103.4±3.4μg/mL)、CRM-DSP-Mus购自加拿大海洋生物科学研究所;甲醇、乙睛,色谱纯,美国赛默飞世尔公司;甲酸,色谱纯,美国Sigma公司;试验用水由纯水仪制备:C18、GCB、PSA、MgSO4基质分散固相萃取填料,购自上海安谱公司。
贝类产品为近江牡蛎、文蛤,采自钦州七十二泾、大风江贝类养殖区,实验室-18℃保存。
1.2 仪器条件
1.2.1 色谱条件 Hypersil GOLD C18色谱柱(1.9μm,2.1mm×100mm)。流动相:乙腈(A),2mmol/L甲酸铵溶液(含0.2%甲酸)(B)。梯度洗脱:0~1min,30% A:1~3min 30%A~50% A:3~4min 50%A:4.1~6min 30% A。流速0.2mL/min,进样体积5μL,柱温40℃。
1.2.2 质谱条件 离子源为电喷雾离子源(ESI);扫描方式为正离子,一级全扫描+数据依赖二级扫描;喷雾电压3200V;鞘气流量40Arb;辅助气流量10Arb;离子传输管温度320℃;一级扫描分辨率70000;二级扫描分辨率17500,归一化碰撞能量20、40、60eV。
1.3 方法
1.3.1 样品制备 用清水洗净贝类外壳,切断闭壳肌,打开外壳,用纯水冲洗泥沙等异物,取除外壳的全部肌肉和内脏作为试样,沥干后均质。
1.3.2 样品提取、净化准确称取2.00g(精确到0.01g)样品于50mL离心管中,加入9mL甲醇,涡旋混匀0.5min,超声提取10min,8000r/min离心10min,将上清液转移至另一离心管中,残渣再用9mL甲醇重复提取1次,离心后合并上清液,加甲醇至20mL。加入1g MgSO4、150mg C18、150mg GCB,漩涡混合0.5min,8000r/min離心5min,取10mL上清液于50℃下氮吹至近干,用80%甲醇定容至1mL,漩涡混合0.5min,过0.22μm滤膜,待仪器分析。
2 结果与分析
2.1 质谱条件的选择
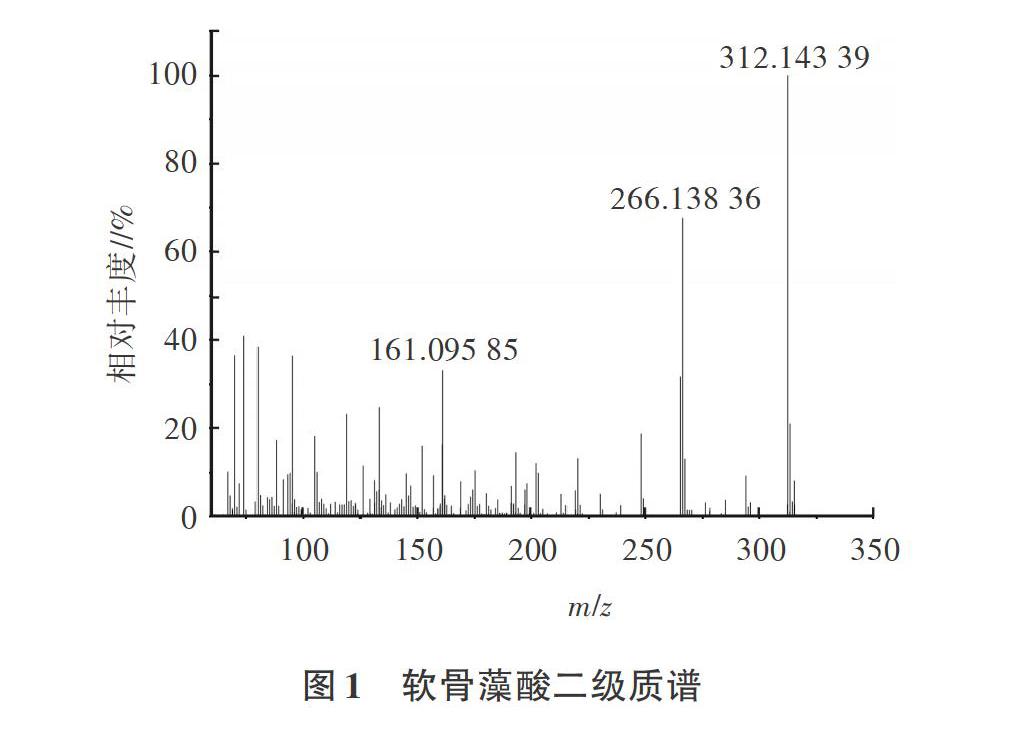
软骨藻酸分子式为C15H21NO6,选择正离子模式下强度最高的[M+H]+作为定量离子,精确质量数理论值为312.14416。当[M+H]+强度达到8×104则触发二级扫描,软骨藻酸强度最高的二级碎片离子为[M-HCOOH+H]+,精确质量数为266.13868,实际测定值为266.13836,偏差0.0012‰,二级质谱见图1。通过高分辨质谱获得母离子和子离子识别点分别为2IN和2.5IPs,因此只需要获得1个母离子和1个子离子,就能满足对目标化合物4个识别点的确证要求。
提取一级全扫描譜图中[M+H]+的精确质量数312.14416定量,二级质谱中碎片离子[M-HCOOH+H]+定性。在相同仪器条件下,样品与标准物质保留时间相对偏差在士5%以内,且检测到[M+H]+、[M-HCOOH+H]+的精确质量数与理论值相对偏差小于0.005‰,可确定为软骨藻酸阳性样品。
2.2 色谱条件的选择
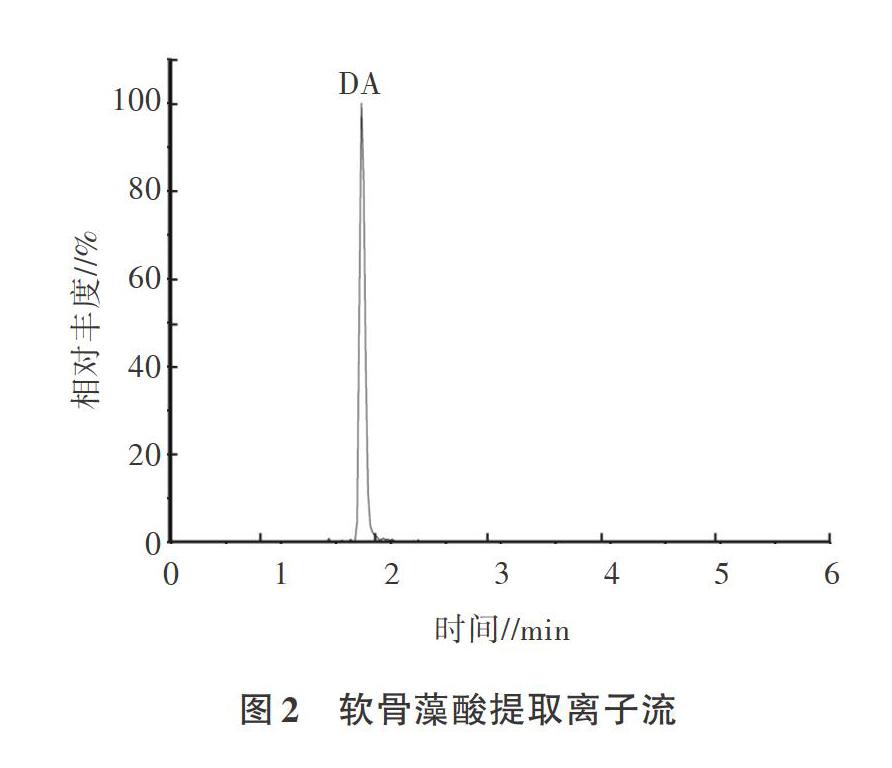
研究选用C18色谱柱,用乙腈和2mmol/L甲酸铵溶液(含0.2%甲酸)进行梯度洗脱,在“1.2.1”的色谱条件下,软骨藻酸在6min内出峰,分析时间短,峰形尖锐,灵敏度高(图2)。
2.3 样品提取、净化条件的优化
2.3.1 样品提取条件的优化本研究根据软骨藻酸的性质及相关文献资料[17-19],通过比较提取前、后加标的回收率,考察了用甲醇、50%甲醇、水的提取率。结果表明,3种提取剂的提取率均能达到90%以上。由于甲醇提取液有利于QuEChERS净化及后续浓缩,因此本研究采用甲醇作为提取剂。
2.3.2 样品净化条件的优化 贝类样品中含有大量脂肪、蛋白质和色素,基质效应大且易污染质谱,需要对提取液进行净化。QuEChERS是一种分散固相萃取技术,将固相萃取吸附剂颗粒分散在样品萃取液中,利用吸附剂与基质相互作用,吸附杂质达到净化目的,广泛应用于药物残留检测[20,21]。本研究通过在基质提取液中加入标准溶液后,再添加不同固相萃取吸附剂净化,比较了C18、GCB、PSA3种常用净化剂的效果。由于软骨藻酸是酸性物质,PSA为碱性吸附剂,对软骨藻酸吸附强,因此回收率较低。单独使用C18固相萃取剂对色素净化效果一般;添加GCB后色素净化效果较好,回收率在80%以上。最终确定2g样品中加入150mg C18、150mg GCB和1g MgSO4。
2.4 线性范围和检出限
为减少净化不完全带来的基质效应,本研究使用基质标准曲线进行定量。取空白基质样品,按“1.3.1”样品处理方法制得基质溶液,在基质溶液中加入标准品配成浓度为25、50、100、250、500μg/L的基质标准溶液,按照“1.2”仪器条件上机测定。以被测组分的峰面积响应值为纵坐标,浓度为横坐标进行线性回归。在25~500μg/L线性良好,R2为0.9998。按照母离子信噪比(S/N)=3、信噪比(S/N)=10确定检出限(LOD)和定量限(LOQ)。DA检出限为0.003mg/kg,定量限为0.01mg/kg,该方法完全可以满足贝类毒素日常检测的需要。
2.5 准确度和精密度
欧盟第853/2004号法规规定软骨藻酸总安全限量值为20mg/kg。对存在最高残留限量(MRL)的物质,加标回收试验一般选择定量限(LOQ)、MRL和2MRL 3个浓度水平进行。本研究选择未检出软骨藻酸的牡蛎和文蛤样品作为基质空白样品,分别添加0.01、20、40mg/kg 3个浓度水平进行加标回收试验。每个浓度水平做6个平行样,结果见表1。结果表明,该方法的回收率和重现性较好。
3 结论
通过QuEChERS技术结合液相色谱一高分辨质谱,能够有效净化贝类样品基质中的各种杂质,快速测定贝类产品中软骨藻酸毒素。该方法简单快速,灵敏度高,线性良好,回收率、精密度均能满足贝类产品中软骨藻酸毒素的限量要求。
参考文献:
[1]王生福,杨傲傲,刘华雪,等.拟菱形藻软骨藻酸产生影响因素及检测方法研究进展[J].中国渔业质量与标准,2019.9(3):34-44.
[2]刘恒.痕量软骨藻酸贝毒的高灵敏分析技术研究及应用[D].福州:福州大学,2017.
[3]王九明,陈军辉,何秀平,等.基于固相萃取膜盘技术分离富集海水中软骨藻酸[J].分析化学,2019,47(7):1075-1081.
[4]阮雯,纪炜炜,岳冬冬,等.贝类生物毒素研究进展[J].渔业信息与战略,2017,32(4):276-280.
[5]王茜,程金平,高利利,等.记忆缺失性贝毒软骨藻酸的污染现状及检测技术[J].安徽农业科学,2011,39(26):16070-16073.
[6]高治臭,林郑忠,陈晓梅,等.贝类产品中软骨藻酸的HPLC检测方法[J].集美大学学报(自然科学版),2015,20(4):255-259.
[7]刘淑娟,赵晓祥,王茜,等.软骨藻酸快速检测方法技术研究[J].上海交通大学学报(农业科学版),2014,32(2):10-14.
[8]李芳,李雪梅,李献刚,等.贝类毒素检测方法研究概况[J].食品研究与开发,2015,36(23):184-186.
[9l顾佳萍,袁涛.赤潮毒素软骨藻酸检测方法研究进展[J].洋通报,2010,29(4):472-477.
[10]卫锋,程日方,宫静宏,等.高效液相色谱法测定贝类中的软骨藻酸[J].色谱,2001(3):248-250.
[11]赵芮,刘磊,刘丽,等.酶联免疫吸附法和液相色谱-质谱联用法分析海洋生物中记忆缺失性贝毒[J]分析试验室,2015,34(8):882-885.
[12]洪专,张怡评,陈伟珠,等.高效液相色谱-串联质谱法测定人血浆和尿液中记忆丧失性贝毒软骨藻酸[J].分析科学学报,2014,30(3):319-322.
[13]陈燕清,陈舜胜,于慧娟,等.液相色谱-串联质谱法测定虾夷扇贝和长牡蛎中软骨藻酸的残留[J].分析试验室,2010,29(12):21-24.
[14]宋琍琍,张海琪,侯镜德,等.液相色谱-串联质谱法测定贝类毒素软骨藻酸的残留[J].水产学报,2008,32(6):950-956.
[15]卫锋,赵守成,李大志.液相色谱-电喷雾离子阱质谱法测定贝类中软骨藻酸[J].分析测试学报,2004(S1):220-222.
[16]方晓明,卫峰,范祥,等.液相色谱/四极杆-飞行时间质谱测定失忆性贝毒的研究[J].分析测试学报,2004(S1):240-241.
[17]王蝉,赵永拓,彭心婷,等.QuEChERS法联合高效液相色谱法快速检测扇贝中的软骨藻酸[J].食品安全质量检测学报,2015,6(1):72-77.
[18]柴继业,王琳,赵巧灵,等.固相萃取-超高效液相色谱-串联质谱法同时测定贝类产品中脂溶性贝类毒素[J].宁波大学学报(理工版),2018,31(3):65-71.
[19]吴海燕,郭萌萌,赵春霞,等.液相色谱-串联质谱法筛查原多甲藻酸毒素及其代谢产物[J].色谱,3016,34(4):401-406.
[20]刘青,曾广丰,王志元,等.QuEChERS净化技术结合高效液相色谱-串联质谱法测定食用贝类产品中4种脂溶性贝类毒素[J].现代食品科技,2015,31(12):338-344.
[21]曾广丰,刘青,王志元,等.QuEChERS法结合高效液相色谱-高分辨飞行时间质谱测定食用贝类产品中4种脂溶性贝类毒素[J].食品工业科技,2015,36(21):289-294.
收稿日期:2020-02-18
基金项目:广西重点研发计划项目(桂科AB16380290)
作者简介:吴祥庆(1977-),男,广西玉林人,副研究员,主要从事水产品检测技术研究工作,(电话)13878602255(电子信箱)wuxiangqing19@163.com;通信作者,杨妹丽,高级工程师,硕士,主要从事水产品检测技术研究工作,(电话)13878178627(电子信箱)13878178627@qq.com。
