阳离子交换皂石黏土在基质辅助激光解吸电离飞行时间质谱分析中的应用
2020-08-17丁宇琦朱价周霞罗金文
丁宇琦,朱价,周霞,罗金文
(浙江省食品药品检验研究院,浙江杭州310012)
糖类化合物是自然界中分布很广的一类重要化合物,在生命体的代谢组学和营养学等中扮演着极其重要的角色,是一切生命体维持生命活动所需能量的最主要来源[1]。 然而,持续的高血糖会导致多尿、多饮、多食和体重减轻等,最终造成各身体组织的慢性损害和功能障碍(糖尿病患者的主要症状)。 目前我国对糖尿病的诊断依据是1999 年世界卫生组织颁布的标准,主要根据空腹和餐后的血糖量进行综合判定。 因此,快速准确地测定血液和血浆中的糖类化合物(尤其是单糖)含量,对于精确诊断糖尿病有重要意义。
糖类化合物难挥发、热不稳定,其中多糖还具有相对分子质量分布发散的性质,其质谱表征比较困难。为此,科研工作者做了大量研究[2],现有文献报道的糖类检测技术主要有:高效液相色谱法(HPLC)、离子色谱法(IC)、薄层色谱法(TLC)以及气相色谱-质谱联用法(GC-MS)等。例如LIU 等[3]利用亲水液相色谱技术分离了地黄中的9 种糖类化合物;ZHANG 等[4]用苯硼酸解吸电喷雾离子化法检测糖类;FUZFAI 等[5]将气相色谱串联离子阱质谱技术用于各种糖类中的三甲基硅烷基及其肟衍生物的特征裂解规律分析。 以上技术虽然比较成熟,但均存在不足,例如:气相色谱法需要对不易挥发的糖类进行衍生化处理,费时费力;薄层色谱法分离效果差,操作时间长,难以准确定量;液相色谱法多采用示差折光检测器,灵敏度低,易受环境影响,重复性差;而离子色谱法则需要高性能的阴离子交换柱。
MALDI-TOF-MS 是一种新型的软电离技术,具有许多优点。首先,检测结果几乎不受污染物和杂质影响,由于离子化效率很高,可分析一些较难电离的样品,得到完整的电离产物;其次,样品前处理方法非常简单,甚至可以直接分析未处理的生物样品,仪器操作也很容易。 相较传统检测技术,MALDI-TOF-MS 技术具有分辨率高、操作简便、快速准确、质量分析范围大、能够直接分析非衍生化物质等优点,并可测定精确分子量,定性准确度高。 因此,该技术已被广泛应用于多肽、聚合物、聚核苷酸等生物大分子物质分子量的测定及蛋白质高通量的鉴定。 但将该技术应用于糖类的研究报道较少,且主要集中于糖蛋白中的糖链分析、大分子多糖精确分子量的测定等[6-8],对小分子糖类化合物的研究尚处于探索阶段。 PARK 等[9]用常规有机基质二羟基苯甲酸(DHBA)及MALDI-TOF-MS 技术分析了啤酒中的寡糖,结果表明,在溶剂中添加阳离子化试剂有利于糖类的离子化,但未对离子化过程和基质的工作原理进行探讨;NIMPTSCH 等[10]同样将 DHBA 作为基质,利用MALDI-TOF-MS 技术进行了黏多糖和低聚糖硫酸盐的检测;刘悦玫等[11]利用MALDI-TOF-MS 技术进行了复杂糖一致性研究;裴兴丽等[12]以DHBA 为基质,利用MALDI-TOF-MS 技术对大豆食品中寡糖成分进行了成像分析。这些文献仅提出寡糖类化合物的检测方法,未涉及小分子糖类化合物,其主要原因是在解吸过程中同时发生基质本身的离子化和碎裂,对图谱的解析困难较大,难以判断某个峰是来源于基质还是分析物,从而大大限制了MALDI-TOF-MS技术在小分子糖类化合物领域的应用,特别是针对未知化合物的分析。 因此,引入无基质的激光解吸电离技术(matrix-free techniques)[13]、对传统有机基质进行修饰(例如通过加入基质添加物形成复合基质)[14]、制备新型无机基质(例如 Au,Ag 等纳米材料)[15]等成为攻克上述难题的关键。
由于硅酸盐层之间的相互作用力较弱,皂石黏土很容易在水中膨胀形成溶凝胶,另外,黏土还有较强的阳离子交换和分子嵌入能力,在多个领域已有广泛应用[16-17]。 在化学领域主要作为催化剂[18]以及纳米复合材料的载体[19],在MALDI-TOF-MS 技术中尚未见应用。 本文选取一种人工合成的蒙脱石皂石黏土,并将有机基质THAP 成功嵌入经阳离子交换后的皂石黏土的晶面间隙中,形成复合基质,用于糖类化合物的分析。结果表明,由于受该复合基质晶面间距的限制,仅能使部分小分子糖类化合物离子化,具有小分子选择性。方法操作简便、分析效率高、经济成本低。
1 试验部分
1.1 仪器设备和试剂
MALDI-TOF-MS 配有 337 nm 波长的氮气激光(Waters 公司);黏土(Sumecton SA)由日本Kunimine 材料实业公司提供;2,4,6-三羟基苯乙酮(THAP,168 Da)、多肽物质 P(SubP)购自德国CNW 公司;葡萄糖(D-glucose,Glu)、半乳糖(D-galactosel)、纤维二糖(D-cellobiose)、棉子糖(D-raffinose)、麦 芽 六 糖(Maltohexaose)、麦 芽 七 糖(Maltoheptaose)、环糊精(γ-cyclodextrin)均购自上海安谱实验科技股份有限公司;乙腈(色谱纯)购自Merk 公司;试验用水为Milli-Q 超纯水。
1.2 仪器参数
激光能量约8 μJ,激光射速10 Hz,正离子反射模式下加速电压17 kV,延迟时间500 ns。
1.3 分析物前处理
Na+交换的黏土(NaSm):将 0.1 mol CH3COONa 溶于50 mL 水中,待完全溶解后与500 mg 黏土混合形成悬浊液,在70℃下搅拌1 h,用0.2 μm 滤纸过滤,去除溶液;在沉淀物中再加入相同体积和浓度的CH3COONa 溶液,重复反应3 次,将最终的沉淀物冷冻干燥过夜。
复合基质:分别称取4 mg THAP 基质和一定量的 NaSm(THAP 和 NaSm 的质量比分别为4∶0.25,4∶0.5,4∶1),加入体积比为 7∶3 的乙腈和水溶剂1 mL,保持每份溶液中THAP 的浓度为4 mg·mL-1,超声溶解 15 min,并称取 4 mg THAP 按上述方法配成纯基质溶液进行对比实验。
分析物制样:称取分析物0.1 mg,用上述溶剂充分溶解并稀释至浓度为1 μg·mL-1,分别移取相同体积的复合基质溶液和分析物溶液,超声混合30 min,取2 μL 混合液滴至不锈钢样品板上,置于空气中使溶剂自然挥发,最后将样品板置入MALDI仪器检测。
2 结果与讨论
2.1 Glu 质谱分析结果
葡萄糖是自然界分布最广且最为重要的一种单糖,是活细胞的能量来源和新陈代谢的中间产物,是生物的主要供能物质。 由THAP 和NaSm 组成的复合基质(THAP-NaSm)应用于Glu 分析的实验结果如图1 所示(纵坐标为优化后的相对强度,各质谱图相对强度的坐标范围一致,下同)。 由于Glu 极性较强,在常规质谱条件下质子化非常困难,因此无法观察到[Glu+H]+峰,而Na+、K+等碱金属离子与Glu 有较强的结合能力,使得Glu 的离子化峰可以以碱金属加和峰形式呈现。 图1(a) 为以THAP 单独作为有机基质测定的Glu 质谱图。 由图1(a)知,仅以THAP 作为基质对葡萄糖进行检测,基质的Na+加和的离子化峰([THAP+Na]+)并不明显,更无法观察分析物的离子化峰(信噪比:S/N=6,R=0.25),说明THAP 并不适合作为葡萄糖的分析基质,而加入NaSm 形成复合基质后,离子化峰有明显增强。图1(b)为用复合基质(THAP 和NaSm 的质量比为4∶0.25)后测得的质谱图,相较图1(a),分析物的离子化峰([Glu+Na]+信号)强度增强了约35倍(S/N=210,R=0.63),分析物的离子化效率显著增强,[THAP+Na]+信号的强度增强了约4 倍。当继续增加 THAP 和 NaSm 的质量比至 4∶0.5 时,[Glu+Na]+的信号强度增强了约100 倍(S/N=590,R=0.83),并且可以清晰地观察到[Glu-H+2Na]+峰,如图1(c)所示。当继续提高THAP 和NaSm 的质量比至4∶0.75 和4∶1 时,绝大部分化合物离子化峰的信号强度出现大幅下降,如图1(d)和(e)所示,这是因为当混合过多的NaSm 后,激发区的基质浓度被稀释,从而导致离子化效率降低。 显然,组成复合基质的THAP 与NaSm 存在一个最优的质量比。
为了确定图1(b)和(c)中峰信号的增强是由添加NaSm 所致,用 NaCl 取代NaSm,形成质量比为4∶0.5 的 THAP-NaCl 复合基质,再进行葡萄糖质谱分析,结果见图1(f)。 相较图1(c),在图1(f)中未见离子化峰信号增强,因此,推断NaSm 不仅可以作为高效的Na+源,还可显著促进分析物和基质的解吸效率。
2.2 多肽物质P(Sub P)的质谱分析结果
多肽物质P 是一种广泛分布于神经纤维内的神经肽,随着MALDI 技术的发展,包括THAP 在内的各种常用有机基质已广泛应用于多肽分析。由于多肽物质P 比糖类物质容易离子化,因此,即使不进行基质修饰,仅以THAP 作为基质仍可观察到非常明显的离子化峰,如图2(a)所示。然而,在混入NaSm形成复合基质后,分析物的质谱峰不仅没有增强,反而显著下降,如图2(b)所示,说明在对分子质量较大的多肽物质进行分析时,复合基质并没有表现出类似于对糖类化合物分析时的卓越性能。基于以上分析,推测分析物的相对响应值可能与分子大小有关;分子直径大于THAP-NaSm 晶面间距的化合物无法有效进入复合基质的晶面间隙与分布在晶面内的基质接触,使得其无法有效离子化,从而导致质谱响应大幅下降。因此,所提出的分析方法对糖类分子具有分子尺寸选择性。

图2 以THAP(a)和THAP-NaSm(b)作为基质的多肽物质P 的质谱图Fig.2 Mass spectra of Sub P measured with THAP(a)and THAP-NaSm(b)as the matrix
2.3 验证实验
2.3.1 X 射线衍射(XRD)分析
粉末X 射线衍射(XRD)是评估基质添加物内部晶体结构的重要表征手段,本研究测定了Sm,NaSm 和 THAP-NaSm 的 XRD 图谱,分别计算了不同添加物的晶面间距,结果如表1 所示。显然由于THAP 的嵌入,NaSm 的晶面间距变大了。
2.3.2 混合晶体制备方法对比
除了超声搅拌混合制样法外,还考察了另外2种混合制样法,即将THAP-NaSm 与Glu 以机械搅拌的方式以及涡旋振荡1 h 的方式分别进行混合处理,之后制备样品板(除混合方式不同外,其余步骤均相同),质谱结果见图3。对比图3(a)和图1(a),两者所有峰([Glu+Na]+,S/N=12)的响应都基本一致,可知以机械搅拌方式制备的复合基质无任何效果;涡旋振荡1 h 制备的复合基质在离子化效率上有一定提升,分析物的质谱峰([Glu+Na]+,S/N=180)提升了约15 倍,大致相当于图1(b)的结果,仅相当于图1(c)分析物响应的1/3。由于 THAP 主要嵌入NaSm 的晶面间隙内,而机械搅拌和涡旋振荡方式无法使Glu 有效进入NaSm 的晶面间隙,因此用这2 种方式制备的复合基质离子化效率较低。

表1 Sm,NaSm 和 THAP-NaSm 的 XRD 分析结果Table 1 XRD measurements for Sm,NaSm and THAPNaSm
2.3.3 不同分析物对比
为了验证对分子尺寸具有选择性的假设,选择了 6 种常见的碳水化合物:半乳糖(galactose, 单糖)、纤维二糖(cellobiose, 双糖)、棉子糖(raffinose,三糖)、麦芽六糖(maltohexaose, 六糖)、麦芽七糖(maltoheptaose, 七糖)、γ-环糊精(cyclodextrin, 八糖)作为分析物,并用THAP-NaSm 作为复合基质
进行分析,质谱结果如图4 所示。所有图谱中基质的相关离子化峰的响应几乎一致,但是分析物相关离子化峰的响应则随单糖单元聚合数的增多而明显降低,其中γ-环糊精拥有8 个单糖单元,其相关离子峰仅勉强可见。SUZUKI 等[20]采用THAP 和丝光沸石(LiM20)作为复合基质,成功检测出了麦芽六糖。 其结果显示,分析物和基质的相关离子化峰大致相当,说明不同糖类化合物之间的理化性质差异并不是引起图4 所示的分析物响应下降的主要因素。由图5 可知,化合物峰离子与基质峰离子的丰度比([M,analyte+Na]+/[matrix+Na]+)随糖类化合物直径(根据范德华假设计算)的增大呈指数下降,说明大分子糖类化合物很难进入复合基质的晶面间隙,无法与THAP 充分接触及相互作用,导致离子化效率降低。因此,糖类化合物的分子直径大小是导致质谱响应值变化的主要因素。而THAPNaSm 复合基质对小分子糖类化合物的检测具有较强的选择性。

图3 分析物混合晶体的质谱图Fig.3 Mass spectra of Glu subjected to different analyte/matrix preparation methods
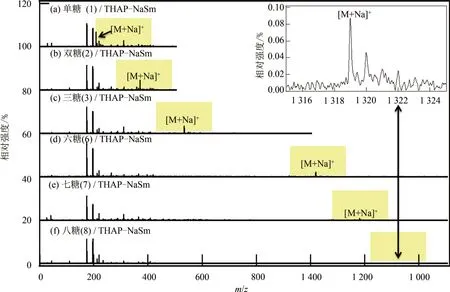
图4 复合基质测得的糖类化合物质谱图Fig.4 Mass spectra of various saccharides measured with THAP-NaSm
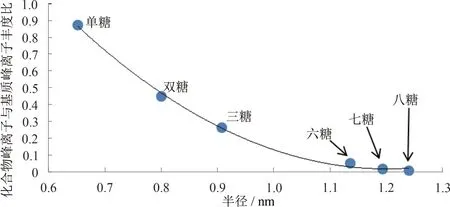
图5 化合物峰离子与基质峰离子丰度比随糖类化合物直径的变化曲线Fig.5 Relationship between peak intensity ratio([M,analyte+Na]+ /[matrix+Na]+)and diameter of saccharides
3 结 论
将蒙脱石皂石黏土应用于MALDI-TOF-MS技术,将传统的有机基质THAP 插入经阳离子交换后的皂石黏土晶面间隙中,制备成新型的复合基质,并将其应用于糖类化合物的检测。由于受复合基质晶面间距的限制,只有小分子糖类化合物能进入晶面间隙充分接触有机基质并被离子化,从而实现对小分子糖类化合物的选择性检测。
