蜂蜜中氯霉素残留量的不确定度评定
2020-08-12杨涛,袁辉
杨 涛,袁 辉
(新疆产品质量监督检验研究院,新疆 乌鲁木齐 830011)
蜂蜜因含有丰富的果糖、葡萄糖、多种维生素、有机酸等对人体有益的矿物质,被誉为大自然中最完美的营养食品。氯霉素是一种强力抗生素,能有效控制蜂群感染,减少蜜蜂死亡情况,但如果过量使用氯霉素,会导致部分氯霉素在蜂蜜中残留。氯霉素作为一种广谱高效抗生素,有严重的副作用,它人类的毒性较大,因此,中华人民共和国农业部公告第235号《动物性食品中兽药最高残留限量》中严格规定动物性食品中氯霉素不得检出。目前,蜂蜜中氯霉素的检测标准主要有:微生物法、酶联免疫法、气相色谱-质谱法、液相色谱-串联质谱法。目前报道的有关蜂蜜中氯霉素残留量不确定度评定主要依据SN/T 1864-2007 《进出口动物源食品中氯霉素残留量的检测方法 液相色谱-串联质谱法》[1],而国内大多数检测机构采用的检测方法是GB/T 18932.19-2003 《蜂蜜中氯霉素残留量的测定方法 液相色谱-串联质谱法》[2],本文作者结合前期不确定度研究成果[3],现根据此检验方法分析蜂蜜中氯霉素残留量不确定度的来源。
1 实 验
1.1 原 理
用乙酸乙酯提取其中的待测组分,浓缩后用水溶解并过HLB小柱净化,液相色谱-串联质谱仪测定,外标法定量。
1.2 主要仪器与试剂
TSQ GUANTIS高效液相色谱-质谱/质谱仪,美国thermofisher公司;电子天平(感量0.1 mg,感量0.01 g),德国Sartorius公司;固相萃取装置,美国J2 Scientific公司;离心机,上海安亭。
氯霉素标准品(99%),德国 Dr公司;乙腈、甲醇、乙酸乙酯(色谱纯),德国默克公司;其它试剂为分析纯;超纯水由美国millipore纯水仪制得;蜂蜜样品为市场中购买。
1.3 检测方法
1.3.1 提 取
准确称取5 g 试样(精确到0.01 g)于50 mL 离心管中,加入5 mL 水,摇匀使其溶解;加15 mL乙酸乙酯提取,离心后准确吸收取12 mL乙酸乙酯溶液进行浓缩,尽干,用5 mL 水溶解待净化。
1.3.2 净 化
用5 mL乙酸乙酯洗脱。洗脱液在50 ℃下用氮吹仪浓缩至近干,用1 mL乙腈水溶液(2+8)溶解残渣,用0.22 μm滤膜过滤后上仪器测定。
1.3.3 色谱条件
流动相为乙腈:水溶液(2∶8),流速0.3 mL/min,柱温40 ℃,进样量:5 μL。质谱条件:电喷雾负离子模式,多反应监测模式(MRM)。
1.4 不确定度来源及数学模型
根据检验方法,不确定度主要来源如下:一是标准溶液引入的不确定度,包含标准品纯度、称量、标准溶液配制以及标准曲线拟合等分量;二是样品前处理过程引入的不确定度,包括样品的称量、定容以及待测组分提取回收率等分量。
依据标准检验方法和评估指南[4]本试验中氯霉素计算数学模型为:
式中:X——试样中氯霉素的含量,μg/kg
m——试样质量,g
V——试样提取液总体积,mL
c——从标准曲线上测得样品中氯霉素的质量浓度,ng/mL
f——样品中待测组分回收率,%
2 不确定度评定
2.1 标准溶液引入的不确定度
2.1.1 标准品纯度引入的不确定度
根据标准品证书提供的内容,氯霉素纯度大于99%,按照矩形分布,其相对不确定度为:
2.1.2 标准品称量引入的不确定度
当称取氯霉素标准品10 mg时所使用的天平最大允许误差为±0.1 mg,按照矩形分布,其相对不确定度为:
urel(s) =0.058/10=0.0058
2.1.3 标准溶液稀释配制过程中由移液器和玻璃量器引入的不确定度
系列标准溶液的稀释配制要使用不同规格的移液器和玻璃量器,依据JJG 646-2006《移液器检定规程》[5]、JJG 196-2006《常用玻璃量器检定规程》[6],其引入的不确定度见表1。

表1 校准玻璃量器和移液器引入的不确定度
根据表1中的数据,结合各自使用的次数,则移液器和玻璃量器引入的相对不确定度为:
2.1.4 标准溶液稀释过程中温度引入的不确定度
在标准溶液稀释配制过程中,环境温度控制在(20±2)℃,标准溶液是用乙腈稀释配制,其在20 ℃时的膨胀系数为1.37×10-3mL/℃,依据矩形分布,移液器和玻璃量器由于温度校准引入的不确定度见表2。
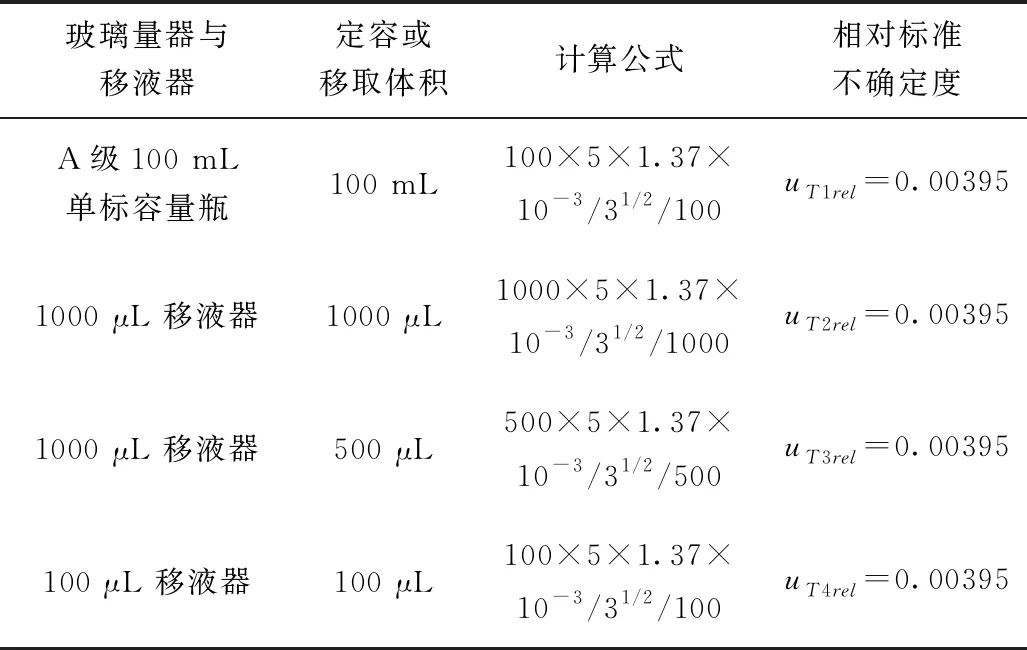
表2 温度校准引入的不确定度
由表2中的数据结合使用次数,由于温度变化引入的相对不确定度:
2.1.5 最小二乘法拟合标准曲线的不确定度
将标准溶液稀释为1、2、5、10、20 ng/mL五个梯度浓度,每个浓度上机测定3次,即n=15,采用最小二乘法对标准溶液浓度/平均峰面积对应的曲线拟合,得到其相对不确定度。标准溶液系列质量浓度与对应峰面积的数据见表3。
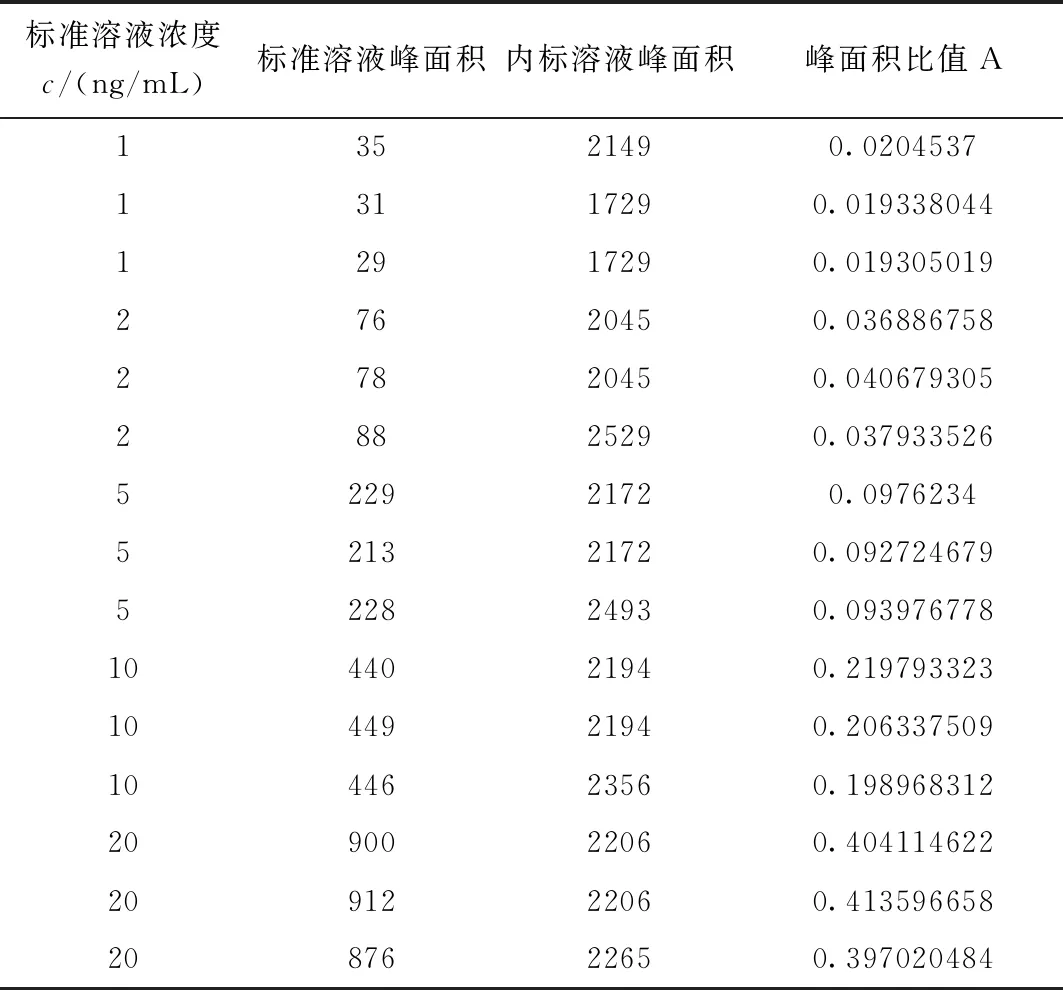
表3 液相色谱-串联质谱法测定氯霉素的标准曲线数据
对样品处理液中的氯霉素共测量6次,即p=6。测得样品处理液中氯霉素的平均含量为x=9.3163 ng/mL。于是由最小二乘法拟合标准曲线所引入的不确定度u(q)为:
其中:

标准曲线拟合引入的相对不确定度为:
urel(q)=u(q)/x=0.0402
因此,在标准溶液配制测定过程中,各分量合成的不确定度为:
2.2 样品前处理过程引入的不确定度
2.2.1 样品称量过程引入的不确定度
当称取蜂蜜5.00 g时,其所使用的天平允许最大误差为±0.01 g,根据矩形分布,其相对不确定度为:
urel(m)=0.00577/5.00=0.00115
2.2.2 样品前处理过程体积引入的不确定度
样品前处理过程中使用15 mL单标线吸量管1次,10 mL单标线吸量管1次,1 mL单标线吸量管1次,样品前处理过程引入的相对不确定度见表4。
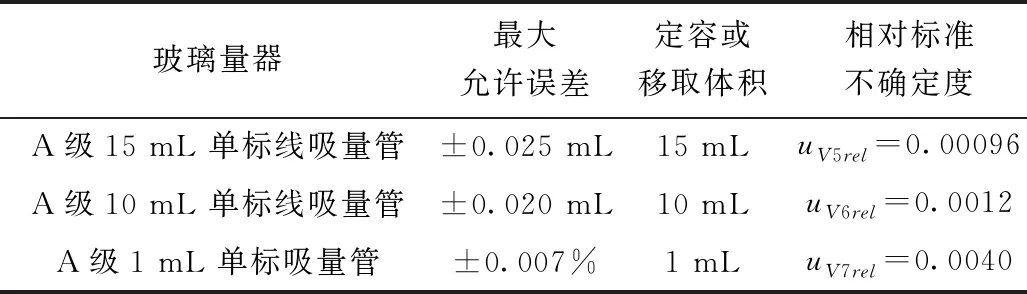
表4 样品前处理过程中玻璃量器引入的不确定度
由表4中的数据,合成前处理过程中玻璃量器引入的相对不确定度为:
2.2.3 样品前处理回收率引入的不确定度
对阴性样品添加10 ng/mL的氯霉素,进行6次加标回收实验,回收率分别为92.9%,93.3%,92.9%,92.7%,93.8%,93.1%,平均回收率为93.16%,相对标准偏差为0.392%,则由回收率引入的相对不确定度为:
urel(f)=0.00392
2.3 不确定度合成
2.3.1 标准不确定度合成
由以上分析过程各相对不确定度分量见表5。

表5 各相对不确定度分量汇总表
由上述各不确定度分量的数据合成标准不确定度为:
2.3.2 扩展不确定度
依据JJF 1135-2005《化学分析测量不确定度评定》[7],在95%的置信水平下,取k=2,蜂蜜样品中氯霉素的测量值为9.3163 ng/mL,结合前处理过程,计算得到样品中氯霉素的含量为2.79 μg/kg,则扩展不确定度为:
U=2.79×0.0502×2=0.280 μg/kg
2.3.3 不确定结果
按照该方法测定蜂蜜中氯霉素的结果为:X=(2.79±0.28) μg/kg,k=2。
3 结 论
根据实验过程,对蜂蜜中氯霉素残留量测定的不确定度来源进行了评定,评定结果表明:影响的主要因素是采用最小二乘法标准曲线拟合对氯霉素质量浓度的影响,而样品称量、前处理过程中等引入的不确定度基本可忽略不计。因此建议在采用该方法的检测过程中,要对标准溶液配制步骤以及标准曲线拟合过程进行强化控制,使检测结果准确有效。
