芫花水提取物对斑马鱼成鱼及SD大鼠肝毒性的相似性评价及作用机制初探
2020-08-07韩沁邹迪新李二文李芝奇徐玥赵崇军林瑞超
韩沁 邹迪新 李二文 李芝奇 徐玥 赵崇军 林瑞超
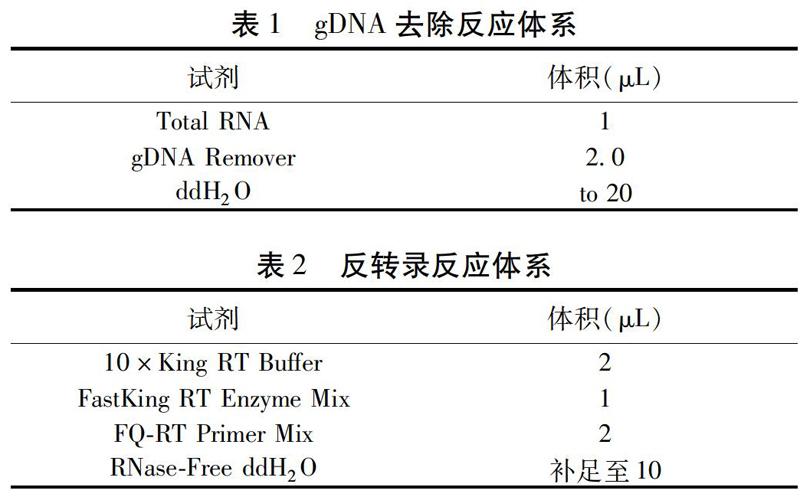

摘要 目的:比較芫花水提取物对斑马鱼成鱼及SD大鼠肝毒性作用的相似性,并初步探讨芫花肝毒性作用机制。方法:选取斑马鱼成鱼320条,分为32组,每组10条(雌:雄=1:1),设置高、中、低剂量组和空白对照组,暴露处理96 h。SD大鼠24只,分为4组,每组6只,设置高、中、低剂量组和空白对照组,按照2.5 mL/200 g体质量每日灌胃给药1次,连续7 d。在实验终点,将斑马鱼成鱼和大鼠处死并获取肝脏组织。通过病理组织切片观察其肝脏形态,以SOD、SDH、MDA、NOX、TG、ALT和AST等生化指标为毒性评价指标。在此基础上通过实时荧光定量PCR测定斑马鱼成鱼肝脏相关基因的表达情况。结果:病理组织切片显示,芫花处理能够引起斑马鱼成鱼肝脏细胞变形、空泡,甚至凋亡,同时,芫花能够引起大鼠肝脏细胞排列松散、空泡、形态皱缩、界限不清晰,细胞核形态成不规则状并伴有出血现象.生化测定结果表明,芫花处理组斑马鱼成鱼肝脏中SOD、SDH及NADH的酶活力均显著降低(P<0.05),而MDA含量上升(P<0.01);给药组大鼠肝脏中SOD、SDH的活力均显著下降(P<0.05),而MDA、TG含量升高(P<0.01),此外,低剂量给药组大鼠ALT活力显著性升高(P<0.05),所有给药组中AST活力均有所升高(P<0.01)。qRT-PCR结果显示,斑马鱼肝脏组织中线粒体功能相关基因mtatp6,mtco1,mtnd1,pklr表达水平下调(P<0.01),氧化应激相关基因gstp2,nqo1,sod1的mRNA表达水平下调(P<0.01),内质网应激相关基因包括atf4a,ern1,hsp90b1的mRNA表达水平上调(P<0.01),自噬相关基因beclin-1和ATG3表达水平下调(P<0.01)。结论:芫花水提取物对斑马鱼成鱼及SD大鼠肝脏均产生毒性作用,其作用机制可能为芫花能够诱导斑马鱼肝脏组织中出现氧化应激损伤、线粒体功能障碍、内质网应激和细胞自噬,进而诱导肝脏细胞凋亡实现的。
关键词 芫花;水提取物;斑马鱼;大鼠;肝毒性;基因表达
Abstract Objective:To compare the similarity of hepatotoxicity effects of water extract from Genkwa Flos in adult zebrafish and SD rats,and to explore the action mechanism of hepatotoxicity effects of Genkwa Flos.Methods:A total of 320 adult zebrafish were divided into 32 groups(10 in each group,female:male=1∶1).High,medium and low dose groups and the blank control group were set up,which were exposed for 96 hours.24 SD rats were divided into 4 groups(6 in each group).The rats of high,medium,low dose group and the blank control group were administered once a day at a dose of 2.5 mL/200 g for 7 consecutive days.The adult zebrafish and rats were then sacrificed at the end of the experiment and liver tissues were collected.The liver morphology was observed through pathological tissue sections.SOD,SDH,MDA,NOX,TG,ALT,AST were used as indicators of toxicity assessment.Based on that,the expressions of apoptosis-related gene in the liver were detected by real-time quantitative PCR.Results:Pathological tissue sections showed that Genkwa Flos could cause deformation,vacuoles,and even apoptosis of the liver cells of zebrafish.At the same time,the water extract from Genkwa Flos could cause loosely arrangement,vacuoles,morphological shrinkage,unclear boundaries,irregular nucleus morphology with hemorrhage of the liver cells of rats.The activity of SOD,SDH and NADH in the liver of adult zebrafish was significantly decreased(P<0.05),while the activity of MDA was increased(P<0.01).The result of biochemical indexes showed that the activity of SOD,SDH in the liver of rats was significantly decreased(P<0.05),while the activity of MDA,TG was increased(P<0.01).In addition,the activity of ALT was significantly increased(P<0.05)in low dose group,and the activity of AST was increased(P<0.01)in all drug-administered group.The result of qRT-PCR showed that the expression of genes involved in mitochondrial function(mtatp6,mtco1,mtnd1,pklr)was decreased(P<0.01)in the liver of zebrafish,the mRNA expression of genes involved in oxidative stress(gstp2,nqo1,sod1)was decreased(P<0.01),the mRNA expression of genes involved in endoplasmic reticulum stress(atf4a,ern1,hsp90b1)was increased(P<0.01),the mRNA expression of genes involved in autophagy(beclin-1,ATG3)was decreased(P<0.01).Conclusion:The water extract of Genkwa Flos has a toxic effect on the liver of zebrafish adults and SD rats.The mechanism may be that Genkwa Flos can induce oxidative stress damage,mitochondrial dysfunction,endoplasmic reticulum stress and zebrafish liver tissue.Cell autophagy,in turn induces liver cell apoptosis.
Keywords Genkwa Flos; Water extract; Zebrafish; Rat; Hepatotoxicity; Gene expression
中图分类号:R285.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2020.13.005
芫花,为瑞香科植物芫花Daphne genkwa Sieb.et Zucc的干燥花蕾,性苦、辛,温,归肺、脾、肾经[1],为传统的泻下逐水药,现代药理学研究表明芫花在镇咳祛痰、引产、杀虫、抗炎抗肿瘤、调节免疫功能等方面有较好疗效[2]。尽管如此,临床应用和临床前安全性研究报道的肝毒性大大限制了其广泛的应用。此外,关于芫花的毒性作用研究相对较少,研究内容不够深入,毒性机制尚不明确,在安全范围内缺乏大量的数据支撑其临床安全使用。
斑马鱼除了繁殖快、成本低、高通量、实验周期短等独特优势外,其还具有与哺乳动物的遗传、生理和解剖同源性高的特征[3]。因此,斑马鱼在毒性评价中具有良好的预测和评价能力。在国外已广泛应用于药物毒理性的筛选与评价[4],国内基于斑马鱼模型的中药安全性研究也正日益兴起[5-8]。前期我们已经利用斑马鱼对芫花的肝毒性进行初步探讨[9],但是,斑马鱼和传统模型在中药肝毒性响应中是否存在相似性尚缺乏系统的支撑数据。
因此,本文以芫花为研究对象,分别选取斑马鱼成鱼及SD大鼠为研究模型,探讨芫花水提取物对斑马鱼模型和传统的SD大鼠模型的肝脏毒性作用,比较斑马鱼模型与传统体内啮齿类动物模型在芫花肝脏毒性响应的相似性,为确认斑马鱼模型在中药肝毒性快速评价中的适用性提供参考依据,在此基础上,利用现代分子生物技术初步探讨芫花的肝脏毒性作用机制,以利于未来针对芫花炮制配伍减毒以及药物深入开发和广泛应用提供研究基础。
1 材料与方法
1.1 材料
1.1.1 动物 斑马鱼亲本购于中国科学院武汉水生生物研究所,实验所用斑马鱼(AB-type)由本实验室循环养殖系统繁育。斑马鱼的养殖繁育参照Zebrafish Book[10]。实验操作遵循OECD标准。养殖条件:水温(28±0.5)℃,pH值7~7.2,电导率450~550 μs/cm,黑暗/光照周期为10 h/14 h,每日喂食丰年虾幼虫3次。SD大鼠(雌雄各半,体质量180 g左右),购自斯贝福(北京)生物技术有限公司,合格证编号:11401500056003,饲料与垫料均由斯贝福(北京)生物技术有限公司提供。饲养于屏障动物房,室温(20±2)℃,通风良好,环境舒适,黑暗与光照周期为12 h/12 h,并定期消毒。
1.1.2 药物 芫花(安国圣山药业有限公司提供)经北京中医药大学刘春生教授鉴定为瑞香科植物芫花(Daphne genkwa Sieb.et Zucc.)的干燥花蕾。
1.1.3 试剂与仪器 NaCl(北京化工,批号:A1060005)、KCl(北京化工,批号:A1049003)、Na2HPO4(北京化工,批号:A1060056)、CaCl2(北京化工,批号:A1011002)、K2HPO4(北京化工,批号:A1049021)、MgSO4(北京化工,批号:A1037009)、NaHCO3(北京化工,批号:A1060001);4%多聚甲醛(北京拜尔迪生物技术有限公司,批号:de-0094)、水合氯醛(北京拜尔迪生物技术有限公司,批号:biodee1212);Bradford蛋白定量试剂盒(北京拜尔迪生物技术有限公司,型号:W042);RNA保护液(北京普利莱基因技术有限公司,批号:R1100);PBS缓冲液(Corning,美国,批号:21-040-CVR);生理盐水(北京百诺威生物科技有限公司,批号:pb30164);超氧化物歧化酶(Superoxide Dismutase,SOD)试剂盒(南京建成生物工程研究所,型号:A001-3-2)、琥珀酸脱氢酶(Succinate Dehydrogenase,SDH)试剂盒(南京建成生物工程研究所,型号:A022-1-1)、丙二醛(malondialdehyde,MDA)试剂盒(南京建成生物工程研究所,型号:A003-4-1)、NADH氧化酶(NADH oxidase,NOX)试剂盒(南京建成生物工程研究所,型号:A116-1-1)、谷草转氨酶(Aspartate Aminotransferase,AST)试剂盒(南京建成生物工程研究所,型号:A010-2-1)、谷丙转氨酶(Alanine Aminotransferase,ALT)试剂盒(南京建成生物工程研究所,型号:A009-2-1)、甘油三酯(triglyceride,TG)试剂盒(南京建成生物工程研究所,型号:A110-1-1);FastKing cDNA第一链合成试剂盒(北京天根生化科技有限公司,型号:KR116-01);TransZol Up Plus RNA Kit(北京全式金生物技术有限公司,批号:ER501-01);TransStart Top Green qPCR Super Mix(北京全式金生物技术有限公司,批号:AQ131-03);丰年虾(天津丰年蝦水产养殖有限公司);12孔板(Corning,美国);96孔低位PCR板(Axygen,美国,PCR-96-LP-AB-C);20μL移液器(Eppendorf,德国,3121000040);斑马鱼循环水养殖系统(北京爱生科技公司);光学显微镜(Olympus,日本,PROVIS AX70);恒温培养箱(广州瑞明仪器有限公司,型号:LRH-250Z型);离心机(无锡瑞江分析仪器有限公司,型号:RJ-LDL-50G);真空旋转蒸发仪(北京欧莱德科学仪器有限公司,型号:SY-3000B);酶标仪(Biotek,美国,型号:Epoch2);紫外-可见分光光度计(尤尼柯上海仪器有限公司,型号:UV-2000);超微量分光光度计(赛默飞世尔科技公司,美国,型号:Nanodrop 2000);全能型成像系统(Bio-rad,美国,型号:ChemiDoc MP)、实时荧光定量PCR仪(Bio-rad,美国,型号:CFX96);Next Advance Bullet Blender快速组织样品匀浆仪(Next Advance,Inc.公司,美国,型号:BB24-AU)。
1.2 方法
1.2.1 分组 选取健康的成年斑马鱼320条,雌雄各半,随机均分为高、中、低剂量组和空白对照组共32组,每组10条(雌∶雄=1∶1)。SD大鼠24只,雌雄各半,随机均分为4组(高、中、低剂量组和空白对照组),每组6只。
1.2.2 给药方法
1.2.2.1 芫花样品的制备 芫花水提取物的制备:称取50 g芫花置于圆底烧瓶中,加10倍量水回流提取2 h,过滤,加10倍量水重新提取两次,1 h/次。合并提取液,抽滤,浓缩,减压干燥,研磨成粉末,置于干燥器中保存。芫花水提物储备液的配制:精密称取研磨后的芫花水提取物粉末0.102 0 g,溶于50 mL斑马鱼养殖水中,超声助溶,配制成2 000 μg/mL的母液,分装于5 mL离心管,放置于-20 ℃的冰箱中保存备用。芫花供试品溶液的配制:根据前期预实验,用养殖水将母液稀释至所需浓度即可。
1.2.2.2 给药方法 斑马鱼成鱼的暴露:根据预实验结果,选择健康的斑马鱼成鱼(鱼龄>6个月)进行暴露给药96 h,确定最大非致死浓度(15 μg/mL)。正式实验中,将成年斑马鱼分别暴露于高剂量(15 μg/mL)、中剂量(10 μg/mL)、低剂量(5 μg/mL)组的药液中,同时设置养殖水为空白对照组,每日喂食丰年虾3次,15 min后更换药物暴露液。待成鱼暴露96 h后,更换暴露液,用养殖水清洗斑马鱼两次,将其快速置于冰上冷冻麻醉,称重,解剖,显微镜下取其肝脏组织,所有解剖过程在冰浴的PBS中进行,取出的肝脏组织样本快速放入干净的5 mL离心管中。SD大鼠给药:参照临床使用剂量,按照2.5 mL/200 g体质量的给药标准对高剂量(0.236 g/100 g)、中剂量(0.079 g/100 g)、低剂量(0.026 g/100 g)组的SD大鼠进行灌胃给药,空白对照组给予等量的生理盐水溶液,灌胃1次/d,连续7 d,期间大鼠自行采食与饮水。待7 d后通过腹主动脉收集血液样本,立即将动物处死并剖取肝脏。取小部分肝脏组织放入4%多聚甲醛溶液中,用于后续的病理组织学观察,剩余的大部分组织切割成黄豆大小的样本保存于-80 ℃冰箱中,用于后续的生化指标检测。
1.2.3 检测指标与方法
1.2.3.1 病理组织学评价 将收集好的成鱼肝脏和SD大鼠肝脏的少量组织固定于4%的多聚甲醛缓冲液中12 h,然后在室温下进行脱水、透明处理,石蜡包埋,切成5 μm的薄片,HE染色后,置于显微镜下观察。
1.2.3.2 生化指標评价 将收集好的成鱼肝脏样本进行SOD、SDH、MDA、NADH氧化酶活性测定,将SD大鼠肝脏样本进行SOD、SDH、MDA、ALT、AST、TG活性测定。所有生化评价试验均严格按照试剂盒中附带的说明书进行。
1.2.3.3 芫花水总提物对斑马鱼成鱼肝脏毒性相关基因表达的影响 样本的收集:在实验终点,将成鱼解剖获得的肝脏组织转入含有3 mL RNA保护液的5 mL离心管中,每5条成鱼为一组。RNA提取及浓度、纯度检测:将收集好的样本中的RNA保护液弃去,参照TRIzol试剂盒内提供的说明书提取肝脏的总RNA。取少量提取所得RNA溶液与DEPC水按1∶10比例稀释后,按照说明书在RNA浓度测定仪上测定RNA溶液浓度和纯度。取1 L RNA模板加4 L RNase free Water和1 L 6×RNA/DNA Loading Buffer,在200 V条件下进行1.5%的琼脂糖凝胶电泳检测。RNA样本的反转录:根据试剂盒步骤对提取的RNA样本进行cDNA反转录即得到cDNA。荧光定量PCR反应:以各样品cDNA为模板,利用TransStart Top Green qPCR Super Mix试剂盒,按照说明书在CFX96 PCR仪中进行荧光定量PCR反应,反应体系和引物序列见表1~3,用于PCR的斑马鱼特异性引物是由Primer Premier 5.0软件设计并由博迈德生物有限公司合成的。PCR扩增方案为:95 ℃ 3 min;95 ℃ 3 s,60 ℃ 20 s,40个循环;95 ℃ 15 s,60 ℃ 15 s,95 ℃ 15 s。
1.3 统计学方法
采用SAS 802统计软件对以上实验数据进行分析,使用单因素方差分析(One-way ANO-VA)和LSD法进行组建多重比较,以P<0.05为差异有统计学意义。
2 结果
2.1 芫花水提物对斑马鱼成鱼及SD大鼠的肝脏组织结构的影响
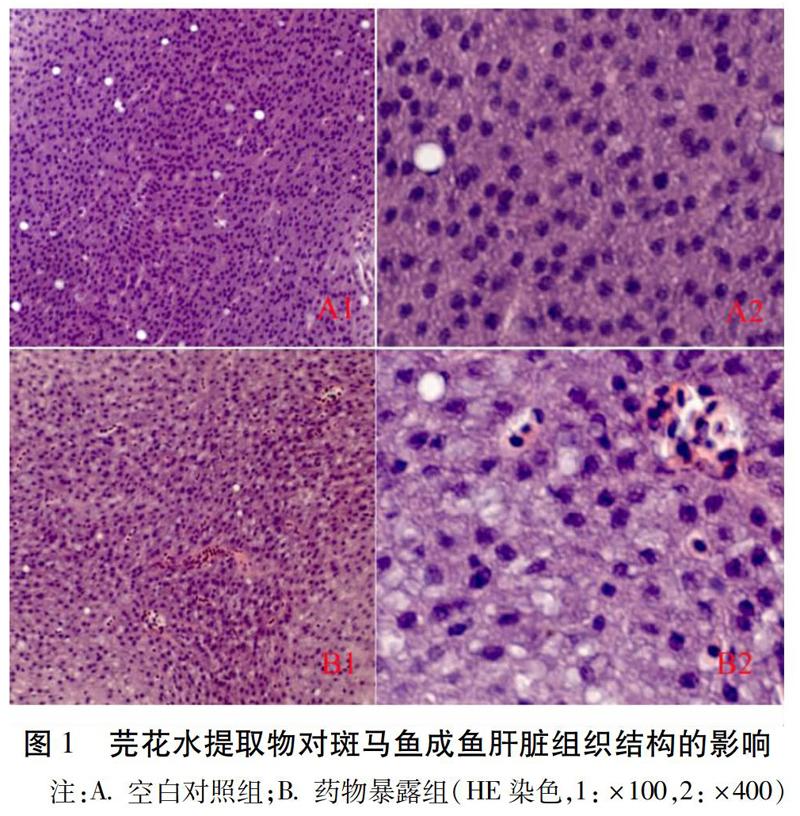
实验结果显示,斑马鱼成鱼及SD大鼠空白对照组的肝脏区域均细胞完整,细胞质均匀,细胞核呈规则圆形,见空白组图1.A,2.A所示;而在药物暴露处理组中,成鱼肝组织肝细胞排列松散,萎缩变形,细胞内的胞质溶解,空泡化严重,部分区域可见细胞坏死。见图1.B。同时,给药组大鼠肝脏细胞结构模糊不清,肝实质细胞减少,出现萎缩变形,部分区域可见胞质溶解造成空泡化,有出血和凋亡的现象。见图2.B。
2.2 芫花水提物处理对成鱼肝脏及大鼠肝脏生化指标水平的影响
实验结果表明,与对照组比较,药物暴露处理组中斑马鱼成鱼肝脏中SOD、SDH及NADH的酶活力均显著下降(P<0.05),而MDA含量上升(P<0.01)。见图3。与对照组比较,给药组大鼠肝脏中SOD和SDH的活力均显著下降(P<0.05),而MDA、TG含量升高(P<0.01),此外,所有给药组大鼠血清中AST活力均升高(P<0.01),低剂量给药组中ALT活力显著升高(P<0.05)。见图4。
2.3 芫花水总提物对斑马鱼成鱼肝脏毒性相关基因表达的影响
实验结果显示,与对照组比较,给药组中线粒体功能相关基因mtatp6,mtco1,mtnd1,pklr表达水平下调,氧化应激相关基因gstp2,nqo1,sod1的mRNA表达水平下调,自噬相关基因beclin-1和ATG3表达水平下调,内质网应激相关基因包括atf4a,ern1,hsp90b1的mRNA表达水平上调,且差异均具有统计学意义(P<0.01)。见图5。
3 讨论
芫花在临床应用时常常伴随着毒性作用和不良反应,现有研究表明芫花对肝脏、肾脏、胃肠道等多个脏器存在毒性作用[11],尤其是肝脏毒性,严重限制了芫花的广泛应用。但是有关芫花肝毒性研究的报道严重缺乏,亟需对芫花的肝脏毒性和毒性机制进一步评价,以利于芫花的深入开发和利用。
斑马鱼作为一种新型的模式生物,具有体积小、繁殖周期短、产卵率高、体外受精、基因序列与人类高度相似等优点[12-13],最重要的是,传统的肝脏毒性检测指标如肝脏代谢功能检测、组织病理学检测、肝脏特异标记物表达检测和肝细胞凋亡检测在斑马鱼模型中也能够使用,因此,斑马鱼不失为一种良好的肝脏毒性评价的模型。近些年,本课题组已利用斑马鱼进行香加皮[14]、芫花、重楼等中药潜在肝毒性筛选和评价,并致力于建立基于斑马鱼模型的中药肝毒性评价平台。但是截止到目前斑马鱼和传统评价模型在中药肝毒性评价中是否具有相似性还没有详细报道。
在本研究中,我们利用芫花分别对斑马鱼成鱼和SD大鼠进行处理,在实验终点,首先通过病理组织切片技术来确认斑马鱼模型与传统的体内SD大鼠模型在肝毒性损伤中表现出相似的肝毒性响应。结果表明芫花药物处理皆能够引起斑马鱼模型和SD大鼠肝脏出现显著的组织结构改变,包括细胞结构松散,组织结构紊乱和细胞空泡化等。谷丙转氨酶(ALT)和谷草转氨酶(AST)可以作为诊断肝细胞受损的标准[15]。前者主要分布于肝细胞的胞质中,后者主要分布于肝细胞的线粒体内。在本研究中,与对照组比较,SD大鼠给药组中低剂量组大鼠血清中ALT活力显著性升高,AST活力在所有给药组大鼠血清中均有所升高(P<0.01),表明芫花水提取物对大鼠肝脏有毒性作用。
同时生化指标评价的结果也表明芫花处理能够引起2种动物模型肝脏组织中的生化反应改变呈现相似性。在正常情况下,机体处于氧化-抗氧化的动态平衡中,当自由基过多或清除能力下降时,机体结构和功能会受到损伤,而脂质过氧化过程中会产生多种活性氧自由基,引起机体的氧化损伤。
SOD是抗氧化系统中的主要抗氧化酶之一,具有清除自由基作用,SOD活力水平体现了机体抗氧化应激水平。MDA是自由基攻击膜不饱和脂肪酸形成的产物,它的含量多少可以反映机体脂质过氧化水平,也可间接反映机体氧化应激损伤的水平[16]。在本研究中,与对照组比較,芫花处理能够引起斑马鱼成鱼与SD大鼠组肝脏中MDA含量均上升(P<0.01),而SOD活性水平均显著下降(P<0.05),表明氧化应激是芫花水提取物引起肝损伤的主要形式之一。线粒体是三羧酸循环的主要场所,是细胞能量产生的中枢,其维持着细胞正常的生理功能。SDH位于细胞线粒体内膜,是细胞有氧呼吸的关键酶,为真核细胞线粒体和多种原核细胞需氧和产能的呼吸链提供电子,其活性可作为评价三羧酸循环运行程度的指标[17]。糖酵解途径是将葡萄糖和糖原降解为丙酮酸并伴随ATP生成的一系列途径,产生的丙酮酸将进入线粒体继续氧化分解,通过三羧酸循环及电子传递链彻底氧化成二氧化碳和水,并生成ATP的过程。NADH氧化酶,在糖酵解过程中催化NADH同氧气发生氧化反应产生NAD+,对维持NAD+/NADH的平衡有重要的意义[18]。在本研究中,与对照组比较,芫花能够引起斑马鱼成鱼与SD大鼠组肝脏中SDH含量均显著下降(P<0.05),同时,芫花能够引起斑马鱼肝脏中NADH氧化酶含量显著下降(P<0.05),表明芫花水提取物影响三羧酸循环和糖酵解过程,进而造成线粒体功能损伤。TG是脂质的组成成分,其主要功能是供给与储存能源,正常情况下三酰甘油保持动态平衡,TG含量升高可以作为肝脏细胞中的三酰甘油代谢出现障碍的标志。在本研究中,与对照组比较,SD大鼠给药组中TG含量升高(P<0.01),表明脂质代谢障碍是芫花水提取物引起肝损伤的方式之一。
为了进一步阐明芫花水提取物引起肝损伤的作用机制,本研究还检测了氧化应激、线粒体功能相关基因的表达水平。Gstp2是胱甘肽S-转移酶(GST)家族成员之一,具有缓解内源性、外源性物质的毒性的作用[19],其表达水平的降低暗示机体内抗氧化物解毒能力的下降。nqo1酶属于Ⅱ相代谢酶,在体内与其他Ⅰ、Ⅱ相代谢酶一起构成了体内对外源性毒性物质的代谢网络,在机体的解毒代谢过程中发生双电子氧化还原反应[20]。SOD1是一种在线粒体外发挥抗氧化作用的抗氧化酶[21],通过催化超氧阴离子自由基(O22-)歧化为H2O2和O2来维持胞内活性氧物种(ROS)的内稳态[22]。本研究结果显示芫花水提取物诱导的斑马鱼成鱼肝脏中gstp2,nqo1,SOD1基因的表达均下调,表明给药后,机体内的ROS增多,导致斑马鱼体内的氧化和抗氧化作用失衡,从而导致氧化应激损伤发生。
Pklr基因作为糖酵解相关基因,其表达水平下调可以显示糖酵解过程受抑制,进而影响线粒体产能。细胞色素c氧化酶是有氧代谢中的关键酶,若该酶缺乏、缺乏或功能失调,将会导致线粒体氧化活性受损和一些严重的疾病状态[23]。mtco1为线粒体呼吸链末端细胞色素c氧化酶构造中的一个亚基,能够编码细胞色素c氧化酶Ⅰ。mtnd1基因能够编码NADH脱氢酶1的蛋白质的合成,该蛋白质为复合物Ⅰ的一部分,在线粒体中具有重要活性,能够参与氧化磷酸化的过程。同样,mtATP6基因能够编码ATP合酶的Fo亚基6,也参与氧化磷酸化的过程与ATP的生成密切相关。可见,Pklr基因、mtco1基因、mtnd1基因、mtATP6基因表达水平高低可以作为线粒体功能强弱的依据。本研究结果显示芫花水提取物诱导的斑马鱼成鱼肝脏中pklr,mtco1,mtnd1,mtatp6基因的表达均显著性下调,表明芫花水提取物能够导致机体内的三羧酸循环和糖酵解障碍,进而造成线粒体功能损伤。
内质网(Endoplasmic Reticulum,ER)是蛋白质合成的主要场所,当细胞内外应激因子影响蛋白正确折叠以及钙的储存,或未折叠蛋白在腔内聚集时,会导致内质网应激(Endoplasmic Reticulum Stress,ERS)[24]。ERS的相关基因有atf4a,hsp90b1,ern1,在芫花水提取物的诱导下,成鱼中atf4a,hsp90b1的表达上调,ern1基因的表达下降,说明芫花水提取物对成鱼肝脏产生毒性作用时,其作用机制均与内质网应激作用相关。
综上可以看出,芫花水提取物能够引起斑马鱼成鱼和SD大鼠出現明显的肝毒性。本研究发现芫花水提取物造成肝脏损伤的潜在作用机制与氧化应激、线粒体功能障碍、内质网应激及细胞自噬有关,为后续研究者进行芫花的肝毒性机制研究提供思路。另外研究表明斑马鱼成鱼与SD大鼠在芫花肝毒性相应中表现出较强的一致性。斑马鱼模型具有成本低、繁殖快、易饲养、高通量筛选等优势,因此,斑马鱼作为模式生物用于中药肝毒性评价具有可行性、高效性,为未来建立斑马鱼中药肝脏快速评价技术与方法提供参考依据。
参考文献
[1]国家药典委员会.中华人民共和国药典[S].北京:化学工业出版社,2015:159.
[2]李玲芝,宋少江,高品一.芫花的化学成分及药理作用研究进展[J].沈阳药科大学学报,2007,24(9):587-592.
[3]Song Z,Zhang Y,Zhang H,et al.Isoliquiritigenin triggers developmental toxicity and oxidative stress-mediated apoptosis in zebrafish embryos/larvae via Nrf2-HO1/JNK-ERK/mitochondrion pathway[J].Chemosphere,2020,246:125727.
[4]Garcia G R,Noyes P D,Tanguay R L.Advancements in zebrafish applications for 21st century toxicology[J].Pharmacol.Ther.,2016,161:11-21.
[5]Jia Z,Zhao C,Wang M,et al.Hepatotoxicity assessment of Rhizoma Paridis in adult zebrafish through proteomes and metabolome[J].Biomed.Pharmacother.,2020,121:109558.
[6]Zhao C,Jia Z,Li E,et al.Hepatotoxicity evaluation of Euphorbia kansui on zebrafish larvae in vivo[J].Phytomedicine,2019,62:152959.
[7]赵崇军,田敬欢,倪媛媛,等.马钱子对斑马鱼胚胎发育的影响[J].中华中医药学刊,2016,34(11):2773-2775.
[8]倪媛媛,赵崇军,冯娅茹,等.基于斑马鱼模型探讨马钱子的抗血管生成活性[J].世界科学技术-中医药现代化,2016,18(9):1534-1538.
[9]李二文,赵崇军,冯丹,等.芫花水提取物对斑马鱼肝脏的毒性作用[J].中华中医药杂志,2019,34(4):453-456.
[10]Westerf Ield M.The Zebrafish Book[M].Eugene:University of Oregon Press,1995:30-43.
[11]Zhou Q,Xiao L,Liu Q,et al.Vinegar processing attenuates toxicity on IEC-6 cells caused by chloroform extraction of Daphne genkwa[J].Zhongguo Zhong Yao Za Zhi,2018,43(11):2282-2287.
[12]王新娟.斑马鱼作为肝癌模型的应用进展[J].临床肝胆病杂志,2016,32(7):1425-1428.
[13]赵崇军,田敬欢,王金凤,等.斑马鱼在中药研究中的应用进展[J].中草药,2015,46(17):2635-2648.
[14]代一航,赵崇军,田敬欢,等.香加皮水提取物对斑马鱼幼鱼肝脏毒性的初步研究[J].环球中医药,2017,10(10):7-12.
[15]Zhang Y,Liu K,Hassan H M,et al.Liver Fatty Acid Binding Protein Deficiency Provokes Oxidative Stress,Inflammation,and Apoptosis-Mediated Hepatotoxicity Induced by Pyrazinamide in Zebrafish Larvae[J].Antimicrob.Agents Chemother.,2016,60(12):7347-7356.
[16]沈洪艳,焦晓会,武彤.头孢噻肟钠对斑马鱼SOD活性、MDA含量及DNA损伤的影响[J].环境科学学报,2015,35(8):2626-2632.
[17]高峰,焦晨莉,余金花,等.基于“有故无陨”理论探讨何首乌对肾阴虚大鼠肝线粒体能量代谢的影响[J].中华中医药杂志,2018,33(11):385-388.
[18]Ge X,Shi X,Shi L,et al.Involvement of NADH Oxidase in Biofilm Formation in Streptococcus sanguinis[J].PLoS One,2016,11(3):e0151142.
[19]Glisic B,Mihaljevic I,Popovic M,et al.Characterization of glutathione-S-transferases in zebrafish(Danio rerio)[J].Aquat.Toxicol.,2015,158:50-62.
[20]Dinkova-Kostova A T,Talalay P.Persuasive evidence that quinone reductase type 1(DT-diaphorase)protects cells against the toxicity of electrophiles and reactive forms of oxygen[J].Free Radic.Biol.Med.,2000,29(3-4):231-240.
[21]Yin J,Wang A,Li W,et al.Sensitive biomarkers identification for differentiating Cd and Pb induced toxicity on zebrafish embryos[J].Environ.Toxicol.Pharmacol.,2017,56:340-349.
[22]李享,石家愿,邱爽,等.SOD1抑制與活性氧信号转导的调控[J].化学进展,2018,30(10):1475-1486.
[23]Ostrow J Donald,Irwanto K Astrid,Malik Safarina G,et al.Effect of bilirubin on cytochrome c oxidase activity of mitochondria from mouse brain and liver[J].BMC Res.Notes.2010,3(1):162.
[24]Guzel E,Arlier S,Guzeloglu-Kayisli O,et al.Endoplasmic Reticulum Stress and Homeostasis in Reproductive Physiology and Pathology[J].Int.J.Mol.Sci,2017,18(4):792.
(2020-06-10收稿 责任编辑:徐颖)
