下调ADAR1表达对人肺癌细胞增殖、迁移和上皮间质转化的影响
2020-08-06马振凯陈微微李雪琳宫凯凯杨丽娟代娟娟
周 宁,武 睿,马振凯,陈微微,李雪琳,宫凯凯,杨丽娟,代娟娟,武 艳
(1. 滨州医学院附属医院耳鼻咽喉头颈外科,山东 滨州 256600;2. 滨州医学院附属医院肿瘤研究实验室,山东 滨州 256600;3. 山东省滨州市人民医院神经外科,山东 滨州 256600)
肺癌的发生发展与异常的基因表达调控有密切关联,RNA编辑是一种重要的基因转录后修饰方式,在调控基因表达中发挥重要作用。作用于RNA的腺苷酸脱氢酶1(adenosine deaminase acting on RNA enzyme 1,ADAR1)能够催化RNA上腺嘌呤转化为次黄嘌呤(A-I),并将次黄嘌呤识别为鸟嘌呤,与胞嘧啶进行配对,最后导致蛋白质中氨基酸的改变,是一种重要的RNA编辑酶[1]。ADAR1的主要功能是编辑内源的双链核糖核酸(double-stranded RNA,dsRNA)使之与病毒来源的dsRNA区分开来[2]。研究[3-4]表明:缺失ADAR1的造血干细胞导致干扰素刺激基因(interferon-stimulated genes,ISGs)表达上调,ADAR1在免疫应答中起重要作用。ADAR1还具有非依赖编辑的功能,例如能够防止转录本的降解。双链RNA结合蛋白staufen1和staufen2与mRNA的结合能招募上游移码突变体(up-frameshift mutant 1,UPF1),并能激活staufen进而促进RNA降解(SMD)[5-6]。ADAR1表达水平变化还与黑色素瘤[7]、食道癌[8]、慢性白血病[9]和宫颈癌[10]等的发生发展有密切关联。有文献[11]报道:ADAR1通过增强局部黏着斑激酶(focal adhesion kinase,FAK)mRNA的稳定性促进肺腺癌细胞的迁移和浸润。但敲低ADAR1对肺癌细胞增殖和上皮间质转化(epithelial-mesenchymal transition,EMT)的调控机制尚无报道。本研究利用RNA干扰技术敲低细胞中ADAR1表达水平,建立了稳定表达shADAR1的H1299和H520细胞系,并通过细胞增殖、克隆形成、细胞划痕实验及Western blotting法评价ADAR1对细胞增殖、迁移和EMT的调节作用,以期为研究ADAR1在肺癌发展中的作用机制奠定基础,同时为以ADAR1为靶点的抗癌药物设计提供理论依据。
1 材料与方法
1.1 细胞、主要试剂和仪器人肺癌H1299和H520细胞购自美国模式培养物研究所(ATCC)。胰蛋白酶、胎牛血清(FBS)和RPMI 1640培养基均购自美国Gibco公司,shADAR1和对照质粒(negative shRNA)购自上海吉凯基因化学技术有限公司,Lipofectamine 2000 购于美国Invitrogen公司,TRIzol试剂和PCR所需引物购于上海生物工程有限公司,逆转录试剂购于Thermo公司,ADAR1单克隆抗体、Tubulin抗体和辣根过氧化物酶标记的羊抗兔IgG抗体购于美国Proteintech公司,波形蛋白(vimentin)抗体和E钙黏蛋白(E-cadherin)抗体购自美国Abcam公司,CCK-8 试剂购于上海碧云天公司。CO2细胞培养箱(美国Thermo公司),激光共聚焦显微镜(美国Leica公司),酶标仪(美国Bio-Tek公司)。
1.2 细胞转染和稳定细胞系的构建细胞用含10%胎牛血清和1%(V/V)青霉素-链霉素的RPMI-1640培养基于37℃、5% CO2及饱和湿度环境的培养箱中培养。H1299和H520细胞均分为对照组和shADAR1组,分别将1.5 μg negative shRNA质粒或shADAR1质粒与Lipofectamine 2000 4 μL 混合后,加入培养基100 μL,室温孵育25 min,分别加入到生长密度为60%~80%的H1299和H520细胞中,继续培养24~48 h后,以野生型细胞为平行对照进行嘌呤霉素筛选,药物浓度为2 mg·L-1,2周后平行对照细胞全部死亡,并且荧光显微镜下转染后细胞全部发出绿色荧光,即稳定细胞系构建成功,后续改为嘌呤霉素半量维持培养。
1.3 实时荧光定量PCR(qRT-PCR)法检测细胞中ADAR1 mRNA表达水平收集各组细胞,TRIzol 法提取细胞总RNA,将提取的RNA应用逆转录试剂盒逆转录成cDNA,应用TransStart Green qPCR SuperMix进行PCR 验证。qRT-PCR的反应条件:95 ℃、30 s 预变性;95 ℃、5 s,60 ℃、30 s,共40个循环。引物序列:ADAR1,上游引物为5′-CCCTTCAGCCACATCCTTC-3′,下游引物为5′-GCCATCTGCTTTGCCACTT-3′;GAPDH,上游引物为5′-GGTGGTCTCCTCTGACTTCAACA-3′,下游引物为 5′- GTTGCTGTAGCCAAATTCGTTGT-3′。进行3次重复实验,以GAPDH 作为内参,采用2-ΔΔCt法计算ADAR1 mRNA相对表达水平。
1.4 CCK-8法检测细胞增殖活性将各组细胞以5×103/孔接种于96 孔板,每组设置3个平行孔,每过12 h 加入CCK-8 继续培养3 h,采用酶标仪测定各孔在450 nm 波长处的吸光度(A)值,共测定至72 h,实验重复3次,取平均A值,以A值代表细胞增殖活性,对0 h平均A值进行均一化处理后,采用GraphPad Prism 7.0软件绘制各组细胞随时间变化的增殖曲线。
1.5 克隆形成实验检测细胞的克隆形成能力将各组细胞以1×103个/孔的密度接种于6孔板中,每组设2个复孔。培养14 d后,吸尽培养基并用PBS清洗细胞,加入4%多聚甲醛固定5 min,再用0.1%结晶紫染液染色15 min,用PBS清洗后拍照并计算克隆形成数,代表细胞的克隆形成能力。实验重复3次。
1.6 划痕实验检测细胞划痕愈合率各组细胞培养过夜后,用200 μL枪头进行划痕,PBS洗涤后,加入新鲜无血清培养基后继续培养,分别在0 和48 h进行拍照。实验重复3次,应用Image J 软件对划痕距离进行统计学分析,并采用Graph Pad Prism 7.0软件绘制各组细胞的划痕愈合率图。细胞划痕愈合率=(0 h划痕间距-48 h划痕间距)/0 h划痕间距×100%。
1.7 Western blotting法检测细胞中ADAR1、E-cadherin和vimentin蛋白表达水平收集各组H1299和H520细胞,NP-40 裂解液裂解细胞,BCA法测定浓度后,通过10% SDS-PAGE进行电泳,转膜,封闭后分别孵育抗ADAR1(1∶1 000)、抗Tubulin(1∶1 000)、抗vimentin(1∶1 000)和抗E-cadherin(1∶1 000)抗体过夜,次日PBST洗涤3次,孵育HRP标记的羊抗兔或羊抗鼠IgG 抗体(1∶1 000),加入ECL显色底物,应用成像系统进行成像拍照,实验重复3次。利用Image J分析软件分析各条带灰度值,以目的蛋白条带灰度值/Tubulin蛋白条带灰度值比值作为目的蛋白表达水平。
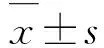
2 结 果
2.1 敲低ADAR1稳定细胞系的构建和鉴定将携带有绿色荧光蛋白(green fluorescent protein,GFP)基因的shADAR1载体和对照质粒分别瞬时转染H1299及H520细胞后,应用荧光显微镜检测GFP的表达情况,以此检测脂质体的转染效率。结果显示:H1299和H520细胞中转染对照质粒和shADAR1后,90%以上细胞中均可见绿色荧光。见图1(插页一)。
与对照组(1.000±0.081和1.000±0.040)比较,shADAR1组H1299和H520细胞中ADAR1 mRNA表达水平(0.530±0.040和0.405±0.045)均明显降低(t=5.255,P<0.05;t=9.882,P<0.01)。Western blotting法检测结果显示:shADAR1组H1299和H520细胞中ADAR1蛋白表达水平(0.296±0.014和0.371±0.052)明显低于对照组(1.000±0.126和1.000±0.043)(P<0.05)。见图2。
2.2 各组细胞增殖活性与对照组比较,shADAR1组H1299和H520细胞增殖活性明显降低(H1299:t=3.106,P<0.05;H520:t=3.255,P<0.01)。见图3。
2.3 各组细胞克隆形成数与对照组(172.500±10.607和213.500±6.364)比较,shADAR1组H1299和H520细胞克隆形成数(38.500±6.364和59.500±4.950)明显降低(t=14.58,P<0.01;t=16.75,P<0.01),即克隆形成能力降低。见图4。
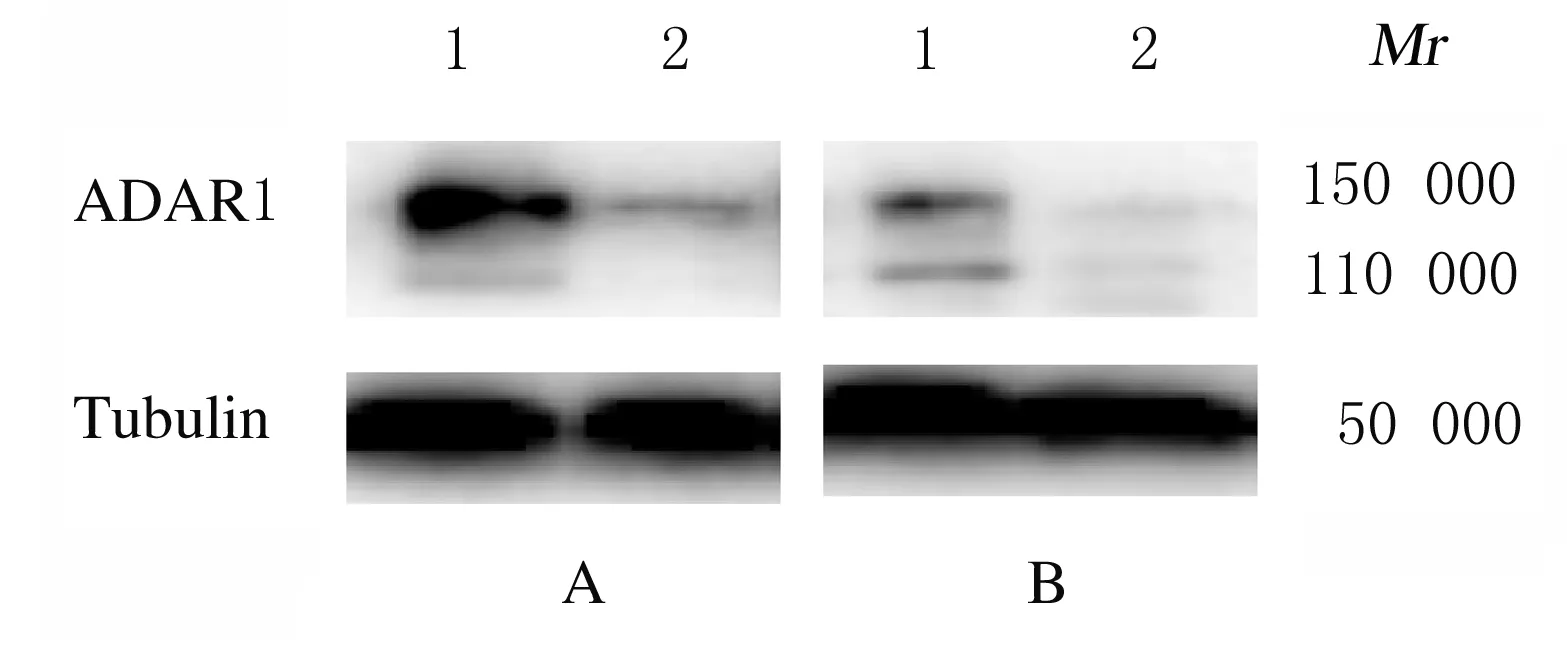
A:H1299 cells;B:H520 cells;Lane 1: Control group; Lane 2: shADAR1 group.
2.4 各组细胞划痕愈合率与对照组(59.1%±8.7%和57.7%±1.7%)比较,shADAR1组H1299和H520细胞划痕愈合率(43.6%±8.9%和45.1%±5.0%)明显降低(t=3.043,P<0.01;t=4.149,P<0.01)。见图5。

A: H1299 cells; B: H520 cells. *P<0.05, **P<0.01 compared with control group.

A, B:Control group; C, D: shADAR1 group; A, C: H1299 cells; B, D: H520 cells.
2.5 各组细胞中转移相关基因E-cadherin 和vimentin蛋白表达水平shADAR1组H1299和H520细胞中E-cadherin蛋白表达水平(1.700±0.018和2.481±0.152)明显高于对照组(1.000±0.070和1.000±0.084)(t=13.8,P<0.01;t=12.02,P<0.01)。
shADAR1组H1299和H520细胞中vimentin蛋白表达水平(0.160±0.009和0.336±0.049)明显低于对照组(1.000±0.056和1.000±0.056)(t=20.68,P<0.01;t=12.49,P<0.01)。见图6。
3 讨 论
化疗在非小细胞肺癌治疗中占重要地位,但是多数的治疗效果并不理想,主要原因是癌细胞在治疗过程中产生了抗药性。因此,研究肺癌发生发展中的关键调控因子,发现新的治疗靶点对肺癌的治疗具有重要意义。
RNA编辑主要指在转录本上碱基的插入、缺失或者替换,是一种重要的转录后修饰[12],其中A-to-I(也称为A-to-G编辑)是哺乳动物中最常见的RNA编辑方式。ADAR1是一种重要RNA编辑酶,存在2种单体形式,分别为ADAR1p110和ADAR1p150[13]。ADAR1 相互作用的蛋白主要分为两类,一类是早期发现能被ADAR1编辑的相互作用蛋白,如丙酮酸激酶(pyruvate kinase,PKR)[14];另一类是不依赖编辑功能,直接与ADAR1 相互作用的蛋白,如核因子(nuclear factor,NF)45[15]和NF90[16],随后还发现移码突变蛋白1(Upf1)[17]和Dice 酶[18],均可与ADAR1相互作用,在机体内发挥重要的生物学功能。

A-D:0 h;E-H:48 h;A,B,E,F:H1299 cells;C,D,G,H:H520 cells;A,C,E,G:Control group;B,D,F,H:shADAR1 group.
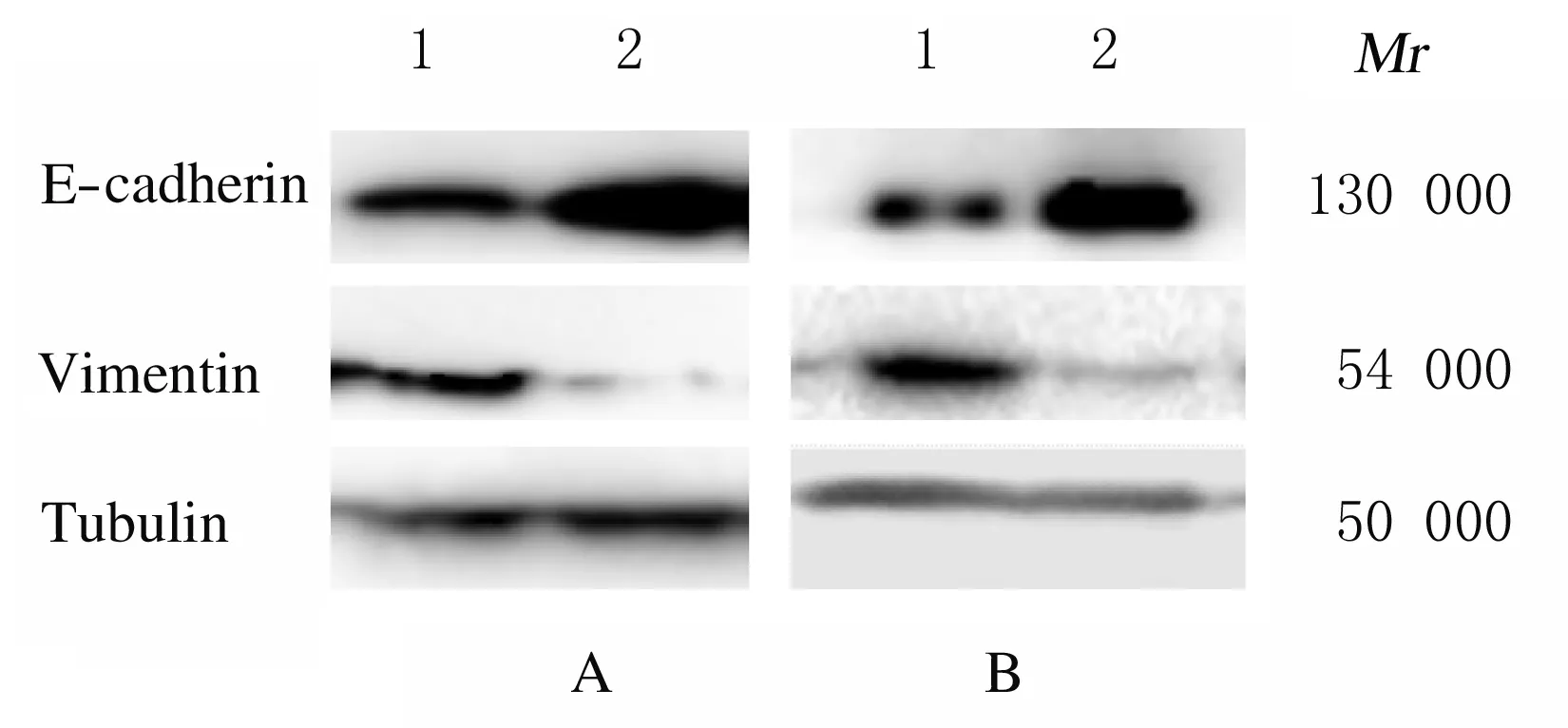
A:H1299 cells;B:H520 cells; Lane 1: Control group;Lane 2: shADAR1 group.
ADAR1除在免疫应答中的重要作用之外,在多种肿瘤中存在过表达的现象,并在肿瘤发生过程中发挥重要的调控作用,例如在肝癌中,ADAR1 的表达水平上调后能稳定抗酶抑制因子1(antizyme inhibitor 1,AZIN1)的水平,导致下游原癌基因表达上调[19]。在结直肠癌中,Ras同源基因家族成员Q(ras homolog family member Q,RHOQ)的A-to-Ⅰ的编辑能够增加肿瘤细胞的侵袭潜能[20]。异常表达的ADAR1通过激活哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)/p70S6K信号通络调控胃癌的发生发展[21]。本研究通过RNA干扰技术并通过抗生素筛选获得稳定低表达ADAR1细胞系,并通过CCK-8实验、克隆形成及划痕实验证明:敲低ADAR1能够抑制H1299和H520细胞的增殖和迁移能力。本研究结果与文献[22]报道的异常表达的ADAR1促进肺癌的发生发展过程的结果一致。最近研究[23]显示:异常表达的ADAR1通过提高c-myc的稳定性介导了胰腺癌细胞对布罗莫结构域和外末端基元蛋白(bromodomain and extraterminal motif,BET)的抵抗性。上述结果说明:ADAR1作为一种促癌基因在肺癌的发生发展中发挥重要作用,也可能参与了肿瘤耐药性的产生。
EMT是肿瘤细胞迁移浸润的重要途径,E-cadherin表达下调、vimentin表达上调是EMT的特征之一[24]。E盒结合锌指蛋白1(zinc finger E-box-binding homeobox 1,ZEB1)[25]、锌指转录因子2(zinc finger transcription factor 2,snail2)[26]等在转录水平上抑制E-cadherin的表达,促进细胞的EMT转化。EMT能够促进癌细胞的转移、浸润和药物抵抗。本研究结果表明:敲低ADAR1可激活E-cadherin,并抑制vimentin的表达,抑制H1299和H520细胞的EMT过程,但ADAR1调控EMT的具体作用机制还需进一步深入研究。
综上所述,本研究首先通过RNA干扰技术抑制细胞中ADAR1表达,并进一步验证敲低ADAR1后可抑制肺癌H1299和H520细胞的增殖、迁移和EMT。本研究结果为肺癌的发病机制和治疗靶点的研究提供了理论依据。
