高效价猪圆环病毒Ⅱ型Cap蛋白多克隆抗体的制备及应用
2020-08-04张文刘照贞李俊硕商营利
张文 刘照贞 李俊硕 商营利
(山东农业大学动物科技学院 山东省动物生物工程与疫病防治重点实验室,泰安 271018)
猪圆环病毒II型(Porcine circovirus 2,PCV2)感染引起的猪圆环病毒相关疾病(PCV2-associated diseases,PCVD)是严重危害养猪业的重要传染病之一。当前,我国猪群中PCV2的感染率高、流行范围广,死亡率可达10%以上,给养猪业造成重大的经济损失[1]。虽然已有多种疫苗免疫防控,但由于对PCV2的致病机制尚不完全清楚以及病毒的持续变异,临床上仍难以控制该病毒的感染。目前已发现 PCV2有 5个基因型(PCV2a-e)[2],其中 PCV2a,PCV2b和 PCV2d流 行 率 较 高[3], 而PCV2b是近年来国内流行毒株的主要优势基因型[4]。PCV2b基因组全长约1.7 kb,包含11个开放阅读框(ORF1-11)[5],其中ORF2编码的结构性蛋白Cap包含了病毒的主要抗原决定簇,与宿主的免疫相关,具有良好的免疫原性和反应原性,且与PCV1 Cap蛋白无抗原交叉反应[6]。因此,Cap蛋白是流行病学诊断和疫苗研究的关键蛋白,同时也是制备抗PCV2抗体的理想抗原[7]。
已有多项研究通过原核或真核表达系统表达了全长或截短形式的PCV2 Cap蛋白,并制备了抗Cap的单克隆或多克隆抗体,但受到Cap表达量低,或不能实现可溶性表达以及制备成本高等诸多因素影响,制备的抗体存在效价较低或应用范围窄等局限[8-12]。因此,制备高效价、应用广的抗PCV2b Cap抗体对于PCV2b的临床诊断和科学研究均具有重要意义。本研究通过优化表达条件,利用大肠杆菌表达了不含核定位信号肽的PCV2b Cap截短蛋白,实现了大量可溶性表达,并将纯化的重组Cap蛋白免疫实验兔,制备了高效价抗PCV2b Cap的多克隆抗体。该抗体能应用于免疫印迹、间接免疫荧光和免疫组化等多种检测方法中,且特异性好,为PCV2b的临床诊断及致病机制研究提供了有利工具。
1 材料与方法
1.1 材料
pET-30a质粒、BL21(DE3)菌株、JM109菌株由本实验室保存;PCV2b毒株IDSDTA2017-1(Genbank number:MN400446)由本实验室分离保存;小鼠抗His标签抗体购于北京博奥龙免疫技术有限公司;山羊抗兔HRP-IgG购于北京中杉金桥生物技术有限公司;Alexa Fluor 594 山羊抗兔IgG购于Proteintech Group,Inc;DAPI、山羊血清购于北京索莱宝科技有限公司;DMEM和青链霉素混合液购自Thermo Fisher Scientific公司;胎牛血清购自 Biological Industries(BI);PrimeSTAR HS DNA Polymerase、限制性内切酶、T4 DNA连接酶、DNA Marker、Premixed Protein Marker等均购自宝生物工程(大连)有限公司;DNA凝胶回收试剂盒、质粒提取试剂盒购于天根生化科技(北京)有限公司;HisTrap HP层析柱购于GE公司;弗氏完全佐剂、弗氏不完全佐剂购于Sigma-Aldrich公司;新西兰大白兔购自山东济南金丰实验动物有限公司;C57BL/6小鼠购自北京斯贝福生物技术有限公司。
1.2 方法
1.2.1 病毒的分离鉴定 取临床诊断疑似圆环病毒感染的病猪肝脏、肺脏和淋巴结组织,以PCR检测PCV2感染情况。将鉴定为PCV2单阳性的组织样品研磨液,4℃,13 500×g,离心10 min后,以0.22 μm滤器过滤除菌后加入单层生长的PK-15细胞中培养,盲传3代,PCR鉴定分离的PCV2病毒,进一步对ORF2基因进行测序鉴定。
1.2.2 蛋白原核表达及纯化 参考文献报道[13]的PCV2 ORF2序列的核定位信号肽,设计引物(表1),以PCV2b毒株DNA为模板扩增不含NLS的ORF2基因片段,序列长度为585 bp,克隆至原核表达载体pET-30a上,测序正确后将重组质粒pET30a-ORF2(His标签)转化至大肠杆菌BL21(DE3)中。通过优化最佳诱导表达条件:37℃,220 r/min,0.5 mmol/L IPTG诱导6 h,收集菌体,超声裂解菌体,4℃,13 500×g离心30 min,收集上清液,利用AKTA蛋白纯化系统和HisTrap柱(GE Healthcare)纯化Cap蛋白。

表1 PCV2 ORF2序列扩增及PCV2病毒鉴定引物
1.2.3 兔源多克隆抗血清制备 根据文献报道的方法[14]对家兔进行抗原免疫。取纯化的Cap蛋白1 mg与等体积的弗氏完全佐剂进行乳化,将乳化后的抗原在实验兔背部皮下多点注射进行免疫,分别于首免后第4周和第6周取纯化的Cap蛋白0.5 mg与等体积的弗氏不完全佐剂进行乳化,皮下多点注射进行加强免疫,三免后14 d采血分离血清,-80℃保存备用。
1.2.4 间接ELISA 取纯化的Cap蛋白,以PBS(pH 7.2)稀释为终浓度10 μg/mL 4℃过夜包被96孔板。以1% BSA 37℃封闭1 h后分别加入不同倍比稀释浓度的抗血清,室温孵育1 h,加入辣根过氧化物酶(HRP)标记的山羊抗兔IgG室温孵育1 h,TMB显色液室温显色15 min,2 N H2SO4终止显色,酶标仪读取OD450nm值。免疫后与免疫前血清吸光度比值(P/N值)大于2.1即判定为阳性[15]。
1.2.5 免疫球蛋白IgG纯化 抗血清中免疫球蛋白IgG纯化采用辛酸-硫酸铵沉淀法[16]。首先将抗血清以醋酸盐缓冲液(pH 4.5)按1∶4稀释后,向混合液中缓慢滴加正辛酸(250 μL/10 mL混合液),室温搅拌30 min沉淀杂蛋白,然后2 700×g,4℃离心30 min收集上清,定性滤纸过滤去除杂蛋白。将过滤液用磷酸盐缓冲液(pH 7.4)按10∶1的比例混合,于4℃缓慢加入固体硫酸铵(2.77 g/10 mL),搅拌30 min盐析沉淀IgG,2 700×g离心15 min收集沉淀,将沉淀的IgG以PBS重悬,透析获得高纯度抗Cap多克隆抗体,-80℃保存。
1.2.6 细胞培养和病毒感染模型 PK-15猪肾细胞系以含青链霉素的10% FBS(Biological industries)的DMEM(Gibco)中置于5% CO2,37℃培养箱中培养。PK-15细胞铺于12孔板中,将IDSDTA2017-1毒株或其他PCV2临床分离株感染PK-15细胞,感染48 h后收集并裂解细胞提取总蛋白,进行免疫印迹检测。
1.2.7 PCV2感染小鼠模型 参考文献报道[17-19]并稍修改,具体方法为取7周龄C57BL/6小鼠,每只小鼠腹腔注射3.5×104PFU的PCV2b病毒,对照组腹腔注射DMEM培养基,感染3 d后取小鼠肝脏、脾脏和肾脏组织进行免疫组化检测。
1.2.8 免疫印迹 收集PCV2b感染的PK-15细胞,以SDS细胞裂解液(2% SDS,50 mmol/L Tris-HCl,10%甘油,100 mmol/L DTT,0.1%溴酚蓝,pH6.8)裂解细胞提取总蛋白。将样品进行12%的SDSPAGE凝胶电泳,转膜,5%BSA室温封闭后,分别以制备的抗血清和纯化后多克隆抗体4℃孵育过夜,HRP酶标二抗室温孵育后,显色拍照。
1.2.9 间接免疫荧光 细胞爬片以4%多聚甲醛室温固定20 min后,以0.1% Triton X-100冰上处理细胞5 min,5%正常山羊血清室温封闭30 min。将纯化后的IgG稀释不同比例与待检细胞室温孵育1.5 h,加入Alexa Fluor 594标记的羊抗兔荧光二抗(1∶200),室温避光孵育、洗涤、最后以含DAPI的封片剂进行封片,荧光显微镜观察。
1.2.10 免疫组织化学 取小鼠肝脏、脾脏和肾脏组织,4%多聚甲醛固定,石蜡包埋和切片(3 μm)。石蜡切片脱蜡至水,5%正常山羊血清封闭后加不同稀释浓度的抗Cap多克隆抗体4℃过夜孵育。PBS洗涤后以HRP标记的羊抗兔IgG(1∶100)室温孵育1 h后,DAB显色,苏木素复染,显微镜观察。
2 结果
2.1 PCV2b Cap融合蛋白的可溶性表达和纯化
为了获得大量的可溶性重组PCV2b Cap蛋白用于制备多克隆抗体,根据文献报道[20]分析了Cap的氨基酸序列,确定前41个氨基酸为核定位信号肽(Nuclear location sequence,NLS)。为了在大肠杆菌中高效表达Cap蛋白抗原,将不含NLS基因序列的长度为585 bp的PCV2b(IDSDTA2017-1株)的ORF2克隆至pET30a表达载体中(图1-A),并对重组载体进行了测序验证。将测序正确的重组表达载体转化至BL21(DE3)表达菌中,以1∶100的稀释比例转接LB培养基,37℃培养至OD600nm为0.5,加入0.5 mmol/L IPTG 37℃诱导表达6 h后收集菌体。取超声裂解后的菌体上清进行SDS-PAGE和考马斯亮蓝染色检测重组Cap蛋白的表达情况,发现在约29 kD处有明显条带,与预期大小相符,表明目的蛋白表达成功,且为可溶性表达(图1-B,Lane4-5)。利用AKTA蛋白纯化系统以1 mL HisTrap HP柱(GE Healthcare)纯化上清液中的Cap蛋白,发现在20 mmol/L咪唑的洗涤缓冲液,500 mmol/L咪唑的洗脱缓冲液条件下,纯化蛋白可获得单一条带(图1-C)。为进一步验证纯化的蛋白为Cap蛋白,纯化的融合蛋白用His标签抗体进行免疫印迹检测,可在约29 kD处检测到单一条带(图1-D)。以上结果表明,PCV2b Cap融合蛋白被成功表达和纯化。

图1 PCV2b-Cap融合蛋白的表达及纯化
2.2 抗PCV2b Cap蛋白多克隆抗体的制备及抗血清效价测定
为了制备抗PCV2b Cap蛋白多克隆抗体,将纯化后的Cap蛋白免疫新西兰白兔,三免后采集血清,以ELISA测定抗血清的效价,结果显示本次制备的抗血清效价最高可达1∶107(图2、表2)。以上结果表明纯化的截短型Cap蛋白具有良好的免疫原性,并成功获得了高效价的抗PCV2b Cap抗血清。

图2 ELISA检测抗PCV2b Cap蛋白多克隆抗体效价
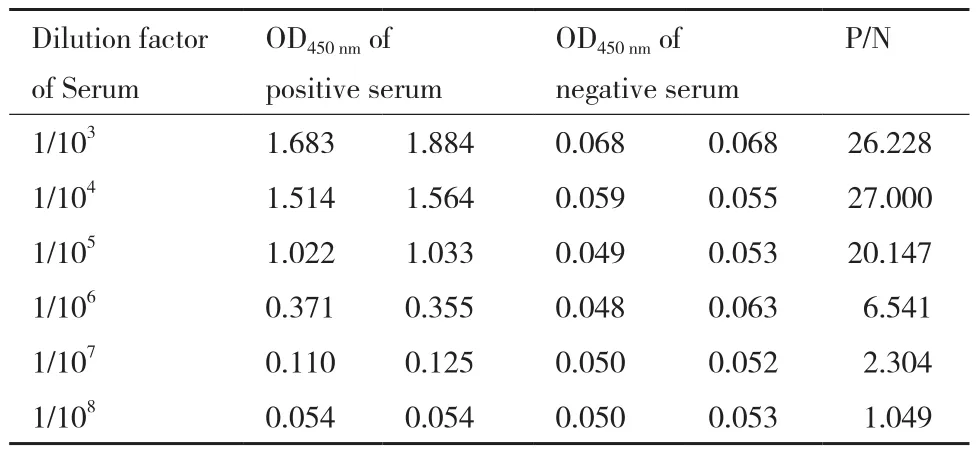
表2 抗PCV2b Cap蛋白多克隆抗体效价P/N值
2.3 抗血清的纯化及多克隆抗体特异性检测
为了检测所制备的抗血清的特异性,将抗血清进行稀释作为一抗对感染PCV2b的细胞样品进行了免疫印迹检测。结果显示,与未感染PCV2b的对照样品相比,抗血清可在感染PCV2b细胞裂解样品中约29 kD处检测到明显的差异表达条带(图3-A),但同时有非特异性条带。为了提高抗体的特异性,将制备的抗血清利用辛酸-硫酸铵沉淀法进行纯化,将纯化后的IgG进行SDS-PAGE和考马斯亮蓝染色检测,可看到明显的重链和轻链两条带(图3-B)。利用纯化的IgG多克隆抗体对感染PCV2b的细胞裂解样品进行免疫印迹检测,发现纯化后的IgG特异性增强(图3-C)。为进一步验证该抗体效价,分别对抗体进行了不同比例稀释,利用同一PCV2b感染的细胞样品检测,发现在相同曝光强度下,纯化后的多克隆抗体在1∶20 000稀释的情况下仍可见特异的目的条带(图3-D),表明该多克隆抗体具有较高的抗体效价。

图3 抗PCV2b Cap多克隆抗体的纯化及特异性检测
2.4 应用抗Cap多克隆抗体进行免疫荧光和免疫组化检测
为了证明纯化的多克隆抗体是否可用于免疫荧光和免疫组化检测,分别以1∶500和1∶50稀释抗体对PCV2b病毒感染的PK15细胞进行免疫荧光实验和人工感染PCV2b的小鼠肝、脾、肾等组织进行免疫组化检测。结果显示,制备的抗Cap蛋白多克隆抗体可以检测到特异性的红色荧光(图4-A)和特异性组化显色褐色(图4-B)。与之对应,对照细胞和对照组织中则均为阴性。以上结果表明纯化后的抗Cap多克隆抗体可以特异性识别PCV2b病毒,并能够应用于免疫荧光和免疫组化染色。

图4 免疫荧光和免疫组化分析纯化的抗Cap多克隆抗体的特异性
2.5 抗Cap多克隆抗体对临床分离毒株的检测
为了进一步验证该多克隆抗体对于其他PCV2b分离毒株的检测效果,从PCR检测PCV2单阳性的临床病猪肝脏、肺脏和淋巴结中分离了3株PCV2b毒株(PCV2b 1-3)(图5-A)。对ORF2序列鉴定为PCV2b毒株,氨基酸序列比对发现分离的3株PCV2b毒株与制备抗体的毒株为不同的毒株(图5-B)。利用免疫印迹检测这些分离株感染的PK-15细胞,结果显示制备抗体均能检测到3株不同PCV2b的Cap蛋白表达(图5-C),表明该多克隆抗体可用于临床PCV2b感染的检测。

图5 抗Cap多克隆抗体检测临床分离PCV2b的病毒感染
3 讨论
PCV2感染会引发猪的免疫抑制,使机体抵抗力下降,继发其他病原感染导致猪圆环病毒相关疾病,给全球养猪业带来了巨大的经济损失。目前对于PCV2的致病机制不清楚,PCV2特异性的抗体是研究病毒感染与致病机制的重要工具之一。目前已有的商品化抗PCV2 Cap蛋白的抗体主要以PCV2a型为主,但自2003年以来猪场PCV2毒株基因型已发生由a型向b型的转变,PCV2b型成为国内主要流行毒株[21],毒力最强。研究发现新的PCV2b变异株不断出现,这些变异株表现为PCV2衣壳蛋白氨基酸序列的突变[20],导致商品化的抗体难以适用于临床分离的PCV2b变异株的检测。PCV2编码的Cap蛋白是病毒的主要结构蛋白,含多种抗原表位,也是病毒的主要免疫原[22],是制备检测PCV2抗体的理想抗原。
目前,国内外已有许多学者利用原核或真核表达系统表达了PCV2b Cap蛋白,制备抗PCV2b Cap的抗体。通过大肠杆菌表达全长PCV2 Cap蛋白主要是包涵体形式,且产量极低,而包涵体中Cap蛋白不利于抗原表位的展示[23]。利用杆状病毒表达系统表达Cap蛋白,虽实现了蛋白的可溶性表达,但表达量低,成本较高[10]。PCV2病毒的ORF2基因编码的N端41位氨基酸为核定位信号肽(Nuclear localization signal,NLS),序列中30%为大肠杆菌稀有密码子[24-25]。因此,表达ORF2全长时常导致蛋白表达量低。值得注意的是,PCV2 Cap蛋白的重要抗原决定簇并不在NLS中[13]。因此,本研究构建了不含NLS的原核表达载体pET-30a-ORF2,利用大肠杆菌表达PCV2 Cap蛋白,同时优化表达条件,实现了Cap的可溶性表达,便于后续纯化及抗原表位的充分展示。
已有学者利用纯化Cap蛋白制备单克隆抗体[12,26],虽特异性强,但抗原表位单一,而PCV2病毒的变异速度快,平均每年每个位点为1.2×10-3替换[27],因此多克隆抗体更适用于PCV2b的临床检测。本研究利用纯化的Cap蛋白制备了兔源多克隆抗体,检测其效价可达1∶107,与已报道多抗效价 1∶105相比[11,28],抗体效价有了显著性提高。与之对应,本研究的抗体经1∶20 000稀释进行免疫印迹,仍可获得特异条带。其原因可能是可溶形式的Cap蛋白,更接近天然蛋白的结构,免疫原性强。此前的研究表明PCV2可以通过多种接种方式感染小鼠,包括腹腔注射、滴鼻、口服和肩胛骨区域肌肉注射等[17-18,29-30]。为了验证制备的抗体是否能够应用于检测体内感染的PCV2,我们通过腹腔注射建立了病毒感染小鼠模型。已有研究表明每只小鼠腹腔注射 PCV2b 剂量可在 104-105PFU[17-18,29],攻毒3 d后组织中病毒拷贝数明显增加,而5 d后则明显降低[18]。本研究以3.5×104PFU接种3 d后进行免疫组化分析,可在PCV2感染的多个组织中检测到特异性染色。证明该抗体可以用于检测体内感染的PCV2b。另外,应用抗体进行免疫荧光检测也显示较好的特异性。
4 结论
本研究以纯化的不含NLS的PCV2b Cap蛋白作为免疫原,成功制备了特异、高效价的、具有广泛应用的多克隆抗体,为PCV2b的临床检测及深入研究圆环病毒的致病机制以及与宿主的相互作用机制提供了有效的候选工具。
