新型鸭呼肠孤病毒的分离鉴定及其σC 基因遗传进化分析
2020-08-04孟照洁高玉龙祁小乐刘长军崔红玉王笑梅
罗 丹,高 立,孟照洁,高玉龙,李 凯,祁小乐,刘长军,崔红玉,王笑梅,3*
(1. 中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室/禽免疫抑制病创新团队,黑龙江 哈尔滨 150069;2. 山东和康源生物育种股份有限公司,山东 济南 271018;3. 江苏省动物重要疫病与人畜共患病协同创新中心,江苏 扬州 225009)
新型鸭呼肠孤病毒(Novel duck reovirus,NDRV)病是一种以肝脾不规则坏死、出血斑/点和心肌、腔上囊出血为主要特征的疫病,其发病率和病死率差异较大,且患病鸭日龄愈小,发病率、病死率愈高[1-2]。2005 年冬季以来,该病在福建、广东、浙江、安徽等番鸭、半番鸭、北京鸭、麻鸭养殖地相继暴发[3-5]。NDRV 感染后可引起患鸭免疫器官萎缩或坏死等病变,成为严重危害养鸭业健康发展的重要免疫抑制性疾病。近年来,NDRV 病发病率仍呈逐年上升趋势,发病范围逐渐扩张,感染宿主谱变广,给水禽养殖业带来严重经济损失[6-7]。
2006 年刘红等首次从北京鸭坏死脾病料中分离到一株NDRV[3],随后,陆续从番鸭、北京鸭、鹅等水禽中分离到多株NDRV[4-7]。本研究于2019 年从山东省某养鸭企业25 份樱桃谷鸭脏器组织中分离出3株NDRV,将该3 株病毒与2016 年~2017 年分离的2株NDRV 进行生物学特性的比较,并分析其σC 基因同源性及遗传进化关系,以探究该企业不同年份分离病毒的生物学特性差异,以期为鸭呼肠孤病的流行病学调查积累资料,并为防控该病提供参考依据。
1 材料与方法
1.1 病料样品、病毒和鸡胚25 份病料样品来自山东某养鸭企业,其中关节组织12 份,肝脏组织8 份,脾脏组织4 份,关节脓液1 份,按送检顺序分别将病料命名为arthrosis/duck/SD19/6301-6308、arthrosis/duck/SD19/7301-7304、liver/duck/SD19/6203-6206、liver/duck/SD19/7301-7304、spleen/duck/SD19/7301-7304、pus/duck/SD19/7304。感染鸭后期出现瘸腿、站立不稳、肌腱断裂等症状,病理剖检显示部分鸭出现明显的脾坏死。 细胞培养病毒液1 份,为2016 年从该养鸭企业鸭的坏死脾脏组织中分离的病毒;鸭胚尿囊液1 份,为2017 年从该养鸭企业的鸭坏死脾脏组织中分离的病毒;上述两份病原未被确定是否为NDRV。SPF 鸡胚由中国农业科学院哈尔滨兽医研究所实验动物中心提供。
1.2 主要试剂pMD18-T 载体、TRIzol 试剂、E. coli DH5α感受态细胞、DL2000 DNA Marker、Premix Taq预混酶均购自宝生物工程(大连)有限公司;核酸凝胶回收试剂盒、病毒DNA/RNA 提取试剂盒和质粒小提试剂盒均购自Axy Prep 公司;Phanta Max Super-Fidelity DNA Polymerase 购自南京诺唯赞生物科技有限公司;M-MLV Reverse Transcriptase 购自Invitrogen公司。
1.3 病料样品处理取适量病料组织,加入1 mL灭菌PBS 研磨,得到混悬液,反复冻融3 次,8 000 r/min(4 ℃)离心5 min,取上清液,用0.22 μm滤器过滤除菌后置于-20℃保存备用。
1.4 病料样品的RT-PCR 鉴定根据GenBank 中登录的NDRV S1 基因参考序列(KJ879930),选取其保守区域设计NDRV 的特异性检测引物,上游引物:5'-GTTGAGACGCCTGACTAC-3'/下游引物:5'-GGAT⁃GCTTGGAGTGAGAC-3',由吉林库美生物科技有限公司合成。取1.3 病料样品研磨液各200 μL,用TRIzol试剂提取其总RNA,反转录为cDNA,具体步骤参见说明书。
以上述cDNA 为模板进行PCR 扩增。PCR 扩增程序:95 ℃5 min;95 ℃30 s,58 ℃30 s,72 ℃1 min,35 个循环;72 ℃10 min;4 ℃保存。PCR 产物经1.0%琼脂糖凝胶电泳检测,预期扩增片段大小为373 bp。鉴定为阳性的病料样品将进行后续的病毒分离。
1.5 病毒的分离培养与传代将上述鉴定为阳性的病料样品滤液及2016 年分离病毒细胞培养液和2017年分离病毒鸭胚尿囊液分别经卵黄囊接种4 枚7 日龄的SPF 鸡胚,0.1 mL/枚,置于37 ℃继续培养,同时设置正常鸡胚对照。逐日观察鸡胚的存活情况,收获死亡鸡胚的尿囊用于下一代鸡胚接种,依次连续盲传3 代,将每代收获的尿囊液经1.4 的PCR 鉴定为阳性后置于-20 ℃保存备用。
1.6 分离病毒的外源病毒检测分别采用TRIzol 法和核酸提取试剂盒提取1.5 获得的5 株分离病毒的F3代尿囊液的RNA 及DNA,并将RNA 反转录为cD⁃NA。以提取的DNA 或cDNA 为模板,利用1.4 中设计的NDRV 特异性引物和鸭瘟病毒(DPV)引物[8]、禽流感病毒(AIV)M 基因检测引物(农业行业标准《NYT772-2013》)、鸭肝炎病毒(DHV)检测引物[9]、鸭坦布苏病毒(DTMUV)检测引物[10]、鸭细小病毒(GPV)检测引物[11]、番鸭呼肠孤病毒(MDRV)检测引物[12]分别进行PCR扩增,以检测分离病毒的外源病毒。
1.7 动物回归试验将18 只1 日龄雏鸭随机分成6组,每组3 只,其中5 组分别感染NDRV 分离病毒,1组为空白对照组。将上述分离病毒的F3 代鸡胚尿囊液均经腿部肌肉注射感染雏鸭,0.1 mL/羽,对照组注射等量PBS。采用隔离器饲养,保证充足的饮水、采食和光照,定时观察并记录雏鸭发病状况,观察期为14 d。接种后第14 d,颈静脉放血迫杀所有雏鸭,剖检并观察其肝脏和脾脏的病理变化。同时采集其肝、脾组织,经研磨无菌处理后接种7 日龄SPF 鸡胚,再次进行病毒分离,取其F3代的培养液经1.4的RT-PCR鉴定,PCR产物由吉林库美生物科技有限公司测序。
1.8 分离病毒的体外细胞培养特性将上述1.5 中获得的5株分离病毒的F3代尿囊液分别接种原代鸡胚成纤维细胞(CEF)及传代Vero细胞,置于37 ℃、5%CO2培养5 d ~7 d,同时分别设正常细胞对照。连续培养5代,观察每代病毒增殖产生的细胞病变(CPE)情况。
1.9 分离病毒σC 基因的PCR 扩增、同源性及遗传进化分析根据GenBank 登录的NDRV σC 基因序列(KF729982)设计一对特异性引物σCF:5'-ATG⁃GATCGCAACGAGGTGATA-3'/σCR: 5'-CTAGCCCGT⁃GGCGACGGTGAA',利用设计的引物对获得的5 株分离病毒分别进行RT-PCR 扩增,预期扩增产物长度为966 bp。利用生物信息学软件DNAStar、Mega6.0 及在线 软 件Multalin(http://multalin.toulouse.inra.fr/multalin/multalin.html)分析5 株分离病毒之间及其与GenBank登录的NDRV、番鸭呼肠孤病毒(MDRV)及禽呼肠孤病毒(ARV)代表株的σC 基因及其编码的氨基酸序列的同源性;利用Mega 6.0 软件构建分离病毒的σC 基因的进化树,并分析其与上述NDRV、MDRV、ARV的遗传进化关系。ARV138 株(Chicken/1998,Canada)、S1133 株(Chicken/1974,USA)为ARV 的参考株;MS01株(Chicken/2015,China)为本实验室分离的ARV[13]。
2 结 果
2.1 病料样品的RT-PCR 鉴定结果以25 份病料样品的cDNA 为模板,利用1.4 的引物进行PCR 扩增。结果显示,病料样品arthrosis/duck/SD19/6304、arthrosis/duck/SD19/6307、pus/duck/SD19/7304 均 可 扩增到一条370 bp 左右的目的条带,与预期大小一致,表明上述3份病料样品可能存在NDRV的感染。
2.2 病毒的分离及传代将上述经RT-PCR 鉴定为NDRV 阳性的3 份组织混悬液过滤除菌,并与2016年、2017 年的分离病毒分别经卵黄囊接种7 日龄鸡胚。结果显示,接种鸡胚均在36 h~60 h 内死亡,致死率100%。死亡胚胎蜷缩、出血,胚体水肿,个别胚体甚至形成淤血斑。对照鸡胚生长良好,无任何上述症状出现。将上述死亡鸡胚尿囊液连续传代3 次,收获其尿囊液经PCR鉴定为阳性后备用。
2.3 分离病毒的外源病毒检测将2.2 收获的5 株分离病毒的F3 代尿囊液分别经AIV、DHV、DT⁃MUV、GPV、MDRV、NDRV 的PCR 检测,结果显示5 株分离株仅NDRV 检测为阳性,其它病毒检测均为阴性,表明分离病毒均纯净性良好。
2.4 动物回归试验结果5 株NDRV 分离病毒的F3代鸡胚尿囊液感染雏鸭后,在整个观察期内均仅有个别雏鸭出现喜卧,精神沉郁,食欲减退,总体发病症状不明显,无雏鸭死亡现象。感染后第14 d,剖杀所有雏鸭,剖检显示脾脏明显肿大,呈暗红色,并伴有不同程度的坏死。取肝脏和脾脏研磨后经卵黄囊途径接种7 日龄SPF 鸡胚,接种鸡胚均在36 h~60 h 内死亡,且100%致死鸡胚,死亡胚胎蜷缩、出血,胚体水肿等,与病毒初次分离接种鸡胚时的症状一致,而对照鸡胚生长良好,无任何上述症 状 出 现。其F3 代 的 培 养 液 经1.4 的RT-PCR 鉴 定结果均为阳性,测序结果显示扩增的目的基因均为NDRV S1 基因片段序列,以上结果表明5 株NDRV分离病毒的动物回归试验成立。将2019年分离获得的3 株NDRV,分别命名为NDRV-SD19/6304、NDRVSD19/6307 和NDRV-SD19/7304;将2016 年、2017 年分离的2 株NDRV 分别命名为NDRV-SD19/6201 和NDRV-SD19/6202。
2.5 分离病毒的体外细胞培养特性分别将5 株NDRV 分离病毒接种原代CEF 及传代Vero 细胞,观察其CPE。结果显示,NDRV-SD19/6304、NDRVSD19/6307、NDRV-SD19/7304 及NDRV-SD19/6201 株病毒在两种细胞中均可增殖,产生明显CPE(图1)。而NDRV-SD19/6202 株仅在Vero 细胞中增殖产生明显CPE(图1A),其在CEF 中连续盲传至5 代仍观察不到明显CPE。而其余分离病毒均在CEF中产生典型的CPE:接种病毒48 h 后细胞融合聚集成簇,形成合胞体,部分细胞脱落;72 h 后,80%细胞死亡、脱落,贴壁细胞数目明显减少。以上结果表明,2017年的分离病毒与2016 年及新分离的3 株病毒在体外细胞中的生长特性存在较明显差异。
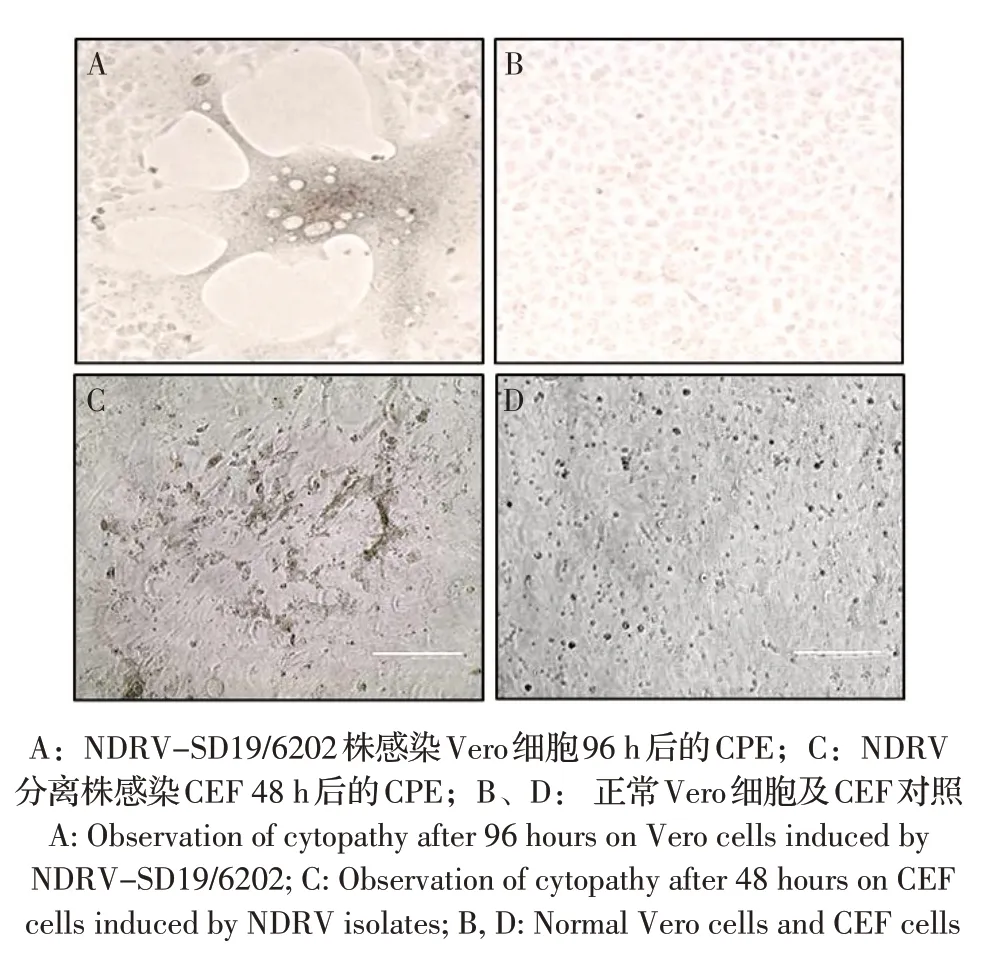
图1 NDRV 分离病毒体外感染细胞后的CPE 观察Fig.1 The observation of cytopathy induced by NDRV isolates
2.6 分离病毒σC 基因的RT-PCR 扩增结果利用本研究设计合成的NDRV σC基因的特异性引物,对上述5 株分离病毒进行RT-PCR 扩增。结果显示均可获得约1 000 bp的目的条带,与预期一致(图2)。以上结果进一步表明,分离的5株病毒均为NDRV。
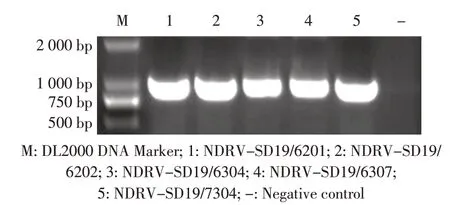
图2 5 株分离病毒的σC 基因的RT-PCR 扩增结果Fig.2 Amplification of σC gene of five NDRV isolates by RT-PCR
2.7 分离病毒σC 基因同源性及遗传进化分析利用DNAStar 软件,对5 株分离病毒σC 基因的核苷酸及编码的氨基酸序列分别进行同源性分析。结果显示NDRV-SD19/6202 株与其余4 株分离病毒的核苷酸序列同源性为95.7%~95.8%,氨基酸序列同源性为95.7%~96.0%。5 株分离病毒与其他NDRV 分离株相应基因核苷酸序列同源性为90.0%~98.2%,与MDRV分离株相应基因核苷酸序列同源性为29.6%~46.1%。利用Mega 6.0 软件,将5 株分离病毒与其他NDRV、MDRV 及ARV 代表株的σC 基因序列进行遗传进化分析,结果显示,所有病毒株分为明显的2 个分支即鸡源分支和水禽源分支,而水禽源分支又分为经典MDRV 分支和NDRV 分支,本研究中5 株分离病毒均位于NDRV 分支,其中NDRV-SD19/6201、NDRVSD19/6304、NDRV-SD19/6307、NDRV-SD19/7304 遗传距离较近,处于同一小分支,而NDRV-SD19/6202与2013 年分离株HN5d-KT861593 处于同一分支,遗传关系较近(图3)。上述结果表明,源于同一养殖企业不同时间分离的NDRV,其主要保护性抗原σC 蛋白的基因序列存在的较大差异,提示该地区NDRV 随着时间的推移发生了变异。
利用Multalin 在线软件对在CEF 中复制特性不同的两株分离病毒NDRV-SD19/6201 与NDRV-SD19/6202 的σC 基因编码氨基酸序列进行比对分析,结果显示两者之间存在13 个氨基酸差异位点,分别位于第P9L、Y16C、T25K、I64T、E65D、L66M、G74S、L87V、T91L、A132S、V298A、I306T、R310Q位(图4)。以上结果表明,以NDRV-SD19/6201 为代表的CEF 适应株与CEF非适应株NDRV-SD19/6202 之间,在σC 基因核苷酸及其编码的氨基酸水平上均存在一定的遗传距离及差异,但该差异位点是否是造成两株分离病毒复制特性差异的关键位点还需要进一步研究。

图3 NDRV 分离株的σC 基因核苷酸序列遗传进化分析Fig.3 Phylogenetic analysis based on the σC nucleotide sequences of NDRV isolates
3 讨 论
本研究于2019 年从山东省某养鸭企业送检的25份樱桃谷鸭脏器组织中分离到3 株NDRV,将其与2016 年、2017 年分离的NDRV 一起进行生物学特性比较研究。结果显示5 株分离病毒均能100%致死鸡胚,导致死亡鸡胚水肿、全身出血,甚至形成淤血斑。人工感染1 日龄雏鸭均能复制出与临床自然发病鸭相同的临床症状和病理变化,并能从感染雏鸭组织中再次分离到该病毒。病毒体外培养特性研究表明,5 株分离病毒均能在Vero 细胞中增殖,产生明显的CPE;但在CEF 中的生长特性存在明显差异:2017 年分离的NDRV-SD19/6202 株在CEF 中连续盲传5 代也不能产生明显CPE,表明该株病毒不能在CEF 中良好增殖,而其余4 株分离病毒均能在CEF 中产生典型的CPE,造成此差异的具体原因有待进一步研究。
病毒σC 蛋白是由NDRV 的S1 基因编码,全长321 个氨基酸,是构成病毒粒子外层衣壳的主要蛋白,可以诱导机体产生保护性中和抗体[14];另一方面,σC 蛋白作为病毒结合细胞受体的主要位点,对病毒的吸附、增殖和合胞体的形成起重要作用,并能促进病毒的侵袭[15]。为了研究分离病毒与其他禽类呼肠孤病毒的遗传关系,本研究克隆了该蛋白基因,并对其进行同源性分析。结果显示,NDRV-SD19/6202株与其余4 株分离病毒的遗传距离较远,与其核苷酸序列同源性为95.7%~95.8%,氨基酸序列同源性为95.7%~96.0%。遗传进化分析显示,5株分离病毒均位于NDRV 分支,其中NDRV-SD19/6201、6304、6307、7304 遗传距离较近,位于同一小分支内,与NDRVSD19/6202 遗传距离较远;NDRV-SD19/6202 与NDRV分离株HN5d-KT861593 处于同一进化分支,二者亲缘关系较近。HN5d 株病毒为郑献进等于2013 年从北京鸭分离的一株具有高致病性的NDRV[16],其在Vero细胞中也具有良好的复制能力且产生明显的CPE,但对其是否能在CEF中复制并产生CPE并没有报道。遗传距离的差异可能是造成NDRV-SD19/6202 株与其余4 株分离病毒在CEF 中产生复制差异的一个原因。以上结果表明,源于同一养殖企业不同时间分离的NDRV 病毒株在其主要保护性抗原σC 蛋白的基因序列呈现多样性,提示该地区NDRV 随着时间的推移在不断发生着变异,但该5 株分离病毒σC 蛋白基因的遗传进化与其分离时间无明显密切相关性。
为进一步探究造成上述分离株在CEF 中复制差异产生的原因,本研究选取NDRV-SD19/6201 作为适应CEF 增殖的代表株,与非适应CEF 增殖的NDRV-SD19/6202 株的σC 蛋白氨基酸序列进行比对,结果显示两株病毒之间共存在13 个差异位点。有研究报道显示,σC C 端的aa151~aa326 位点为呼肠孤病毒的受体结合区域[17],上述差异位点中第298、306 及310 位氨基酸位点均位于该区域内,该3 处位点或其它位点的差异是否是造成NDRV-SD19/6202 株与其余4 株分离病毒在CEF 中复制产生的差异还需要进一步研究。
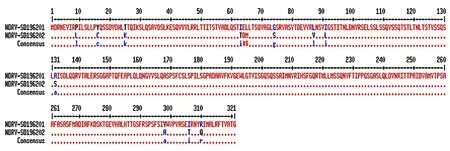
图4 两株NDRV 分离病毒σC 基因编码氨基酸序列的比对分析Fig.4 Analysis of σC amino acid sequences of two NDRV isolates
综上,本研究对从同一养鸭企业2016 年~2019年分离获得的5 株病毒进行了比较研究,结果表明5株分离病毒均位于NDRV 分支,但它们之间的复制特性存在明显的差异,其诱导保护性中和抗体产生的σC 蛋白氨基酸序列之间存在多个差异位点,提示NDRV 存在不断的遗传变异,应持续开展该病的流行病学调查以深入了解NDRV 的遗传进化特征和基因变异情况,为有效防控NDRV 感染的疾病提供参考。
