高温胁迫对小麦花药活性氧代谢的影响
2020-07-31卢奕霏顾迎港侯泽豪张迎新方正武马东方刘易科朱展望张改生王书平
卢奕霏,顾迎港,陈 威,王 娜,康 珍,侯泽豪,张迎新,方正武,马东方,刘易科,朱展望,张改生,王书平,4
(1.长江大学农学院/主要粮食作物产业化湖北省协同创新中心,湖北荆州 434025; 2.湖北省农业科学院粮食作物研究所,湖北武汉 4300643; 3.西北农林科技大学农学院,陕西杨凌 712100; 4.湖北荃银高科种业有限公司,湖北荆州 434025)
随着大气中CO2和其他温室气体排放量的逐年升高,地球表面平均温度也在日益增高,温室效应给全球农业生产带来极大危害[1-2]。研究表明,气温升高1 ℃以上时,小麦产量开始快速下降,升高3 ℃时,产量降低20%左右[3-4]。在小麦对逆境响应机制的研究中,有关干旱、盐胁迫和低温胁迫的研究较多,而关于高温胁迫对小麦影响的研究仍不全面系统。因此,探索小麦高温胁迫响应机制,了解小麦耐热性的分子遗传基础及机理进而提高其的抗热性尤为重要。
Driedonks等[5]研究表明,高温胁迫会造成植物细胞内的氧代谢失调,增加细胞发生氧化损伤的风险。郑 飞等[6]研究表明,高温胁迫能显著提高冬小麦旗叶中丙二醛(MDA)的含量,加速叶片衰老。刘洪展等[7]研究了不同高温胁迫对小麦叶片中活性氧(ROS)代谢的影响,结果表明,在轻度高温胁迫下,超氧化物歧化酶(SOD)活性增强,过氧化氢酶(CAT)活性稍微下降;在严重高温胁迫条件下,SOD活性最终表现出减弱的趋势,CAT活性则有所上升。郭洪雪等[8]对二叶期小麦叶片分别进行1 h、12 h、24 h和36 h 高温处理,发现SOD活性及MDA含量呈现先上升后下降的变化趋势。目前为止,还未见有关高温胁迫影响小麦花药不同生育期ROS代谢的研究。
高温胁迫会导致植物细胞的ROS代谢平衡失调,而ROS代谢平衡失调是引起作物雄性不育的重要生理原因之一[9]。前人研究结果表明,短时高温胁迫(42±1)℃使小麦花药彻底败育(败育率100%)[10]。处于生殖生长阶段的小麦对温度最为敏感,当外界环境温度达到一定的阈值时,可引起小麦花药氧化还原体系的紊乱,造成花药的氧化胁迫。因此,本研究以小麦不同发育时期的花药为材料,通过对高温胁迫下小麦花药细胞内ROS积累进行观察,以及比较分析ROS的生成速率和抗氧化酶的活性,揭示高温胁迫下ROS代谢的动态变化与小麦花药败育的关系,探索小麦花药高温胁迫响应机制,为进一步解析小麦耐热性的分子遗传基础及机理,提高小麦的耐热性提供依据。
1 材料与方法
1.1 材料处理
供试小麦品种为西农1376。待花药发育至单核早期,于人工气候室中进行高温胁迫处理,设置温度分别为(42±1)℃(高温胁迫处理)和(25±1)℃(对照),湿度为(70±5)%,每天处理3 h,共3 d,此时花药已发育至单核后期。在4 ℃条件下分别收集单核后期、二核期和三核期的花药,取样时期的确定按Wang等[11-12]的方法进行。
1.2 ROS染色
采用二氨基联苯胺(3,3′-diaminobenzidine-HCl, DAB)染色检测法[13],将不同发育时期的小麦花药置于DAB溶液(0.1 μg·mL-1DAB, 50 mmol·L-1三羟甲基氨基甲烷(Tris)-醋酸缓冲液,pH 5.0)中,真空渗透 15 min,25 °C黑暗条件下 150 r·min-1振荡24 h。染色后的花药经蒸馏水漂洗后置于85%乙醇溶液中70 °C水浴15 min,待叶绿素完全褪去后置于乳酸∶苯酚∶水(体积比1∶1∶1)溶液中保存,在光学显微镜下观察并拍照。
1.3 酶液制备
称取花药1 g,在液氮中迅速研磨成粉末状,加入 10 mL 预冷的提取液(0.1 mol·L-1Tris-HCl、pH 7.8,0.5 mmol·L-1EDTA 和1% PVP),然后于4 ℃下 3 000 g离心 10 min,取上清液,再以13 000 g离心 15 min,上清液即为酶提取液,低温保存供酶活性测定。ROS指标和酶活性指标均重复测定3次。
1.4 超氧阴离子自由基产生速率及过氧化氢(H2O2)和丙二醛(MDA)含量的测定

H2O2含量按Patter-son等[15]的方法测定,并略有改动,取5%硫酸钛0.1 mL和17 mmol·L-1氨溶液0.2 mL 加入酶液中,用丙酮冲洗5次,静置沉淀后用5 mL 2 mmol·L-1硫酸铵溶解,在410 nm处测其吸光值,含量以 nmol·g-1FW表示。
MDA含量按Wang等[16]修改的方法测定,以nmol·mg-1protein 表示。即1 mL 0.6%TBA(硫代巴比妥酸)与1 mL酶液混合后100 ℃水浴加热30 min,迅速冰浴降温,二次离心后记录 532 nm、600 nm、450 nm 处的吸光值。
1.5 酶活性的测定
SOD 活性的测定按王爱国等[17]的方法进行,并略有改动,利用抑制氮蓝四唑在荧光下的还原作用,将每3 mL反应液(1.3 μmol·L-1核黄素、13 mmol·L-1甲硫氨酸、63 μmol·L-1NBT、0.05 mol·L-1pH 7.0磷酸缓冲液)中加入适量酶液后于4 000 lx荧光灯下光照15 min,以缓冲液作空白,在560 nm下测其吸光值。以抑制NBT 光化还原作用50 %的酶量为1个酶活性单位。
POD 活性按Wang等[11]的方法进行测定。CAT 活性参照Ba等[18]的方法测定。
1.6 统计分析
试验设置三个生物学重复,每个重复进行三次测量。采用Microsoft Excel 2010进行数据整理,采用IBM SPSS Statistics 19软件进行差异显著性分析。
2 结果与分析
2.1 高温胁迫对小麦花药细胞ROS的影响
正常发育的小麦花药经高温胁迫后用DAB染色检测ROS的积累情况,结果(图1)发现,正常发育的小麦花药从单核后期至三核期DAB染色程度均较弱,染色斑点较少(图1A~图1C)。而高温胁迫后的花药从单核后期即可检测到明显的DAB染色斑点(图1D),在花药二核期时DAB染色强度最强,并与对照的差异最明显(图1E),且在各发育时期花药的DAB染色程度(图1D~图1F)均高于对照组。这表明高温胁迫造成了花药内ROS代谢的紊乱,使花药始终处于氧化胁迫的状态,进而影响花药的正常发育。

A~C:对照组; D~F:高温胁迫组;A、D:单核后期;B、E:二核期;C、F:三核期。比例尺:0.5 mm。
2.2 高温胁迫对小麦花药中产生速率、H2O2和MDA含量的影响

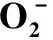
表1 花药经高温胁迫后不同发育期的产生速率、和MDA含量
植物组织中积累的ROS会导致脂膜过氧化,产生MDA,其浓度是判断脂质过氧化程度和膜系统伤害大小的主要指标[11-12]。MDA含量在对照组花药的整个发育过程中均比较稳定,而高温胁迫后的花药MDA含量则呈现先升高后下降的趋势,且在二核期时达到最大值,为2.95 nmol·g-1,是对照组的1.59倍,差异显著。此外,在单核后期和三核期时,MDA 的含量与对照相比差异显著,分别为对照的1.09倍和1.34倍。这说明高温胁迫对花药细胞膜造成了持续的 损伤。
2.3 高温胁迫对小麦花药中SOD、POD 和CAT 活性的影响

由表2可知,在正常发育的小麦花药中,POD活性从单核后期到二核期比较稳定,分别为46.14和46.50 U·g-1FW·min-1,发育至三核期则急剧上升,达到86.66 U·g-1FW ·min-1。而高温胁迫后花药的POD活性呈现先升高再降低的变化趋势,且始终显著低于相同发育时期的对照组,在单核后期、二核期和三核期分别比对照组降低了61.38%、50.62%和88.37%。这说明在高温胁迫的初期POD活性的增强清除了花药内过量积累的部分ROS,但随着后期ROS的不断积累,进而抑制了POD的活性。

表2 花药经高温胁迫后不同发育期的SOD、POD和CAT酶活性
此外,随着小麦花药的不断发育,CAT活性在高温胁迫和对照中均呈持续下降趋势,在不同发育时期间,高温胁迫的花药下降速率显著高于对照,其中对照的下降幅度为27.04%(单核后期至二核期)和10.90%(二核期期至三核期);而高温胁迫后的花药下降幅度为44.07%(单核后期至二核期)和66.52%(二核期期至三核期)(表2)。在相同发育时期,高温胁迫后的花药的CAT活性始终显著低于相同发育时期的对照组,在单核后期、二核期和三核期分别比对照下降了 51.06%、62.48%和85.90%。
3 讨 论


