烯效唑浸种对干旱胁迫下工业大麻幼苗形态、渗透调节物质及内源激素的影响
2020-07-28左官强王晓楠张晓艳韩承伟韩喜财孙宇峰冯乃杰
姜 颖,左官强,王晓楠,张晓艳,韩承伟,韩喜财,曹 焜,赵 越,孙宇峰,冯乃杰
(1.黑龙江八一农垦大学农学院,黑龙江 大庆 163319;2. 黑龙江省科学院大庆分院,黑龙江 大庆 163319)
全球性气候不断变化导致世界各地缺水问题日益严重,进而引发干旱。干旱作为重要的非生物胁迫因子之一,其发生周期短,程度重,对粮食生产构成严重威胁,制约着我国农业的发展[1]。干旱会使植物形态结构、光合能力和生理行为发生变化[2-3],且对植物生长发育和产量产生巨大的负面影响。大麻是世界上最古老的一年生草本植物之一,在中国有数千年的种植历史[4]。δ-9-四氢大麻酚(THC)含量低于0.3%的大麻称之为工业大麻,允许在我国种植。工业大麻作为我国传统的多用途、多功能经济作物,其种子、纤维以及花叶被广泛应用于多个领域中[5-7]。干旱胁迫是限制大麻生长的主要环境因素之一,对大麻的品质和产量造成重大的损失[5]。干旱胁迫会降低大麻种子的发芽势和发芽率,抑制种子胚芽和胚根生长[8],进而影响发芽指数和活力指数。有研究表明,干旱胁迫对大麻萌发初期和快速生长期幼苗和植株的生理特性有明显的影响,对其生长有明显的抑制作用[9-10]。植物生长调节剂的应用可以影响植物体内多种参与逆境代谢相关的生理活动,明显提高植株的抗逆性[11]。烯效唑(S3307)作为一种高效低毒的三唑类植物生长延缓剂[12],具有很强的生长调节能力,主要用于壮苗和抗逆,具有“控上促下”、“前控后促”的效果,可以改变幼苗形态[13],缓解膜脂过氧化程度[14],增强渗透调节能力,改变植物激素的含量和作用方式,使植株生命活动发生改变,最终达到抗逆、增产等一系列效果[15]。
本研究以工业大麻品种“火麻1号”为试验材料,研究了烯效唑对干旱胁迫下工业大麻幼苗形态、渗透调节物质及内源激素的影响,旨在分析烯效唑对干旱胁迫下工业大麻的调控效应,为烯效唑在工业大麻抗逆方面的应用及进一步拓宽工业大麻化控技术的研究提供理论基础和技术支持。
1 材料与方法
1.1 材 料
供试材料为黑龙江省大麻品种“火麻1号”,种子由黑龙江省科学院大庆分院提供。烯效唑(S3307)由黑龙江八一农垦大学化控实验室提供。
1.2 试验方法
用0.4 mg·L-1烯效唑浸种,浸种完成后进行播种,选择发芽较好且长势一致的种子,定植于装有草炭土∶沙子为2∶1(体积比)的花盆中,草炭土pH值6.30。在遮雨棚中进行试验,保证供水一致(维持在田间持水量的70%),直至三叶期(3对真叶)进行处理。试验共设3个处理,分别为:清水浸种,正常供水(CK);清水浸种,三叶期断水(D);烯效唑浸种,三叶期断水(D+S)。干旱胁迫0、2、4、6、8 d以及复水4 d后分别取样进行指标测定。
1.3 指标测定
地上部和地下部干重用烘干称重法测定;根系总根长、体积、表面积、总投影面积、平均直径、根尖数、分枝数和交叉数用加拿大Regent公司生产的根系扫描仪,经数字化软件(WinRHIZO-2004a)分析后获得根系形态数据。
细胞膜透性采用电导法测定[16];可溶性糖含量采用蒽酮比色法测定[17];可溶性蛋白质含量采用考马斯亮蓝(G-250)法测定[18];SPAD值采用CCM-220+手持叶绿素仪测定。
样品中内源激素脱落酸(ABA)、水杨酸(SA)、茉莉酸(JA)含量采用液相色谱-质谱联用法检测。
1.4 数据分析
试验数据采用Excel 2010和SPSS statistics 20软件进行整理、分析,采用OriginPro 9.1绘图软件绘制图片。
2 结果与分析
2.1 烯效唑浸种对干旱胁迫下工业大麻幼苗生物量的影响
由表1可知,干旱胁迫下工业大麻地上部鲜重明显下降,地上部干重积累产生了明显的抑制作用。D+S处理与D处理地上部鲜重在胁迫2 d未出现明显差异,但在干旱胁迫8 d和复水4 d后D+S处理高于D处理,分别高2.36%和2.23%;而地上部干重在胁迫6 d开始恢复,在复水4 d后比D处理高4.38%。由图1可知,D处理下,工业大麻的根系鲜重、根系干重均较CK出现明显的下降,根系鲜重下降了13.19%~25.40%,根系干重下降了23.53%~29.17%;而D+S处理显著提高了根系干鲜重,与D处理相比,根系鲜重增加了16.46%~25.53%,干重增加了46.67%~61.54%。
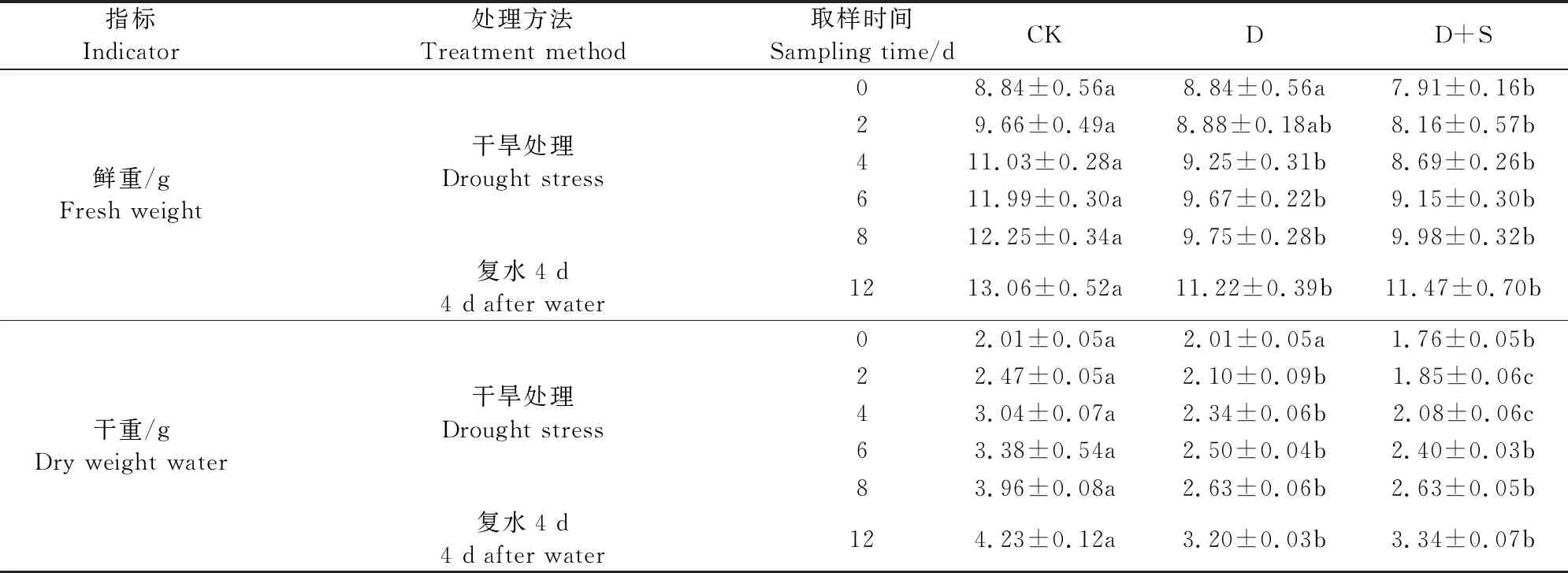
表1 烯效唑浸种对干旱胁迫下工业大麻地上部干、鲜重的影响
2.2 烯效唑浸种对干旱胁迫下工业大麻根系形态指标的影响
研究发现,烯效唑处理后对总根长的影响是多方面的,与正常供水下、干旱胁迫4 d和8 d后相比,烯效唑处理显著增加了工业大麻的总根长,分别增加了84.10%、77.42%和34.48%(图2A)。D+S处理后对根平均直径的影响差异不明显,只在胁迫4 d后比D处理增加5.40%(表2)。随着处理时间的延长,根表面积、根体积和根总投影面积不断增加,D处理较CK有所降低(图2);D+S处理的工业大麻根表面积在处理8d后比D处理高34.77%(图2B);D+S处理的工业大麻根体积在处理0、2、4、6 d和8 d后都显著高于D处理下的根体积,增加了59.66%~93.22%(图2C);根总投影面积在D+S处理4、6 d和8 d后显著高于D处理下的根总投影面积,分别提高了37.47%、69.23%和70.00%(图2D);复水处理4 d后D+S处理根表面积、根体积和根总投影面积与CK差异不显著(图2)。D处理下,根尖数、分枝数和交叉数显著低于CK,在处理8 d后,根尖数、分枝数和交叉数分别比CK降低31.23%、25.78%和42.66%;D+S处理根尖数、分枝数和交叉数显著高于D处理,在处理8 d后,根尖数、分枝数和交叉数分别比D处理增加33.07%、29.62%和54.28%(表2)。
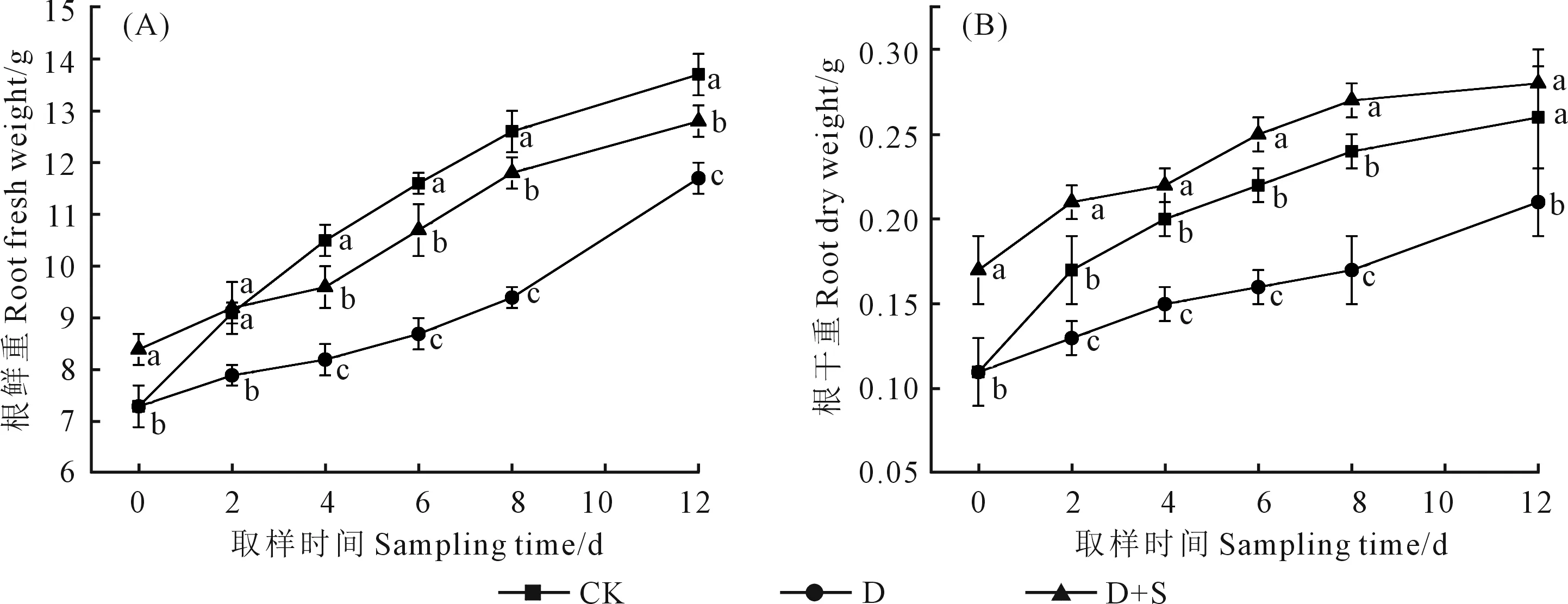
注:不同小写字母表示处理间差异显著(P<0.05)。下同。Note: Different lowercase letters mean significant difference among the treatments (P<0.05). The same below.图1 烯效唑浸种对干旱胁迫下工业大麻根系干、鲜重的影响Fig.1 Effect of seed soaking with uniconazole on fresh and dry root weight of industrial hemp under drought stress
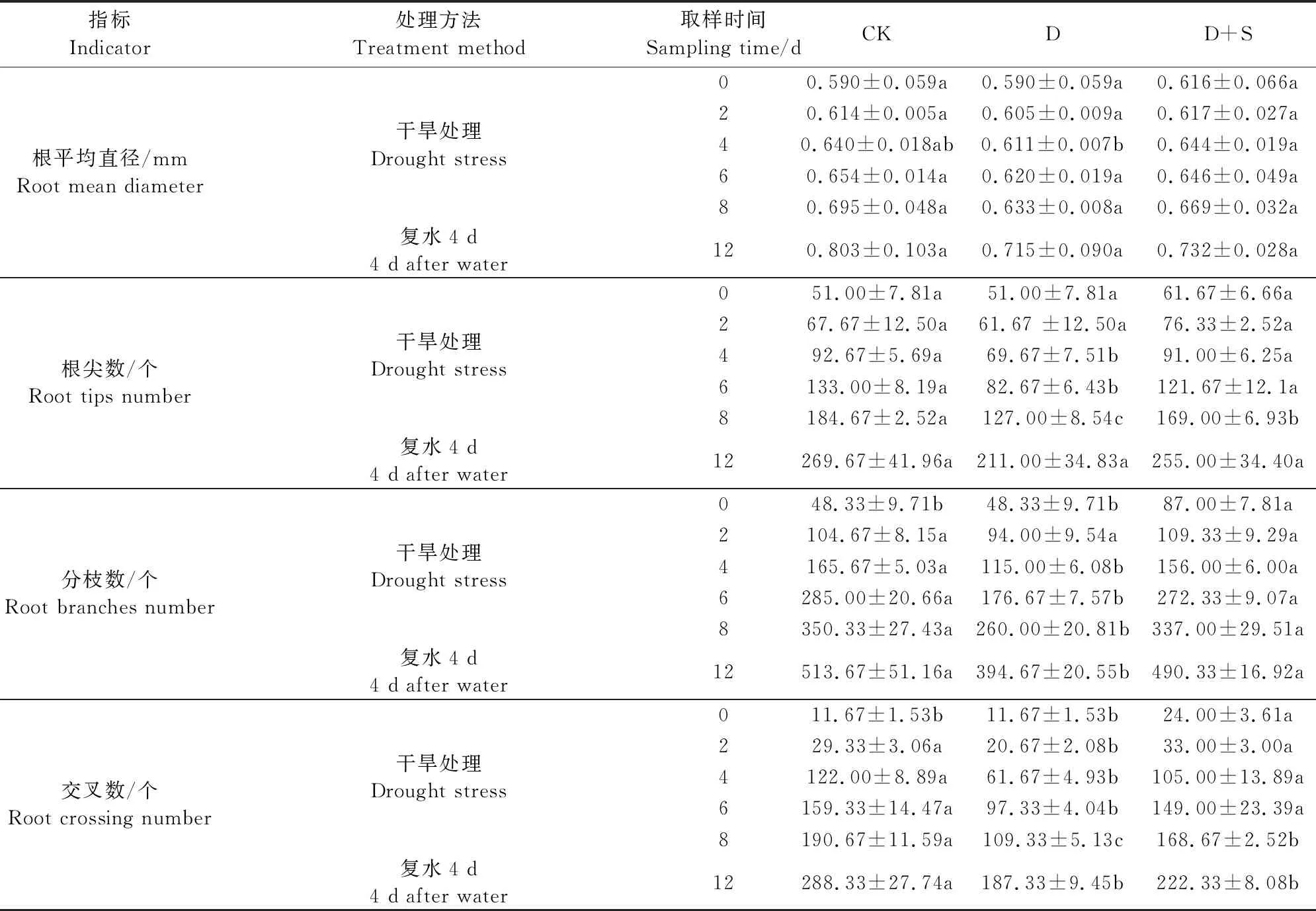
表2 烯效唑浸种对干旱胁迫下工业大麻根系形态的影响

图2 烯效唑浸种对干旱胁迫下工业大麻根长、根表面积、根体积、根总投影面积的影响Fig.2 Effect of seed soaking with uniconazole on root length, superficial area, volume, and projected root area of industrial hemp under drought stress
2.3 烯效唑浸种对干旱胁迫下工业大麻幼苗生理生化指标的影响
2.3.1 烯效唑浸种对干旱胁迫下工业大麻幼苗SPAD值的影响 随着处理天数的增加,各处理的SPAD值呈现出不同的变化趋势。正常供水条件下,SPAD值处于稳定状态;D处理下,SPAD值呈下降趋势,在胁迫4、6、8 d后显著低于CK,分别降低了11.01%、18.33%和27.31%,而在复水4d后得到缓解;D+S处理下,SPAD值显著高于D处理,在胁迫4、6、8 d后分别增加了11.77%、19.87%和28.30%(图3)。可见,烯效唑浸种能提高叶片的SPAD值,对于提高光合作用有明显作用。

图3 烯效唑浸种对干旱胁迫下工业大麻幼苗SPAD值的影响Fig.3 Effect of seed soaking with uniconazole on SPAD value of industrial hemp under drought stress
2.3.2 烯效唑浸种对干旱胁迫下工业大麻幼苗细胞膜透性的影响 工业大麻幼苗遇干旱胁迫导致叶片的细胞膜透性明显增加,并随着胁迫时间的延长不断升高;D处理4、6 d和8 d后,细胞膜透性显著增加,分别是CK的1.26、1.33倍和1.39倍,复水4 d后得到恢复;烯效唑浸种可以显著降低叶片的细胞膜透性,与D处理相比,在胁迫0、2、4、6、8 d和复水4 d后分别减少了11.40%、15.01%、19.46%、22.69%、17.22%和12.08% (图4),这表明烯效唑浸种能够缓解干旱胁迫对工业大麻叶片造成的氧化损伤。

图4 烯效唑浸种对干旱胁迫下工业大麻幼苗细胞膜透性的影响Fig.4 Effect of seed soaking with uniconazole on membrane permeability of industrial hemp under drought stress
2.3.3 烯效唑浸种对干旱胁迫下工业大麻幼苗渗透调节物质含量的影响 干旱胁迫导致了工业大麻叶片内的渗透调节物质——可溶性糖和可溶性蛋白含量均显著增加。D处理可溶性糖和可溶性蛋白含量分别较CK增加了23.08%~123.84%(图5A)和2.44%~8.98%(图5B);复水4 d后可溶性糖和可溶性蛋白含量有所下降,但仍高于对照(图5)。烯效唑浸种进一步促进了叶片内渗透调节物质含量的增加,处理过程中,D+S处理可溶性糖和可溶性蛋白含量分别比D处理增加了17.32%~36.78%(图5A)和5.07%~7.94%(图5B);复水后D+S处理的渗透调节物质含量仍然高于CK和D处理(图5)。

图5 烯效唑浸种对干旱胁迫下工业大麻幼苗可溶性糖和可溶性蛋白含量的影响Fig.5 Effect of seed soaking with uniconazole on soluble sugar and soluble protein content of industrial hemp under drought stress
2.4 烯效唑浸种对干旱胁迫下工业大麻幼苗内源激素的影响
测定干旱胁迫8 d后的CK、D、D+S处理叶片中内源激素——脱落酸(ABA)、水杨酸(SA)和茉莉酸(JA)的含量(图6)。干旱胁迫下,工业大麻叶片中的内源激素ABA、SA和JA含量显著增加,分别比CK增加了163.50%、38.72%和77.67%。D+S处理ABA含量有所增加,但与D处理差异不显著(图6A);而D+S处理显著降低了SA和JA的含量,分别比D处理降低了17.79%(图6B)和14.40%(图6C)。

图6 烯效唑浸种对干旱胁迫下工业大麻幼苗ABA、SA和JA的影响(干旱胁迫8 d)Fig.6 Effect of seed soaking with uniconazole on ABA, SA, and JA of industrial hemp under drought stress (8 d after drought stress)
3 讨论与结论
随着干旱胁迫的延长,植株高度和叶面积减小[19];烯效唑作为一种植物生长抑制剂,能有效地保护植物免受损伤,降低植物高度和叶面积[20-21];而且烯效唑对于缓解逆境胁迫下植株根系的生长具有促进作用[13]。Barnes等[22]研究发现,烯效唑处理对水分胁迫下的松木幼苗的茎有显著的抑制作用,但促进了根系生长。本研究发现在胁迫初期,烯效唑浸种处理的地上部干、鲜重比干旱胁迫处理低,但在胁迫后期慢慢得到恢复,且在复水4 d后比干旱处理植株的地上部干、鲜重分别高出4.38%和2.23%;而烯效唑浸种处理显著提高了地下部干、鲜重,较干旱处理的根系鲜重增加了16.46%~25.53%,根系干重增加了46.67%~61.54%。由此表明烯效唑具有“控上促下”、“前控后促”的效果,即具有延缓地上部生长、促进地下部根系生长的能力[13,23]。工业大麻苗期,主根占主要部分,亦起到主要作用,烯效唑浸种显著增加了总根长,在干旱胁迫8 d后,总根长比干旱处理下提高了34.48%。根系长出的侧根降低了根的平均直径,侧根生长越多平均直径反而越低。本研究发现,烯效唑浸种处理后分枝数和交叉数显著高于干旱处理,在干旱胁迫8 d后,分枝数和交叉数分别比干旱处理下增加了29.62%和54.28%;而对根系平均直径的影响差异不明显。根尖数是工业大麻根系的一个重要指标,根尖数近似与侧根数相等,烯效唑浸种处理后根尖数显著增加,在干旱胁迫8d后,根尖数比干旱处理下增加了33.07%。根系长度和直径的变化会引起工业大麻根表面积和根体积的变化,而工业大麻根表面积直接影响到其对水分和营养的吸收能力。研究结果表明,烯效唑浸种后根表面积、根体积和根总投影面积有所增加,在干旱胁迫8 d后,根表面积、根体积和根总投影面积比干旱胁迫处理增加了34.77%、69.10%和70.00%。烯效唑浸种处理下,叶片SPAD值显著提高,在干旱胁迫8 d后增加了28.30%,这对于提高光合作用有明显作用。干旱胁迫能够破坏活性氧的产生和消除之间的动态平衡,使植物细胞受到伤害,细胞膜透性增大,从而影响植物的正常生长代谢[9,25]。本研究发现,干旱胁迫导致工业大麻叶片的细胞膜透性明显增加,胁迫处理8 d后较CK增加了38.76%;而烯效唑浸种可以显著降低叶片的细胞膜透性,与干旱处理相比,在胁迫8 d后减少了17.22%,这表明烯效唑能够缓解干旱胁迫对工业大麻叶片造成的氧化损伤。可溶性糖和可溶性蛋白作为渗透调节物质是植物抗逆形成的重要物质基础[26],逆境胁迫下,可溶性糖和可溶性蛋白大量积累,可以维持植物细胞渗透势和增大细胞原生质浓度而引起抗脱水作用,有利于植物抵抗逆境的伤害。研究表明,逆境胁迫下,烯效唑施用可以增加渗透调节物质的含量,提高抵御逆境能力[15,27]。本研究发现,干旱胁迫使可溶性糖和可溶性蛋白含量显著增加,烯效唑浸种进一步促进了叶片内渗透调节物质含量的增加,分别比干旱胁迫处理的植株增加了17.32%~36.78%和5.07%~7.94%。植物通过提高内源ABA水平诱导气孔关闭等机制来应对干旱胁迫造成的损伤[28]。本研究发现干旱胁迫8 d后,工业大麻叶片中的内源激素ABA显著增加,比CK增加了163.50%;烯效唑浸种后ABA含量仍有所增加,合理的解释是烯效唑能够抑制ABA 8′-hydroxylase的活性,减少ABA的降解,从而提高ABA的含量[29]。植物通过控制SA和JA的含量来调控它们所介导的代谢途径,使植物更具有抵御胁迫的能力。张志芬等[30]研究发现,重度干旱胁迫下,内源激素SA和JA含量显著升高。本研究结果与其相似,干旱胁迫8 d后,工业大麻叶片中的内源激素SA和JA显著增加,分别比CK增加了38.72%和77.67%;烯效唑浸种后,植株损伤程度降低,SA和JA的含量分别比干旱胁迫处理降低了17.79%和14.40%。
