嗜水气单胞菌刺激对中华绒螯蟹免疫的影响
2020-07-28毛振方张翠真陈志和朱敏杰简少卿赵大显
程 超,肖 敏,李 菁,毛振方,张翠真,陈志和,朱敏杰,简少卿,3,赵大显,3
( 1.南昌大学 生命科学学院,江西 南昌 330031; 2.江西省吉安市井冈山农业科技园,江西 吉安 343000; 3.江西省水产动物资源与利用重点实验室,江西 南昌 330031 )
中华绒螯蟹(Ericheirsinensis),俗称河蟹、毛蟹、大闸蟹等,是我国重要的特种水产养殖品种之一,因肉质鲜美,具有较高的营养价值和经济价值。近年来,随着市场需求量的不断扩大,其增养殖模式在不断发展,养殖规模也在逐步扩大。自20世纪80年代起,人工池塘养殖开始起步,在2000年后,中华绒螯蟹池塘生态养殖技术已逐渐成熟,到2016年全国中华绒螯蟹总产量达8.23×105t,产值超过400亿元[1]。随着人工养殖的迅速发展,其病害问题亦日趋突出,严重影响了中华绒螯蟹的养殖效益。因此,从根源上探明中华绒螯蟹的免疫机制,有效提高中华绒螯蟹的品质和抗病能力就显得尤为重要。
嗜水气单胞菌(Aeromonashydrophila)作为一种较常见的条件致病菌,在水环境中广泛存在,是一种典型的人—兽—鱼共患的致病菌,也是鱼类发病的主要病原[2]。目前有关嗜水气单胞菌对经济类水产品的致病性研究,多集中在硬骨鱼类、两栖类和爬行类,而对甲壳动物如虾、蟹等的研究则不多[2-3]。余雪明等[4]在对13种贝类及甲壳类海产品检测时发现,致病性气单胞菌检测出8种,检出率高达61.29%,其中以嗜水气单胞菌数量最多;衣启麟[5]则指出,致病性嗜水气单胞菌会导致中华绒鳌蟹的颤抖病和水肿病等多种疾病的发生,也是虾蟹类养殖病害中主要细菌病原之一。
笔者选定嗜水气单胞菌为感染病原,采用注射方式急性感染中华绒螯蟹,探究其重要免疫器官组织结构变化和免疫相关基因表达规律,有助于从组织和分子水平揭示中华绒螯蟹对嗜水气单胞菌的免疫应答机理以及嗜水气单胞菌对中华绒螯蟹的致病机理,为寻找更科学的蟹病防治措施、提高养殖对象抗病能力,实现养殖产业的健康可持续发展提供科学依据。
1 材料与方法
1.1 试验动物
中华绒螯蟹由南昌市墩子塘水产市场购得,规格为80~100 g,经充分曝气自来水(水温24 ℃,pH 6.8,溶解氧>5.0 mg/L)暂养7 d后,挑选健康、规格基本一致且肢体健全的蟹用于嗜水气单胞菌免疫刺激试验。
1.2 嗜水气单胞菌
嗜水气单胞菌(ATCC35654标准菌株)自上海复祥生物科技有限公司购得;菌种使用营养肉汁琼脂培养基活化,并在营养肉汁液体培养基中进行扩增培养(30 ℃培养24 h)后,于4 ℃,3240 r/min下离心15 min,弃上清液,沉淀用生理盐水(0.9%)进行洗涤、悬浮,悬浮后菌液密度约为2.8×108cfu/mL。
1.3 嗜水气单胞菌免疫刺激试验
试验分为感染组和对照组,每组设3个平行,每个75 cm×55 cm×45 cm试验桶中放中华绒螯蟹21尾,共计126尾。试验期间日换水量约1/2~1/3,换水时清除污物,试验期间不投饵。试验组,使用1 mL的医用一次性注射器取1.2中悬浮后菌液0.1 mL,于中华绒螯蟹第三步足基膜处注射进腹部肌肉;对照组注射等体积生理盐水。试验期间各组中华绒螯蟹均无死亡,于注射后0、3、6、12、24、48 h和72 h各平行组取2尾中华绒螯蟹分别抽取血淋巴,4 ℃,11 240 r/min离心10 min收集血细胞[按1∶1加入预冷抗凝剂后抽取样蟹血淋巴,离心得到的血细胞加入适量TRIzol®Reagent (Life Technologies,USA)后置于冰箱-80 ℃冻存],用于总RNA抽提。随后对试验蟹进行解剖,小心取出中华绒螯蟹的鳃、肝胰腺组织(组织块大小约0.5 cm×1.0 cm),用生理盐水浸洗,滤干水分后置于体积比为20∶1的10%甲醛溶液中常温保存,备用于组织切片观察。
1.4 组织切片和测量
采用常规石蜡切片、苏木精—伊红染色对感染前后中华绒螯蟹鳃和肝胰腺组织进行切片制作,并通过显微镜(尼康TI-S)进行观察、测量和拍照。
1.4.1 鳃丝厚度的测量
随机选择各时段切片视图中5根结构完整的鳃丝,从鳃轴起至鳃丝末端间随机选择10个位点进行测量,求取平均值及标准差。
1.4.2 肝小管管腔比面积的测量
随机挑取各时段切片视图中5个结构完整的肝小管横截面图,因肝小管近椭圆形,取椭圆长轴直径、短轴直径进行测量,利用椭圆面积公式粗略计算肝小管横截面积;因管腔形状不规则,对环截面厚度的测量采用对环截面进行均匀布点,以多次(8~10次)测量求取平均值,估算肝小管管腔面积占比,取5次估算值的平均值及标准差。
1.4.3 指标计算公式
(1)
(2)
(3)
式中,TL表示中华绒螯蟹的鳃丝平均厚度,n为测量次数,T1、T2…Tn为各次测量的数值;S0为中华绒螯蟹肝小管的横截面积,a、b表示肝小管长轴、短轴直径;φ为估算的肝小管管腔面积占比,t表示肝小管厚度。
1.5 免疫相关基因的相对表达量分析
1.5.1 总RNA提取与cDNA模板获得
取上述1.3中冻存血细胞样品,采用Trizol法提取总RNA;用反转录试剂盒TaKaRa PrimeScriptTM RT reagent Kit with gDNA Eraser (Perfect Real Time)进行第一链cDNA的合成,cDNA合成后于冰箱-20 ℃保存备用。
1.5.2 实时荧光定量PCR(qPCR)检测分析
使用荧光定量PCR仪Bio-Rad CFX Manager 3.1进行qPCR检测分析。PCR反应体系(20 μL)参照实时荧光定量PCR试剂盒TaKaRa SYBR®Premix Ex TaqTM(Tli RNaseH Plus)进行,组分为:SYBR Premix Ex Taq (Tli RNaseH Plus) (2×) 10 μL,PCR Forward Primer (10 μmol/L) 0.4 μL,PCR Reverse Primer (10 μmol/L) 0.4 μL,Template (<100 ng) 2 μL,dH2O 7.2 μL。反应条件如下:
步骤1:95 ℃预变性5 min后进入循环;步骤2:95 ℃变性30 s;步骤3:58~60 ℃退火30 s;步骤4:72 ℃延伸30 s,共39个循环;步骤5:溶解曲线分析,95 ℃ 5 s (变温速率4.4 ℃/s),60 ℃ 1 min (变温速率2.2 ℃/s),95 ℃(变温速率0.11 ℃/s,采集方式:连续采集,每1 ℃ 5次)1个循环;步骤6:结束。每个反应重复3次。引物使用Primer 5.0软件设计,具体序列见表1,其中β-actin为内参基因,引物均由上海生工生物工程股份有限公司合成。

表1 实时荧光定量PCR反应引物
1.6 数据分析
数据以平均值±标准差表示;实时荧光定量PCR数据使用2-△△Ct法(Livak法[6])进行分析计算目的基因的mRNA相对表达水平数值;使用Excel、OriginPro 8软件完成相关制表、制图等;使用SPSS 21软件分析数据显著性差异,P<0.05为显著性差异,P<0.01为极显著性差异。
2 结 果
本试验中,对照组蟹在注射生理盐水后无异常反应,活力正常;试验组蟹在嗜水气单胞菌(菌液密度约2.8×108cfu/mL)注射感染后,活力明显下降,但未出现死亡,并在24 h后活动能力有逐步恢复的趋势。
2.1 嗜水气单胞菌免疫刺激对中华绒螯蟹鳃、肝胰腺组织结构的影响
2.1.1 对鳃组织结构的影响
对嗜水气单胞菌免疫刺激前后中华绒螯蟹鳃丝厚度进行测量发现,对照组中华绒螯蟹鳃丝厚度无显著差异变化(P>0.05),试验组中鳃丝厚度在3 h时极显著降低(P<0.01),在6~72 h时鳃丝厚度有不同程度的增厚(表2)。进一步通过镜检观察发现,与对照组(图1a)和感染组0 h(图1b)相比,中华绒螯蟹在感染嗜水气单胞菌3 h后鳃丝腔中上皮细胞形成的腔隔膜结构被破坏,致鳃丝厚度急剧减小,且鳃丝末端有血细胞积聚,但角质层及基膜结构完整(图1c);6、12 h时角质层显著增厚(P<0.05),并有波状突起,部分角质层与基膜分离,且鳃丝腔增大,鳃丝末端破裂,相比近鳃轴处,鳃丝中后段血细胞数量较少(图1d~e);24 h时鳃丝厚度达最大,血细胞数量异常增多,角质层增厚且波状突起多与基膜脱离并呈碎裂状,鳃丝末端结构破坏加剧(图1f);48 h时鳃丝厚度相比24 h时有减小,且鳃丝近末端结构损伤处出现血细胞积聚现象(图1g);72 h时观察到鳃丝不同区段有血细胞积聚现象(图1h)。试验结果表明,嗜水气单胞菌免疫刺激对中华绒螯蟹鳃组织结构造成了显著影响。
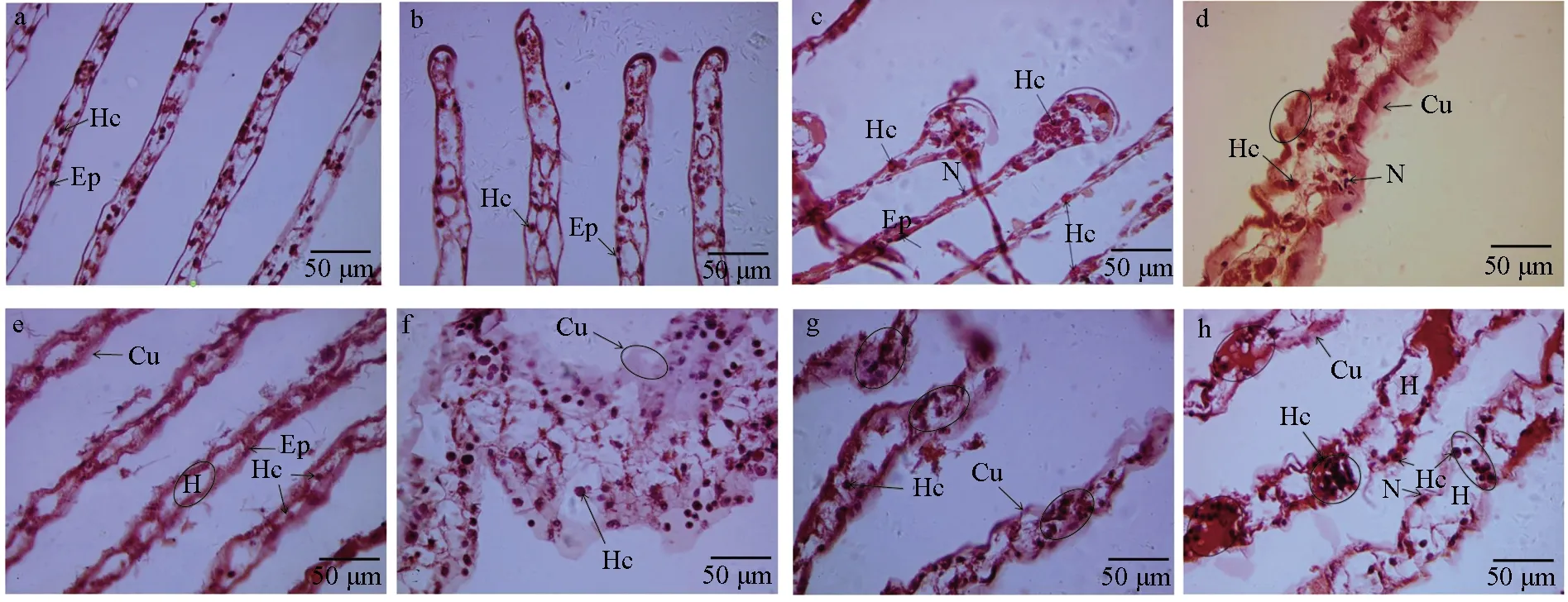
图1 嗜水气单胞菌免疫刺激对中华绒螯蟹鳃组织结构的影响

表2 嗜水气单胞菌免疫刺激对中华绒螯蟹鳃丝厚度的影响 μm
2.1.2 对肝胰腺组织的影响
对中华绒鳌蟹肝胰腺中肝小管进行测量,计算肝小管中管腔面积占肝小管横截面面积的百分比(后简称肝小管管腔面积比,φ)。结果显示,在注射生理盐水和嗜水气单胞菌后,均会使肝小管管腔面积比均值增大,即使肝小管管腔面积增大,但对照组在6 h后面积比均值恢复至近0 h水平,试验组则在6 h时面积比均值有最大值,随后呈下降趋势,但与0 h面积比均值相比仍较大。且对照组和试验组在3 h时肝小管管腔面积比均值之间无显著差异(P>0.05);6 h时面积比均值均有较高水平,且标准差较小;12 h时面积比均值较6 h时减小,且标准差值较大;24、48 h时面积比均值进一步减小,但标准差值仍较大;72 h时对照组肝小管面积比均值异常增大(表3)。

表3 嗜水气单胞菌免疫刺激对中华绒螯蟹肝小管管腔面积比的影响 %
通过对中华绒螯蟹肝胰腺组织切片结构观察发现,对照组0 h(图2a)和试验组0 h(图2b)肝小管结构清晰,基膜完整,细胞核整齐排列于近基膜侧,主要为纤维细胞与吸收细胞。嗜水气单胞菌免疫刺激3 h时,肝小管部分细胞水肿,吸收细胞结构有变形,分泌细胞及胚细胞增生(图2c);6 h时肝小管大部分细胞水肿,细胞排列紊乱,部分核固缩坏死,肝小管中,基膜与吸收细胞连接处碎裂、分离(图2d);12 h时肝小管上皮增生,细胞排列层次增多,核大小不一,部分细胞水肿变形(图2e);24 h时肝小管中细胞发生水样变性,细胞结构模糊、排列紊乱,血细胞数量增多,出现空泡状结构,但基膜结构仍完整(图2f);48 h时肝小管中细胞核分布靠近基膜侧,纤维细胞数量增多,吸收细胞与分泌细胞错落分布,空泡状结构减少(图2g);72 h时肝小管中,基膜明显增厚,分泌细胞位于近基膜处,吸收细胞结构为清晰柱状且数量较多,偶见空泡状结构(图2h)。结果表明,注射生理盐水和嗜水气单胞菌均可能引起中华绒螯蟹的免疫反应,但生理盐水无明显毒性作用,而嗜水气单胞菌免疫刺激会对中华绒螯蟹肝胰腺组织造成显著影响。
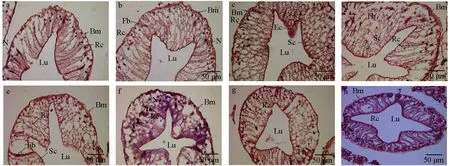
图2 嗜水气单胞菌免疫刺激条件下中华绒螯蟹肝胰腺组织结构的影响
2.2 嗜水气单胞菌免疫刺激对中华绒螯蟹血淋巴中免疫相关基因表达量的影响
2.2.1 对免疫模式识别相关基因相对表达量的影响
对照组中华绒螯蟹血淋巴中脂多糖和β-1,3-葡聚糖结合蛋白(LGBP)mRNA的相对表达量在3、6 h略有上调,12 h下调,且为最小值,24、48 h时与0 h相近,72 h上调;试验组中华绒螯蟹血淋巴中LGBP基因在6 h下调表达,在12 h时表达上调,24、48、72 h与0 h的相对表达量相近;与对照组相比,试验组在6、72 h有显著低表达(P<0.05),在12 h有极显著高表达(P<0.01)(图3)。
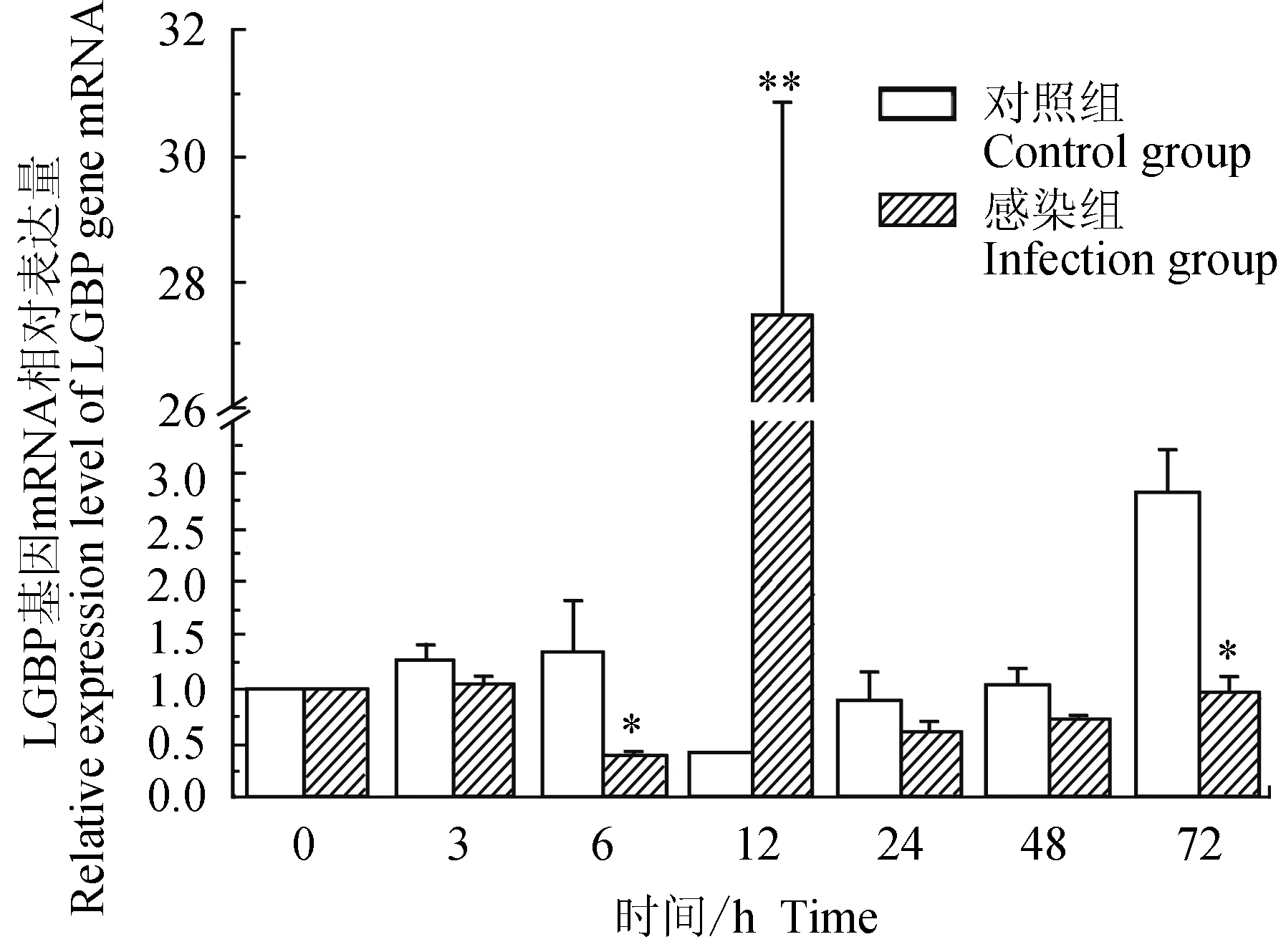
图3 嗜水气单胞菌免疫刺激对中华绒鳌蟹免疫LGBP基因表达的影响
2.2.2 免疫信号传导相关基因的相对表达量分析
对照组中华绒螯蟹血淋巴中免疫信号传导Toll通路重要组件Tube基因的相对表达量水平在72 h内差异不大;试验组中华绒螯蟹血淋巴中Tube基因在3、6 h逐级下调表达,在12、24、72 h上调表达,且在12 h有最大值;与对照组相比,试验组在3、6 h有显著低表达(P<0.05),在12 h有显著高表达(P<0.05)(图4)。
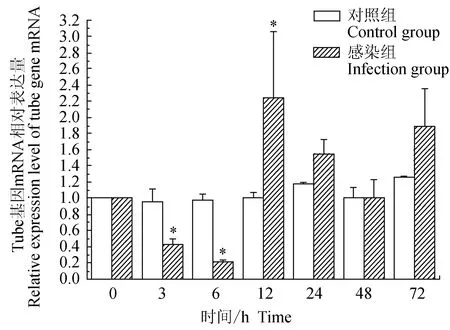
图4 嗜水气单胞菌免疫刺激对中华绒鳌蟹免疫Tube基因表达的影响
对照组中华绒螯蟹血淋巴中免疫信号传导Toll通路重要组件Dorsal基因在6、72 h有上调表达,3、12、24、48 h相对表达量与0 h相近;试验组中华绒螯蟹血淋巴中Dorsal基因在3 h上调表达,随后呈逐渐下调趋势;与对照组相比,试验组Dorsal基因在3 h有显著高表达(P<0.05),在24、72 h有显著低表达(P<0.05)(图5)。
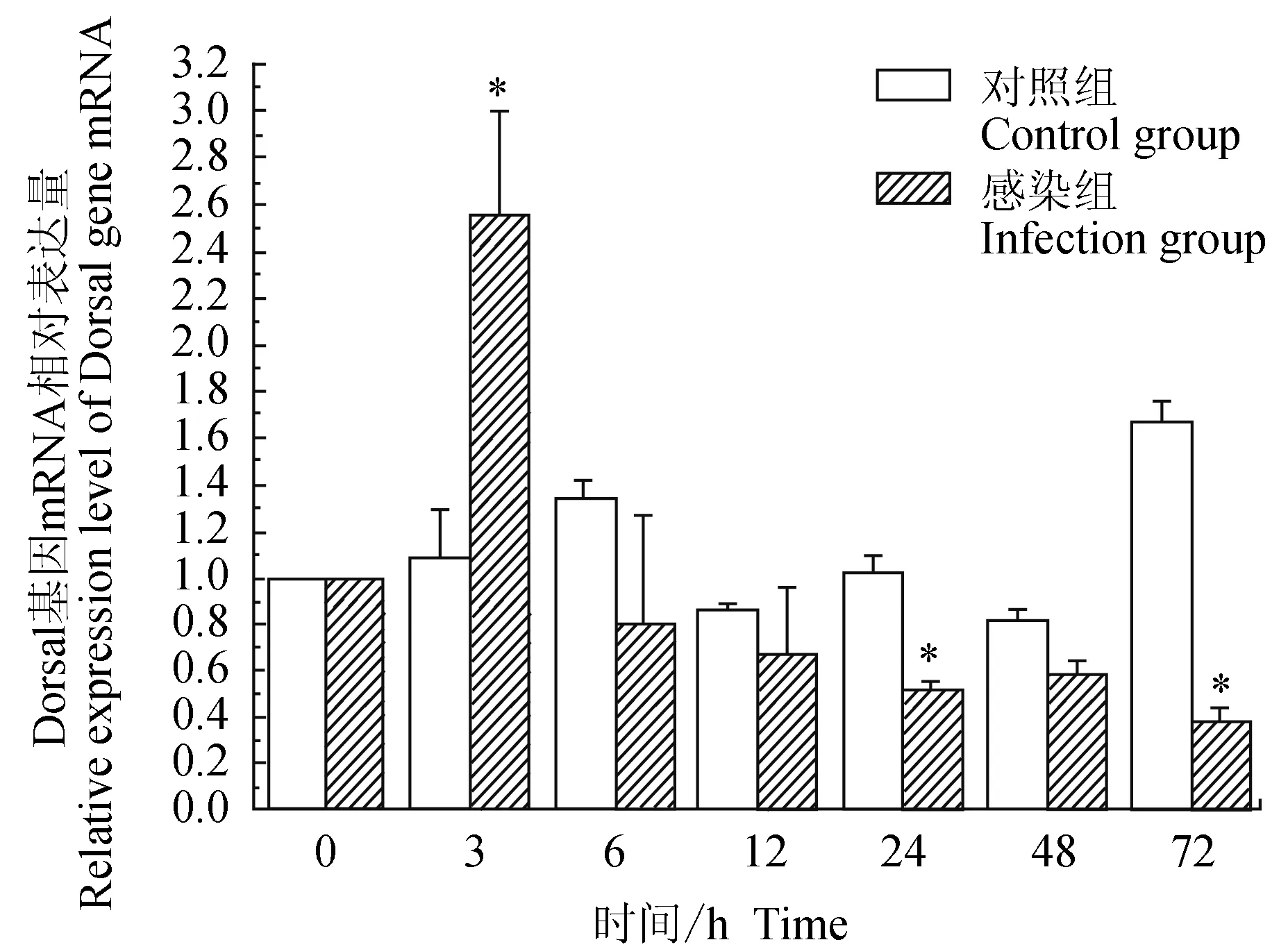
图5 嗜水气单胞菌免疫刺激对中华绒鳌蟹免疫Dorsal基因表达的影响
对照组中华绒螯蟹血淋巴中整合素(Integrin)基因在3 h有下调,72 h上调,相对表达量在72 h内差异不大;试验组中华绒螯蟹血淋巴中Integrin基因在3、6、12 h均上调表达,24、72 h均下调表达;相比对照组,试验组Integrin基因在3、6 h显著高表达(P<0.05),在12 h有极显著高表达(P<0.01),在24、72 h时有显著低表达(P<0.05)(图6)。
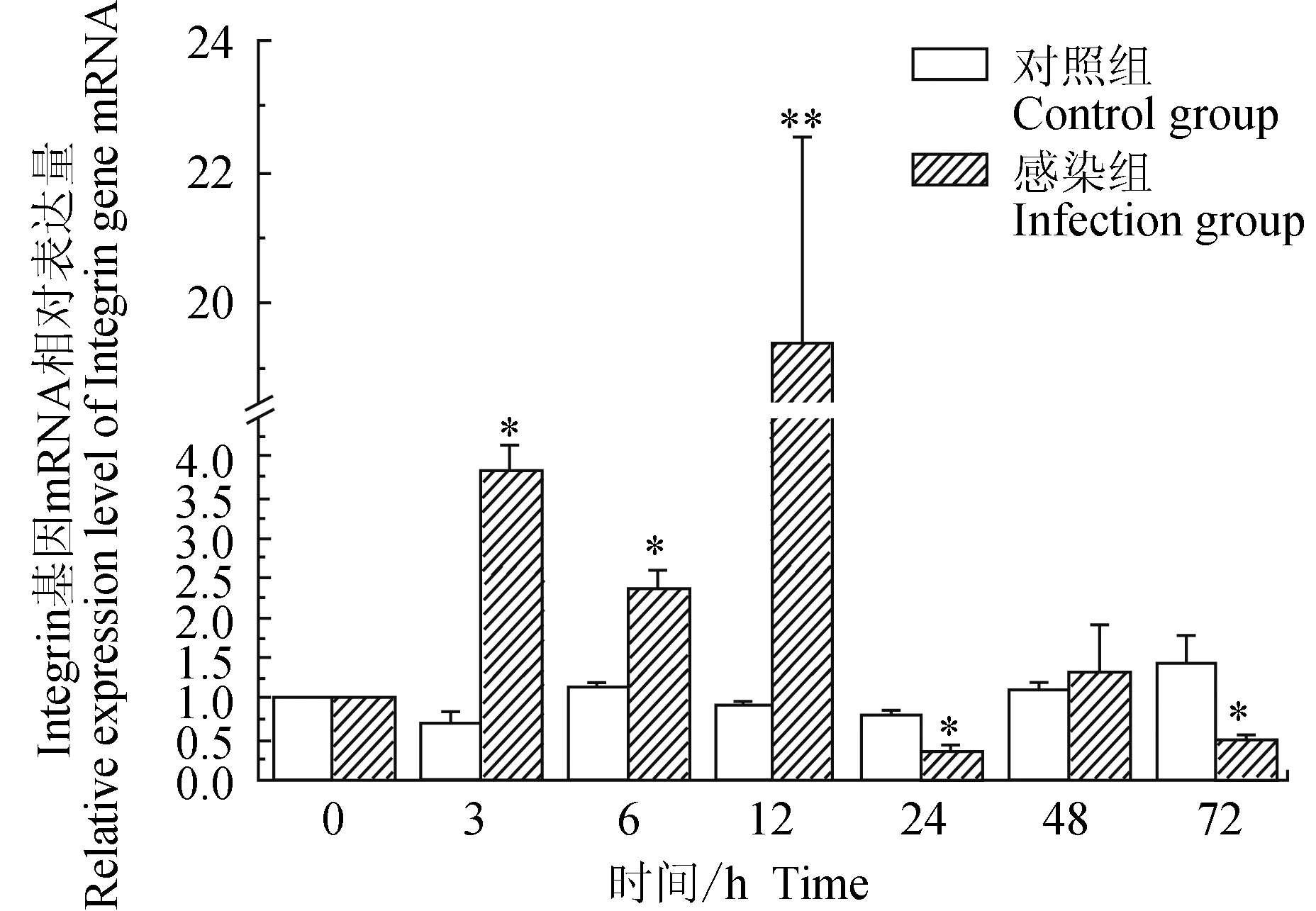
图6 嗜水气单胞菌免疫刺激对中华绒鳌蟹免疫Integrin基因表达的影响
2.2.3 免疫效应相关基因的相对表达量分析
对照组中华绒螯蟹血淋巴中酚氧化酶原激活酶(PPAF)基因在3 h上调表达,在6 h时下调表达,12、24、48 h时有下调表达趋势,12 h与0 h无明显差异,72 h时上调表达;试验组中华绒螯蟹血淋巴中PPAF基因在感染嗜水气单胞菌72 h的相对表达量均明显下调,在12 h有最小值;相比对照组,3、24 h有显著低值(P<0.05),12、72 h有极显著低值(P<0.01)(图7)。
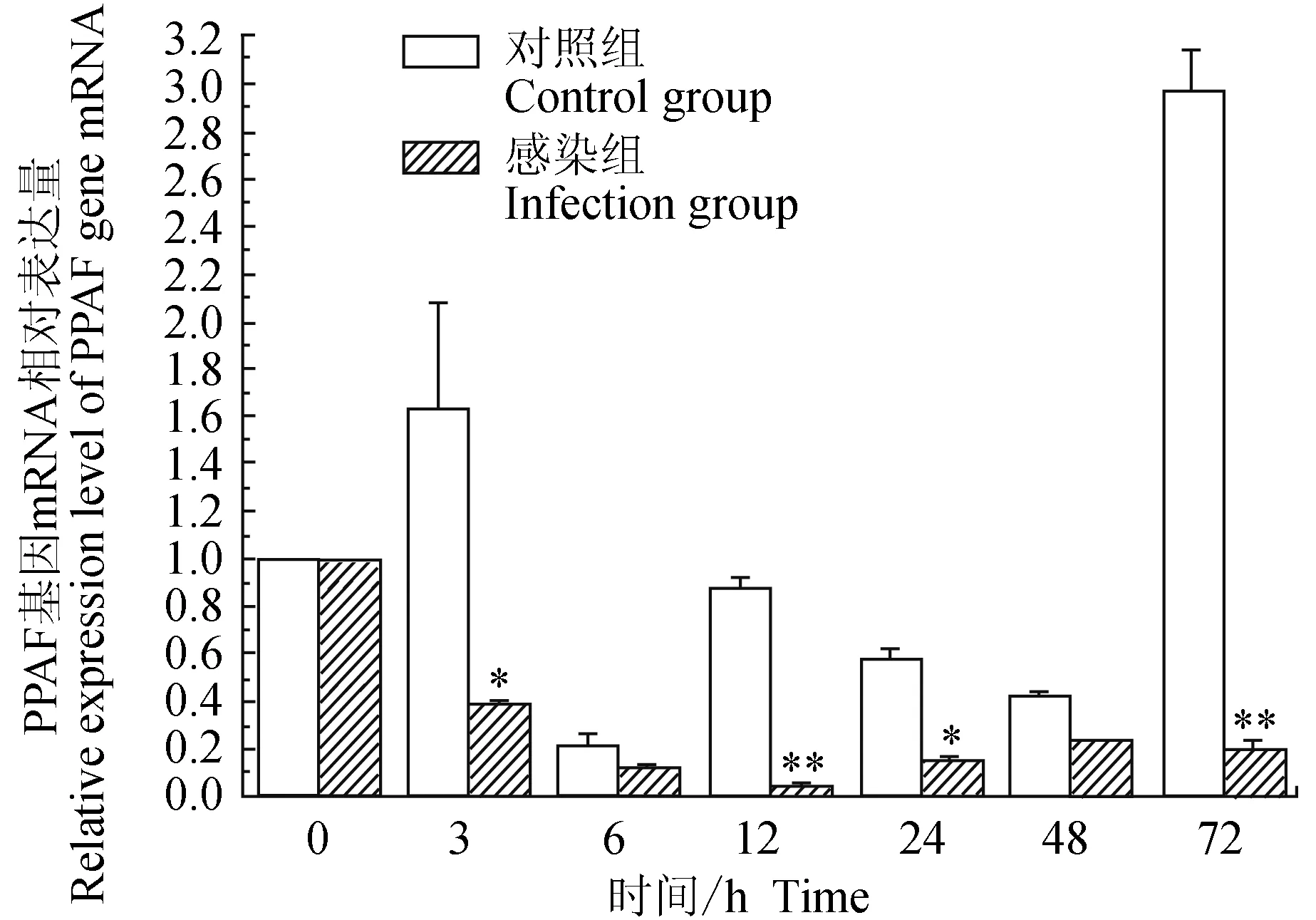
图7 嗜水气单胞菌免疫刺激对中华绒鳌蟹免疫PPAF基因表达的影响
对照组中华绒螯蟹血淋巴中细胞黏附蛋白(PXN)基因在3、6、12 h逐级下调表达,6 h有最小值,24、72 h上调表达,48 h下调表达,有最低值,72 h有最高值;试验组中华绒螯蟹血淋巴中PXN基因在12 h内逐级下调表达,12 h有最低值,24、48 h和72 h相对表达量有升高,但较0 h仍为下调表达;与对照组比较,6、72 h有显著(P<0.01)低值,12 h有极显著低值(P<0.01)(图8)。
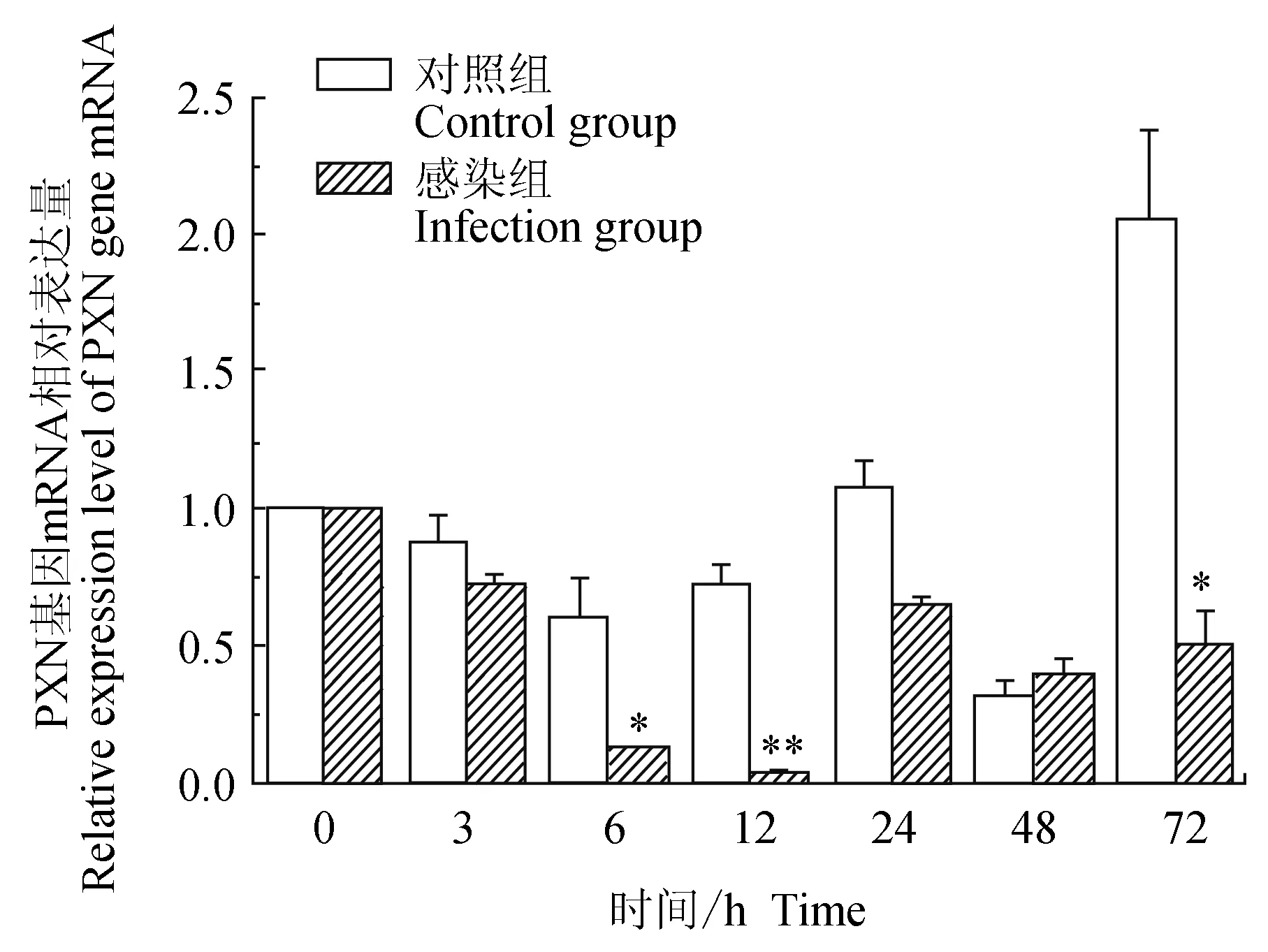
图8 嗜水气单胞菌免疫刺激对中华绒鳌蟹免疫PXN基因表达的影响
对照组中华绒螯蟹血淋巴中谷胱甘肽硫转移酶(GST)基因在3 h上调表达,随后下调,48 h内与0 h时差异不大,72 h上调表达;试验组中华绒螯蟹血淋巴中GST基因在12 h内逐级下调,12 h有最低值,24 h上调表达,48、72 h相对表达量与0 h相近;相比对照组,3、6、12 h和72 h均有显著低值(P<0.05)(图9)。
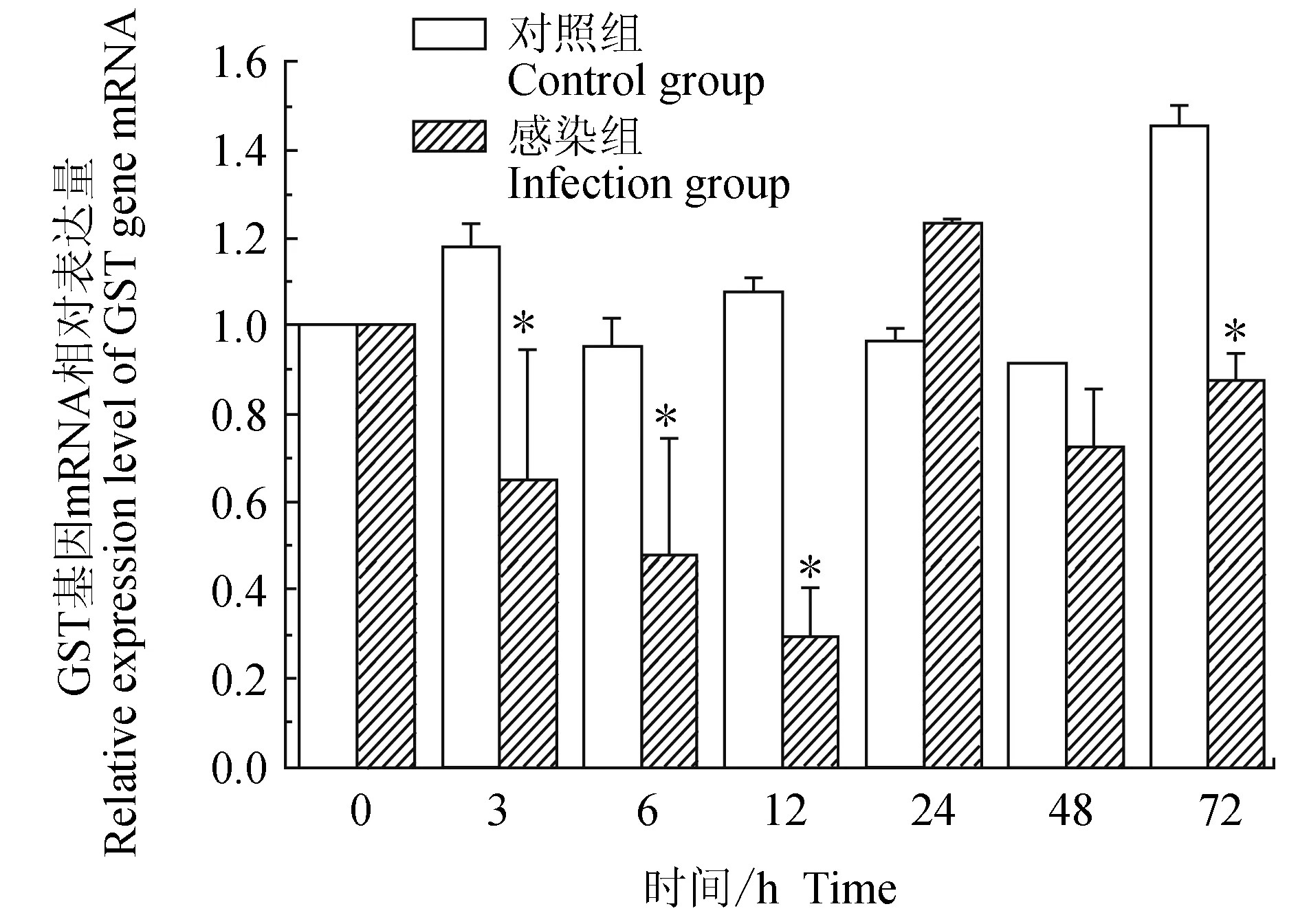
图9 嗜水气单胞菌免疫刺激对中华绒鳌蟹免疫GST基因表达的影响
对照组中华绒螯蟹血淋巴中谷胱甘肽过氧化物酶(GPx)基因在3 h下调,随后上调,趋于0 h水平,72 h上调;试验组中华绒螯蟹血淋巴中GPx基因在24 h内均下调表达,48 h上调表达,72 h下调表达,6 h有最低值;相比对照组,6、24、72 h时有显著低值(P<0.05),48 h时有显著高值(P<0.05)(图10)。
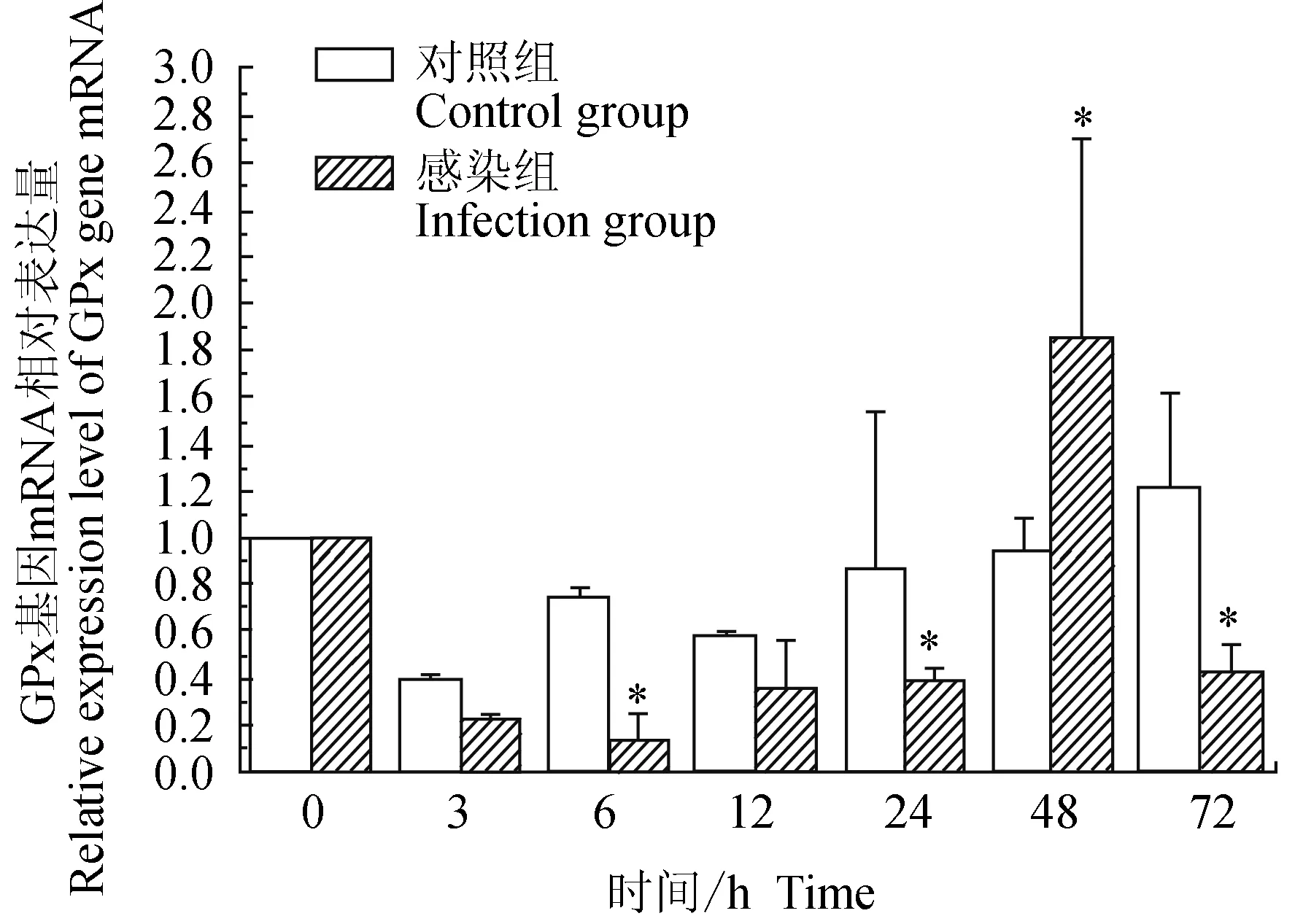
图10 嗜水气单胞菌免疫刺激对中华绒鳌蟹免疫GPx基因表达的影响
对照组中华绒螯蟹血淋巴中超氧化物歧化酶(SOD)基因仅在24 h时下调表达,其余时段无显著差异;试验组中华绒螯蟹血淋巴中SOD基因在3 h上调,6、24 h下调,其余时段与0 h无显著差异;相比对照组,6 h有显著低值(P<0.05)(图11)。
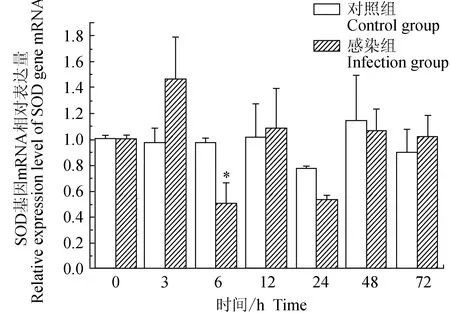
图11 嗜水气单胞菌免疫刺激对中华绒鳌蟹免疫SOD基因表达的影响
3 讨 论
3.1 嗜水气单胞菌
嗜水气单胞菌属弧菌科、气单胞菌属,是嗜温、有动力的气单胞菌群,广泛存在于淡水、污水及土壤中,是水生动物尤其鱼类最常见的致病菌[2]。嗜水气单胞菌已在淡海水鱼类[7]、淡水虾类[8-9]、淡水蟹类[10]和蛙类[11-12]体内分离到。嗜水气单胞菌感染后,不同对象表现出不同的临床症状而有不同名称,如蛙类[12]和大口黑鲈(Micropterussalmoides)[13]的“红通病”,鲫鱼(Carassiusauratus)、鲢鱼(Hypophthalmichthysmolitrix)[14]的“暴发病”,胡子鲇(Clariasgariepinus)[15]和白斑狗鱼(Esoxlucius)[16]的“红嘴病”、“坏死病”等。在虾蟹类中,有日本沼虾(Macrobrachiumnipponense)[8]的“红鳃病”,中华绒螯蟹[10]的“腹水病”、“抖抖病”等。姜艳丽等[2]研究发现,嗜水气单胞菌能产生多种外毒素(如气溶素、溶血素、细胞毒素和肠毒素等)、胞外蛋白酶和黏附因子等毒力因子,使虾蟹类血淋巴失去功能或导致其他组织器官被侵染,发生病变,最终丧失功能,引发死亡。所以,在本试验中选取嗜水气单胞菌作为病原,分析其对中华绒螯蟹免疫系统的影响。
3.2 嗜水气单胞菌免疫刺激对中华绒螯蟹鳃、肝胰腺组织结构的影响
鳃组织作为中华绒螯蟹重要的呼吸器官,是抵御水环境中病害侵蚀的第一道屏障,同时还承担调节渗透压和调节离子平衡等重要作用[17]。据顾志峰等[18-19]报道,中华绒鳌蟹鳃组织结构中鳃腔内的膨大细胞是由上皮细胞向鳃腔内分裂形成突起,生长膨大而成,且每个上皮细胞处于不断的生长和分裂状态。本研究发现,嗜水气单胞菌免疫刺激后,试验组中华绒螯蟹行动力明显减弱,同时鳃组织结构有明显的病理变化,具体表现为鳃丝中上皮细胞破坏崩解、鳃丝先锐减后增厚、鳃腔增大、鳃丝中血细胞数量先减后增及鳃丝末端结构逐渐破坏解体和血细胞积聚现象等。感染初期鳃丝厚度减小,可能是因为嗜水气单胞菌随血液循环系统进入鳃组织后,破坏了由上皮细胞形成的鳃腔隔,导致鳃丝失去支撑而厚度减小;而之后鳃腔中血细胞数量减少,可能是受嗜水气单胞菌分泌的溶血素等毒力因子影响而引起的败血症状;但在感染后期,由于机体大量合成血细胞,在清除病原菌的同时也在鳃丝末端积聚,从而起到一定的损伤修复。
甲壳动物的肝胰腺承担肝脏和胰脏的双重功能,对外界影响因素极为敏感[17]。中华绒螯蟹肝胰腺作为重要的免疫器官,其组织结构的变化在一定程度上也可反映出机体对环境的适应性改变[21]。张瑶等[20-21]研究发现,致病菌柠檬酸杆菌(Citrobacter)感染中华绒螯蟹后会引起其败血症,造成其肝胰腺对物质合成、消化吸收及能量代谢功能的紊乱或丧失,进而破坏整个机体的新陈代谢作用,同时会使鳃组织大面积肿胀、坏死,致病蟹呼吸困难甚至窒息,最终导致病蟹死亡。洪美玲等[22]研究指出,氨氮胁迫15 d后,中华绒螯蟹肝胰腺组织中分泌细胞数量均减少,转运泡体积明显增大,细胞核增大且数量增多;在高含量试验组中,部分肝小管的基膜破裂、细胞结构模糊,少量细胞核解体。在本试验中,观察到试验组肝胰腺肝小管管腔面积比相比对照组有明显增大,但感染期间基膜基本结构完整,结构和数量具有明显变化的主要是分泌细胞和吸收细胞,也出现细胞水肿、排列紊乱及变形水解等现象。该现象与洪美玲等[22-23]研究结果类似,说明嗜水气单胞菌免疫刺激与氨氮、重金属胁迫对中华绒螯蟹肝胰腺组织结构的影响可能存在一定的共性。
以上结果表明,嗜水气单胞菌免疫刺激对中华绒鳌蟹产生了明显的毒性作用,且对其鳃组织、血淋巴组织及肝胰腺组织均造成了一定的损伤,同时机体对病原菌也可能存在一定的免疫调节能力。
3.3 嗜水气单胞菌免疫刺激对中华绒螯蟹血淋巴中免疫相关基因表达量的影响
中华绒螯蟹为典型的无脊椎甲壳类动物,其免疫主要依靠先天性免疫系统[24]。先天免疫系统包括细胞免疫和体液免疫,它们在免疫刺激下被激活。其中甲壳动物细胞免疫主要是由血细胞来承担的,主要包括吞噬作用、节结形成和包裹作用等;体液免疫主要是机体在外源刺激和诱导下合成和分泌的一些免疫因子,如抗菌肽,具有杀菌活性和免疫相关酶活性的凝集素、溶菌酶、酚氧化酶酶原和酚氧化酶、超氧化物歧化酶等[25]。
3.3.1 对免疫模式识别相关基因LGBP表达的影响
和其他无脊椎动物一样,中华绒螯蟹的免疫反应主要由一些模式识别蛋白发起[26]。在节肢动物中,主要的模式识别蛋白包括β-葡聚糖结合或识别蛋白(βGBP)、脂多糖结合或识别蛋白(LBP)、肽聚糖结合或识别蛋白(PGRP)和脂多糖及β-1,3-葡聚糖结合蛋白(LGBP)。其中LGBP已经在中华绒螯蟹中被克隆出全长,并指出其在防御细菌侵染方面起非常重要的作用[25]。本试验中也分析了中华绒螯蟹血淋巴中免疫模式识别蛋白相关基因LGBP在嗜水气单胞菌免疫刺激后的相对表达量变化,结果发现,在菌液注射感染6 h时检测到LGBP基因显著下调表达(P<0.05),在12 h时有极显著上调表达(P<0.01),随后趋于0 h水平。说明在嗜水气单胞菌免疫刺激后,LGBP基因参与了中华绒螯蟹清除病原菌的免疫反应。与Zhao等[27]研究结果对比,LGBP基因的极显著上调应答时间是在细菌感染1.5 h,应答时间较本试验结果明显提前,但本试验中12 h时LGBP的相对表达量水平远远大于1.5 h时检测水平。推测中华绒螯蟹机体在清除病原菌时可能存在多次免疫反应过程。
3.3.2 对免疫信号传导相关基因Tube、Dorsal和Integrin表达的影响
Toll信号通路是无脊椎动物中主要的先天免疫信号通路之一,而Tube、Dorsal基因均为Toll信号通路中的重要组件,在先天免疫系统的信号传导中发挥着重要作用,且均已在中华绒螯蟹中克隆出cDNA全长[28-29]。本试验中,检测到Tube基因表达量在3、6 h显著下调(P<0.05),12 h显著上调(P<0.05);Dorsal基因表达量在3 h有显著上调(P<0.05),随后下调。说明Tube、Dorsal基因能被嗜水气单胞菌诱导表达,且可能存在一定的应答次序。
整合素(Integrin)是一种介导细胞和其外环境之间的连接的跨膜受体,在细胞迁移、分化和存活中起关键作用。Huang等[30]在中华绒螯蟹中克隆出β亚型整合素,并提出作为细胞受体,中华绒螯蟹整合素蛋白能结合多种细菌,对抗菌免疫具有重要作用;且在被脂多糖、肽聚糖、金黄色葡萄球菌(Staphyloccocusaureus)或副溶血弧菌(Vibrioparahaemolyticus)胁迫时,Integrin基因表达量会显著上调[30]。本试验中也观察到,与对照组相比,试验组中Integrin基因在3、6、12 h时均表现为显著(P<0.05)或极显著上调(P<0.01),说明Integrin基因在中华绒螯蟹先天免疫反应中拥有重要功能。
3.3.3 对免疫效应相关基因PPAF、PXN、GST、GPx和SOD的表达影响
酚氧化酶原激活酶(PPAF)为一类催化酚氧化酶酶原成为酚氧化酶的酶类,是酚氧化酶原系统中的重要组成成员,可通过级联反应最终激活酚氧化酶系统[31]。研究表明,在嗜水气单胞菌免疫刺激后,血细胞中PPAF基因会立刻启动转录相应mRNA,合成蛋白行使功能[25]。本试验中,对照组PPAF基因在3 h上调表达,随后下调表达,趋于0 h水平;而试验组PPAF基因则在受菌免疫刺激后,处于持续下调表达,在12 h达最小值;且与对照组相比,试验组中PPAF基因的相对表达水平显著降低(P<0.05)。结合鳃组织切片结果分析,在菌免疫刺激后,鳃腔中血细胞数量有先降后升的趋势,12 h时鳃腔中血细胞数量最少,且由于PPAF基因在肝胰腺组织表达最高,在血细胞中表达相对较少[25],由此推测,嗜水气单胞菌免疫刺激后,中华绒螯蟹血细胞数量的减少和PPAF主要在肝胰腺中表达的特点可能是导致该基因持续下调表达的原因。
细胞黏附蛋白(PXN)是甲壳动物中最早鉴定出的细胞黏附分子[32],和人的髓过氧化物酶具有类似的结构,是一类具有细胞黏附特性和过氧化物酶活性的免疫分子,能与整合素结合,并与胞外的超氧化物歧化酶协同作用发挥免疫效应,同时也与酚氧化酶原系统的激活有关,参与多种病原体的清除过程[33]。本试验中检测到PXN基因在菌免疫刺激后表达量降低,且在12 h有最低值,原因可能与PPAF表达量持续降低类似。
谷胱甘肽硫转移酶(GST)、谷胱甘肽过氧化物酶(GPx)和超氧化物歧化酶(SOD)基因均为中华绒螯蟹抗氧化系统中的主要抗氧化酶类基因[34-36]。在甲壳动物血细胞吞噬作用过程中,会导致活性氧的产生,这些活性氧能有效杀死外源入侵者,但过多积累也会导致自身细胞的严重损伤。而谷胱甘肽硫转移酶通过与还原型谷胱甘肽的巯基(-SH)结合,催化氧化应激产生的各种毒性代谢物等,使这些亲电性的疏水化合物变成亲水性的物质,可减少其毒性,进而保护细胞免受过量活性氧的损伤[34]。谷胱甘肽过氧化物酶可以消除机体内的过氧化氢及脂质过氧化物,阻断活性氧自由基对机体的进一步损伤,是生物体内重要的活性氧自由基清除剂。它与体内的超氧化物歧化酶和过氧化氢酶一起构成了机体的抗氧化防御体系。超氧化物歧化酶是一种能够催化超氧化物通过歧化反应转化为氧气和过氧化氢的酶,广泛存在于各类动物、植物和微生物中,是一种重要的抗氧化剂[36]。目前,β型GST、不含硒型GPx和锰型SOD基因均在中华绒螯蟹中得到克隆,且被证实在应对菌免疫刺激均有免疫应答反应[25,34,37-38]。本试验中,嗜水气单胞菌免疫刺激后,GST、GPx和SOD基因在不同时段有一定的上调或下调表达,说明对菌免疫刺激均有应答。其中GST、GPx基因表达量在12 h均呈下调;而SOD基因表达量在3 h上调,在6 h显著下调(P<0.05)。推测各基因之间可能存在一定的应答次序。
上述结果表明,在嗜水气单胞菌免疫刺激下,中华绒螯蟹血淋巴组织中各免疫相关基因均有一定的应答反应,且各基因之间可能存在一定的应答次序或级联关系。
综上,嗜水气单胞菌免疫刺激对中华绒螯蟹有明显的毒性作用,可对其鳃、肝胰腺组织正常结构造成一定程度的破坏作用,也会显著影响其血淋巴组织中各免疫相关基因的表达;同时在一定程度上,机体对病原菌也有一定的免疫调节能力及自我修复能力。
