肿瘤体积对局部进展期直肠癌预后的影响
2020-07-27
直肠癌是湖南省高发恶性肿瘤之一[1]。新辅助放化疗(neoadjuvant chemoradiotherapy,NCRT)联合全直肠系膜切除术(total mesorectal excision,TME)是局部进展期直肠癌(locally advanced rectal cancer,LARC)的标准治疗方案[2],可以降低局部复发率,提高5年无病生存率[3]。随着影像学技术的进步,肿瘤体积(gross tumor volume,GTV)的具体计算成为可能。但依据治疗计划系统(treatment planning system,TPS)计算的GTV 对LARC患者预后的影响却鲜见报道。本研究回顾性分析2011年1月至2016年9月128例直肠癌患者的临床资料,旨在探讨GTV对LARC患者预后的影响,试图从数据分析中找到合理的GTV截点,为临床上LARC患者个体化治疗方案和治疗强度的选择提供理论依据。
1 材料与方法
1.1 临床资料
选取2011年1月至2016年9月湖南省肿瘤医院收治的128例中低位LARC患者。男性80例,女性48例。平均年龄(51.27±11.95)岁。纳入标准:1)首诊结肠镜检查见肿瘤下缘距肛缘的距离≤10 cm,余肠腔内未见肿瘤;2)全部患者结肠镜下活检病理确诊为腺癌;3)初诊经胸腹CT、全身骨扫描、直肠MRI 等检查临床判断,临床分期为T3~4N0M0和T1~4N+M0即Ⅱ~Ⅲ期,临床分期和术后病理分期标准均参照美国癌症协会(AJCC)肿瘤分期手册(第7版);4)卡氏评分≥70 分;5)入院血常规、肝肾功能及其他生化检查未见明显异常;6)术前接受同步放化疗;7)定期接受随访。排除标准:1)其他恶性肿瘤史,放化疗史;2)肿瘤阻塞肠腔并发肠梗阻者;2)肿瘤已远处转移,无法通过手术切除;3)合并有严重心肺功能障碍或肝肾功能衰竭,无法耐受手术者;4)数据丢失或者随访失访患者。
1.2 方法
1.2.1 GTV计算 所有患者放疗定位前饮水500 mL(含造影剂泛影葡胺20 mL),充盈膀胱并显影小肠,1 h后在俯卧位于腹部用带孔托架行胸腹热塑面罩固定,并在固定下行模拟CT平扫+增强扫描定位,范围从第一腰椎上缘至坐骨结节下10~15 cm,层厚5 mm。扫描图像资料传输至TPS,由放疗科医师在TPS的CT图像上结合MRI、CT、电子结肠镜等检查所见图像,逐层进行直肠肿瘤侵犯范围勾画,由上级医生审核靶区。如果对肿瘤受累部位有争议或者是图片质量不清晰,应与放诊科医生沟通后再确定靶区范围。待图像勾画完成后由TPS 自动进行三维重建和GTV计算,原发直肠肿瘤体积为原发直肠肿物(不含转移淋巴结)。
1.2.2 放疗技术及靶区勾画 所有患者全程接受三维适形放疗(three dimensional conformal intensity-modulated radiotherapy,3D-CRT)或调强放疗(intensity modulated radiation therapy,IMRT)。直肠GTV为影像学检查、电子肠镜检查、超声内镜检查所显示的肿瘤病变范围。盆腔转移淋巴结(GTVnd):参照MRI,在定位CT影像上勾画盆腔转移淋巴结。临床靶区(clinical target volume,CTV):包含GTV及直肠周围系膜区、骶前区、骶3上缘以上(梨状肌起始部)髂外血管淋巴结引流区、全部髂内血管淋巴结引流区、部分闭孔淋巴结引流区。病变位于中段时,下界需至肿块下3 cm;如果病变位于直肠下段,包括整个直肠系膜(肛提肌插入直肠壁层面)且延伸至肿块下3 cm,同时包括全部坐骨直肠窝。直肠下端肿块直接侵犯超过齿状线,或累及肛缘和肛周皮肤以及阴道下段(女性)时,可考虑包括髂外淋巴结引流区和腹股沟淋巴结引流区。T4期病变如侵犯膀胱、肛管(齿状线以上)、前列腺(男性)、宫体或宫颈或阴道的中上段(女性)可考虑包括髂外淋巴结引流区。计划靶区(planning target volume,PTV):CTV外扩,一般头脚10 mm,左右7~10 mm,腹背10 mm。周边危及器官限量:膀胱(勾画全膀胱)V50≤50%;小肠(勾画全盆腔及部分腹腔区至PTV上2 cm)Dmax≤52 Gy,V50≤5%;结肠(勾画全盆腔及部分腹腔区至PTV 上2 cm)Dmax≤54 Gy,V50≤10%;股骨头(勾画股骨头、股骨颈至大转子下缘)V50≤5%。处方剂量:95%PTV 45~50 Gy/25~28次,1.8~2.0 Gy/次,每周5次,共5~6周完成。
1.2.3 化疗 全部患者接受同步放化疗两种方案:1)以5-FU为同步化疗(17例),放疗开始d1~4和d22~25配合5-Fu 400 mg/m2/d微电脑持续泵入;2)以口服卡培他滨为基础的同步化疗(111例),自放疗第1天起同步口服卡培他滨,计量1 650 mg/m2/d,分早晚2次服用,与放疗日期同步,口服至放疗结束。术后辅助化疗方案:本组病例有77例行术后辅助化疗,化疗方案分别为XELOX(奥沙利铂+卡培他滨)(8例,每3周重复给药)和FOLFOX(奥沙利铂+5-氟尿嘧啶+亚叶酸钙)(69例,每2周重复给药),术后半年内维持化疗。
1.2.4 手术和病理 所有患者行NCRT后休息4~12周入院行相关检查明确无手术禁忌后按TME原则行根治切除术,具体术式包括Hartmann 术、Dixon 术、Mile′s 术。所有术后病理标本均由本院病理科医生行相应病理处理后,确定术后病理分期。治疗后肿瘤分期变化由病理分期和治疗前分期作比较得出,治疗前T分期和N分期与病理T分期和N分期出现一个分期及以上的差别(如MRI临床分期T4经治疗后分期为ypT0~3,MRI临床分期N2经治疗后分期为N0~1)即认为有分期变化。肿瘤退缩分级(tumor regression grade,TRG)标准参照AJCC肿瘤分期手册(第7版)和美国病理学家协会(CAP)指南推荐的Ryan等[4]研究的修订版。
1.2.5 随访 治疗结束后,患者前2年内每3个月复查1次,后3年每6个月复诊1次。每次复查的内容包括:全身系统体格检查包括直肠指检、血常规、血生化、CEA、胸部X线或CT、腹部CT或MRI,前1年内复查肠镜1次,以后每3年复查肠镜1次,必要时行直肠腔内超声、全身骨扫描、全身PET/CT检查。随访截止日期为2018年2月,电话随访患者生存状态。
1.3 统计学分析
采用SPSS 19.0软件进行统计学分析。采用受试工作者曲线(receiver-operating characteristic,ROC)选择GTV的截点。采用频数和构成比描述分类资料。采用Spearman相关分析探讨GTV分组与其他临床因素的相关性。采用χ2检验分析GTV分组与T降期与TRG 0~1级分布的差异。总生存率(overall survival,OS)、无病生存率(disease-free survival,DFS)、无局部复发生存率(local relapse free survival,LRFS)、无远处转移生存率(distant-metastasis-free survival,DMFS),采用Kaplan-Meier 法进行生存分析并用Log-rank 检验。采用Cox 比例风险回归模型进行多因素分析。P<0.05为差异具有统计学意义。
2 结果
2.1 临床资料
128例LARC患者中位随访时间为35.94(14~63)个月,详细资料见表1。

表1 患者临床病理资料
2.2 GTV选择
采用ROC曲线确定GTV对死亡的诊断价值。得到GTV的截点为79.31 mL,灵敏度0.875,特异度0.768,正确指数0.643,曲线下面积为0.815,95%CI(0.708~0.923),见图1。
2.3 GTV与临床病理因素的相关性分析
将GTV分组分别与MRI-T分期、MRI-N分期、T分期变化、N分期变化、TNM分期变化、TRG作相关性分析,发现GTV分组与T分期变化(ρ=0.229,P=0.009)、TNM分期变化(ρ=0.219,P=0.013)、TRG(ρ=0.517,P<0.001)呈正相关,与MRI-T分期、MRI-N分期及N分期变化无关(表2)。说明GTV≥79.31 mL即肿瘤大体积,患者的肿瘤降期和消退情况更差,表明肿瘤大体积更容易引起新辅助放化疗抗拒。
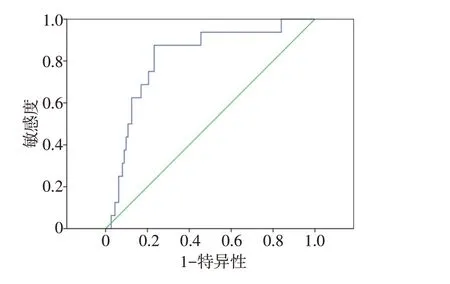
图1 GTV ROC截点图
将GTV分组分别与T降期和TRG 0~1级分布情况进行χ2检验,分析表明GTV分组与T降期和TRG 0~1级分布具有显著性差异(P<0.05,表3)。

表2 GTV分组与各个临床因素的Spearman 相关性分析结果 n(%)
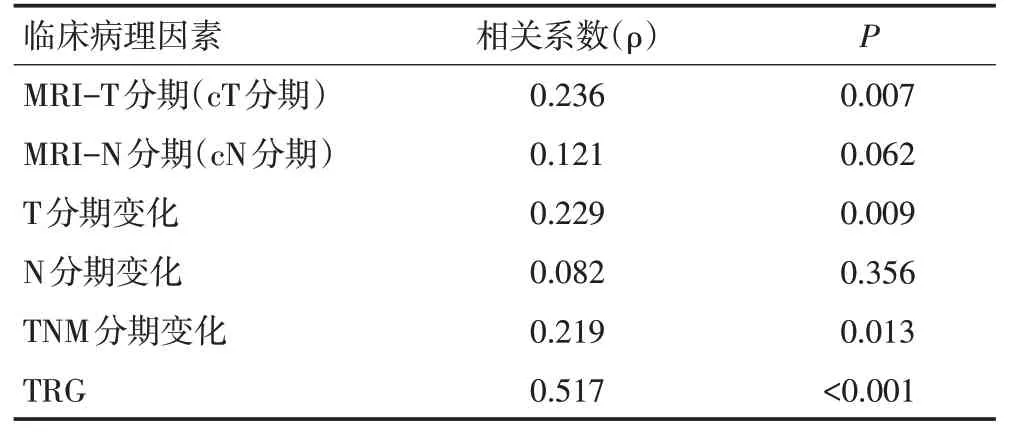
表3 GTV分组与T降期、TRG 0~1级分布情况
2.4 以截点值分组的两组生存情况比较
本研究中128例患者生存情况如下:1)有16例患者死亡,其中11例为远处转移,2例为局部复发,3例为复发合并转移。3年OS为90.7%。将患者分为GTV≥79.31 mL与GTV<79.31 mL两组,3年OS分别为73.8%与98.8%(P<0.001,图2)。2)有16例患者死亡,7例带瘤生存。3年DFS为81.3%。GTV≥79.31 mL与GTV<79.31 mL组3年DFS分别为54.8%vs.94.2%(P<0.001,图3)。3)有9例患者出现局部复发:5例出现盆腔复发合并远处转移、4例为单纯盆腔复发。3年LRFS为93.0%。GTV≥79.31 mL与GTV<79.31 mL组3年LRFS分别为81.0%vs.98.8%(P<0.001,图4)。4)有20例出现远处转移:7例全身多发转移、6例肝转移,5例肺转移,1例腹膜转移,1例腹股沟淋巴结转移。3年DMFS为84.4%。GTV≥79.31 mL与GTV<79.31 mL组3年DMFS分别为61.9%vs.95.3%(P<0.001,图5)。

表4 128例LARC患者的单因素分析

图2 GTV<79.31 mL与GTV≥79.31 mL两组患者的OS曲线

图3 GTV<79.31 mL与GTV≥79.31 mL两组患者的DFS曲线
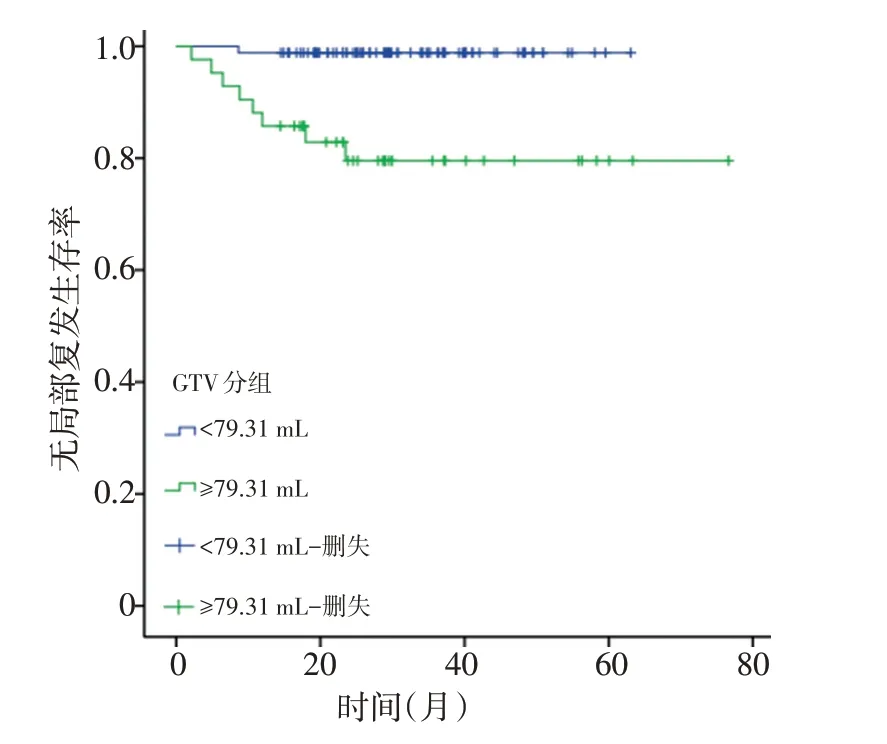
图4 GTV<79.31 mL与GTV≥79.31 mL两组患者的LRFS曲线
2.5 预后因素
分析GTV、病理N分期、N分期变化、TNM分期变化、TRG、治疗前临床分期、肿瘤下缘距肛缘距离、病理术后T分期、新辅助治疗后T分期变化、病理完全缓解(pathological complete response,pCR)、病理分型、放疗技术、年龄、性别对预后的影响。单因素分析结果表明GTV与3年OS、DFS、LRFS、DMFS显著相关(P<0.05,表4)。多因素分析表明,GTV(HR=19.699,P<0.001)、N分期变化(HR=5.876,P=0.048)、病理N分期(HR=2.521,P=0.024)是OS的独立预后因素。GTV(HR=12.972,P<0.001)、病理N分期(HR=3.556,P=0.038)、N分期变化(HR=4.412,P=0.024)、TNM分期变化(HR=8.5,P=0.011)是DFS的独立预后因素。GTV(HR=11.248,P<0.001)、N分期变化(HR=3.664,P=0.015)是LRFS的独立预后因素。GTV(HR=15.818,P<0.001)、病理N分期(HR=5.891,P=0.016)、N分期变化(HR=5.651,P=0.036)是DMFS的独立预后因素(表5)。GTV(≥79.31 mL)较大时,OS存在显著性差异。将GTV值分为≥79.31 mL 与<79.31 mL两组,GTV≥79.31 mL患者的死亡风险、复发和转移的风险、局部复发的风险、远处转移的风险分别是GTV<79.31 mL 患者的19.699、12.972、11.248、15.818倍。
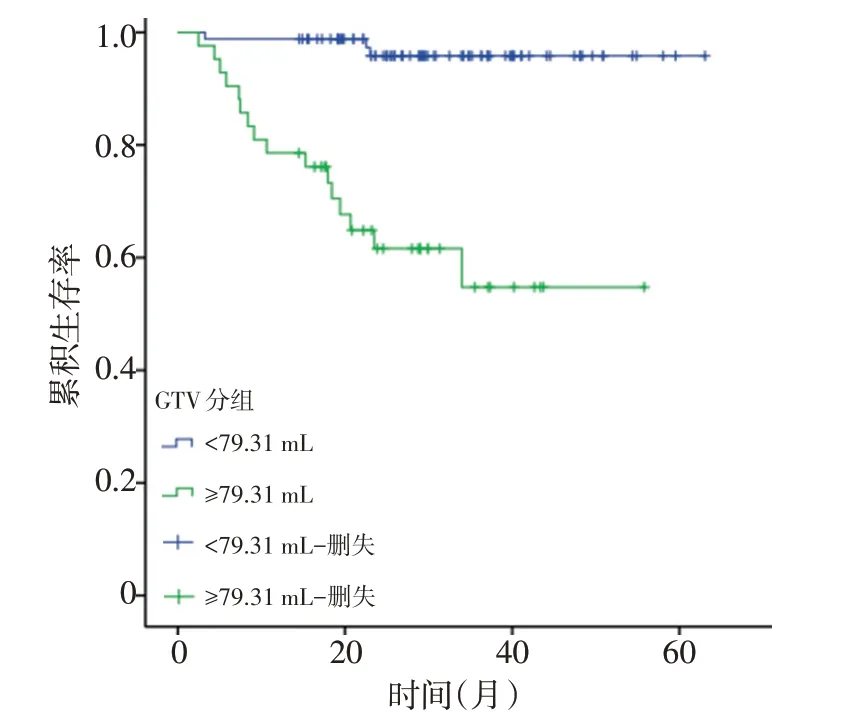
图5 GTV<79.31 mL与GTV≥79.31 mL两组患者的DMFS曲线

表5 多因素分析
表5 多因素分析(续表5)
3 讨论
文献报道治疗前肿瘤大小≤5 cm 是pCR的风险预测因子(P=0.035)[5]。然而,测量肿瘤大小的方法各不相同,并且在不同研究中常用的直径一维测量不能反映三维实际GTV。目前GTV对局部晚期直肠癌的影响鲜见报道,因此探索根据GTV 选择个体化的综合治疗方案具有重要的临床指导意义。本研究的GTV 均为CT 模拟定位三维重建后勾画,采用TPS系统计算的肿瘤大小,相对于肿瘤的长度或者最大直径能够更好地反映肿瘤的真实大小情况,且有利于肿瘤放疗的精确性。
3.1 病例资料特点及生存分析
本研究共纳入128例患者,男女比例为5:3。在本组病例中有91例为低位直肠癌,37例为中位直肠癌,保肛为73例,保肛率为57.03%,这与文献报道的NCRT后保肛率基本一致[6]。本组病例pCR率为16.4%,与既往文献报道(15%~27%)一致[7]。本组病例T降期率为58.6%与Rodel等[8]的一项临床Ⅰ/Ⅱ期试验结果基本一致(55%)。
本研究的3年OS、DFS、LRFS、DMFS分别为90.7%、81.3%、93.0%、84.4%,与既往文献报道的范围一致[9-12],本研究多因素分析发现GTV、病理N 分、N分期变化、TNM分期变化是影响LARC患者NCRT联合TME术后生存状态的主要因素。Sannier等[13]纳入113例接受NCRT联合TME术的LARC患者,多因素分析发现病理N分期是影响患者DFS的独立预后因素。另有文献报道,病理N分期是LRFS、DMFS和OS的独立预后因素,病理N0期的5年OS为84%,病理N1~2期的5年OS为69%[14]。本研究表明经过术前新辅助治疗后N降期和TNM降期的患者具有较好的预后。
3.2 其他因素对LARC预后的影响
影响LARC的预后因素,包括临床病理预后因素、遗传学和表观遗传学预后因素、分子标记物等。其中最重要的预后因素是临床TNM分期,传统T分期只考虑肿瘤向肠周侵犯的深度,并未考虑直肠为空腔脏器、肿块可以沿肠腔内及纵轴生长,相同T分期的患者GTV并不完全相同,其预后也不尽相同,因此本研究纳入直肠GTV 作为预后因素补充了传统T分期对患者预后判断的局限性。
3.3 GTV对LARC预后的影响
已有学者研究直肠癌GTV、直肠肿瘤密度与肿瘤消退和pCR的预测,Tayyab 等[15]对25例接受TME的直肠癌患者的临床资料进行分析,通过直肠MRI计算GTV,将患者分为<77 cm3和≥77 cm3两组,其结果发现肿瘤大体积者的死亡风险是肿瘤小体积者的6倍,肿瘤大体积的局部复发风险是肿瘤小体积的2倍,多因素分析显示GTV 是患者OS的独立预后因素。虽然GTV 与直肠癌预后的影响鲜见报道,但在鼻咽癌[16]、食管癌[17]、胃癌[18]等肿瘤中均有文献报道。本研究显示,GTV≥79.31 mL 是LARC的不良预后因素,且与放疗抗拒存在相关性,GTV 越大,出现新辅助放化疗抗拒的可能性越大。GTV 与肿瘤负荷呈线性相关,是体现肿瘤负荷最直接的指标,而肿瘤负荷与放疗敏感性相关。影响放疗敏感性的主要因素包括肿瘤细胞的固有敏感性、乏氧克隆细胞所在的比例、肿瘤放射损伤修复。肿瘤的生长需要肿瘤血管提供营养,肿瘤血管通常不成熟,缺乏平滑肌细胞且存在着结构的异常,如动静脉短路或盲端等。当GTV 较大时,这些血供通常不能满足肿瘤生长的需要,因此由营养不良导致供氧不足区域的出现,乏氧细胞即存在于这些区域。根据肿瘤放射生物学原理,处于乏氧环境的肿瘤细胞接受高能X线照射产生亚致死损伤的修复能力优于富氧的肿瘤细胞,从而引起乏氧肿瘤细胞对射线的抗拒。另外,肿瘤大体积表明肿瘤增殖时间长和/或增殖速度快,可能已发生肿瘤细胞血液微转移、脉管、神经浸润等,这可能表明与局部复发和远处转移相关。因此,对于这些患者,可能需要新辅助同步放化疗前采用诱导化疗、双药同步化疗、使用放疗增敏剂及加大放疗剂量来达到减少局部复发和远处转移的目的,从而提高总生存期。
3.4 GTV作为LARC预后因素的优点
本研究采用了以TPS自动计算的GTV,而非传统的MRI GTV计算,其测量方式精准,有助于肿瘤的精确放疗,此种GTV 评估方法在鼻咽癌[19-21]中应用广泛,但在直肠癌中鲜见报道。本研究通过放射治疗计划系统三维成像技术,结合临床影像学资料,只需在患者放疗前定位CT 上勾画出肿瘤范围,系统会自动计算出GTV,不受肿瘤自身生长形状的影响,因此本测量方法使得计算的精确性得到了提高,而且更为便捷。
综上所述,NCRT可使LARC降期和提高保肛率。通过ROC 确定的GTV 截点值为79.31 mL,GTV与LARC患者局部复发和远处转移密切相关,是预后因素之一,且与NCRT 抗拒相关。因此对于GTV≥79.31 mL的LARC患者,可能需要采用放疗前诱导化疗、双药同步化疗、使用放疗增敏剂及加大放疗剂量来达到减少局部复发和远处转移的目的,从而提高总生存期。
