河豚卵处理物对吉富罗非鱼生长性能、血液生化及抗菌感染的影响
2020-07-27陈德举陶易凡包景文李红霞朱昊俊
陈德举,强 俊,陶易凡,包景文,李红霞,,朱昊俊,徐 跑,
(1.南京农业大学无锡渔业学院,江苏无锡214081;2.中国水产科学研究院淡水渔业研究中心,农业农村部淡水渔业和种质资源利用重点实验室,江苏无锡214081)
河豚(Takifugurubripes),又称河鲀,因其味鲜而广受人们喜爱。目前,人工养殖的河豚一般低毒或无毒,而野生河豚的内脏、卵巢、血液等组织通常含有大量的河豚毒素(tetrodotoxin,TTX),基于此,一般选择野生河豚的卵巢来提取TTX,从而会产生大量的卵巢废弃物,而这些废弃物仍含有较多的营养素、微量元素以及少量的TTX未被利用。已有报道显示,河豚卵巢提取物可显著增加小鼠脾脏和胸腺的重量,提高小鼠腹腔吞噬细胞吞噬率[1]。除此之外,在一定的剂量范围内,河豚卵提取物还可提高小鼠的非特异性免疫[2]。河豚卵中除含有丰富的蛋白质和脂肪外,还含有微量的河豚毒素、糖类以及维生素、溶菌酶、微量元素等生物活性物质[3]。研究表明,河豚毒素可替代广谱抗生素,抑制革兰氏菌阳性生长[4]。河豚毒素还具有抗肿瘤作用,其抗肿瘤活性显著高于珍珠贝茹多糖[5]。此外,与其它昆虫等动物蛋白源相比,河豚卵处理物还具有较高的钙磷比,可用来调配膳食及饲料中的钙磷含量[3]。
目前对罗非鱼饲料添加物较多,中草药饲料添加剂因其毒副作用小、不易产生抗药性而备受关注。研究发现,中草药等植物性添加剂的有效成分极为复杂,适当的添加对罗非鱼的生长[6]、改善品质[7]以及免疫调节[8]具有促进作用。然而,植物性添加剂的研发并不能很好地解决罗非鱼链球菌病以及健康养殖的问题。与植物性添加剂相比,罗非鱼饲料的动物源性添加物研究显得相对空缺。基于此,本实验选用去毒后的野生横纹东方鲀卵巢废弃物,经真空冷冻干燥后获得处理物,并以吉富罗非鱼为研究对象,均添加河豚卵处理物的饲料,研究吉富罗非鱼生长性能和血液生化指标的差异与变化,同时进行海豚链球菌感染实验,以期为动物源饲料添加剂在罗非鱼饲料中的研究以及罗非鱼健康养殖提供基础资料。
1 材料与方法
1.1 河豚卵处理物的获取与饲料制备
选取野生的去除河豚毒素后的横纹东方鲀卵巢废弃物,用真空冷冻干燥机干燥36 h以上,超微粉碎后过80目筛,获得河豚卵处理物。经测定本实验所用河豚卵处理物中,蛋白含量占60.6%~75.6%,粗脂肪含量为17.2%~32.1%,其不饱和脂肪酸占总脂肪酸的60%以上,此外,河豚卵处理物还含有一定量的α-亚麻酸(α-Linolenic acid,ALA),亚油酸,以及较高的n-3/n-6不饱和脂肪酸(见表1)。

表1 河豚卵处理物脂肪酸含量Tab.1 Total fatty acids of extract powder from puffer fish ovaries %
制备饲料时,充分混匀各种饲料原料,依次添加河豚卵处理物量如下:0、0.2%、0.4%、0.8%、1.6%、3.2%、6.4%,制备7组饲料S1、S2、S3、S4、S5、S6、S7,每组实验饲料的TTX含量依次为0、2.5、5.5、11.8、23.9、45.6和95.2 μg/kg,饲料水分约为12%,干燥后保存在-20 ℃备用。各组饲料组成和营养成分分析见表2。
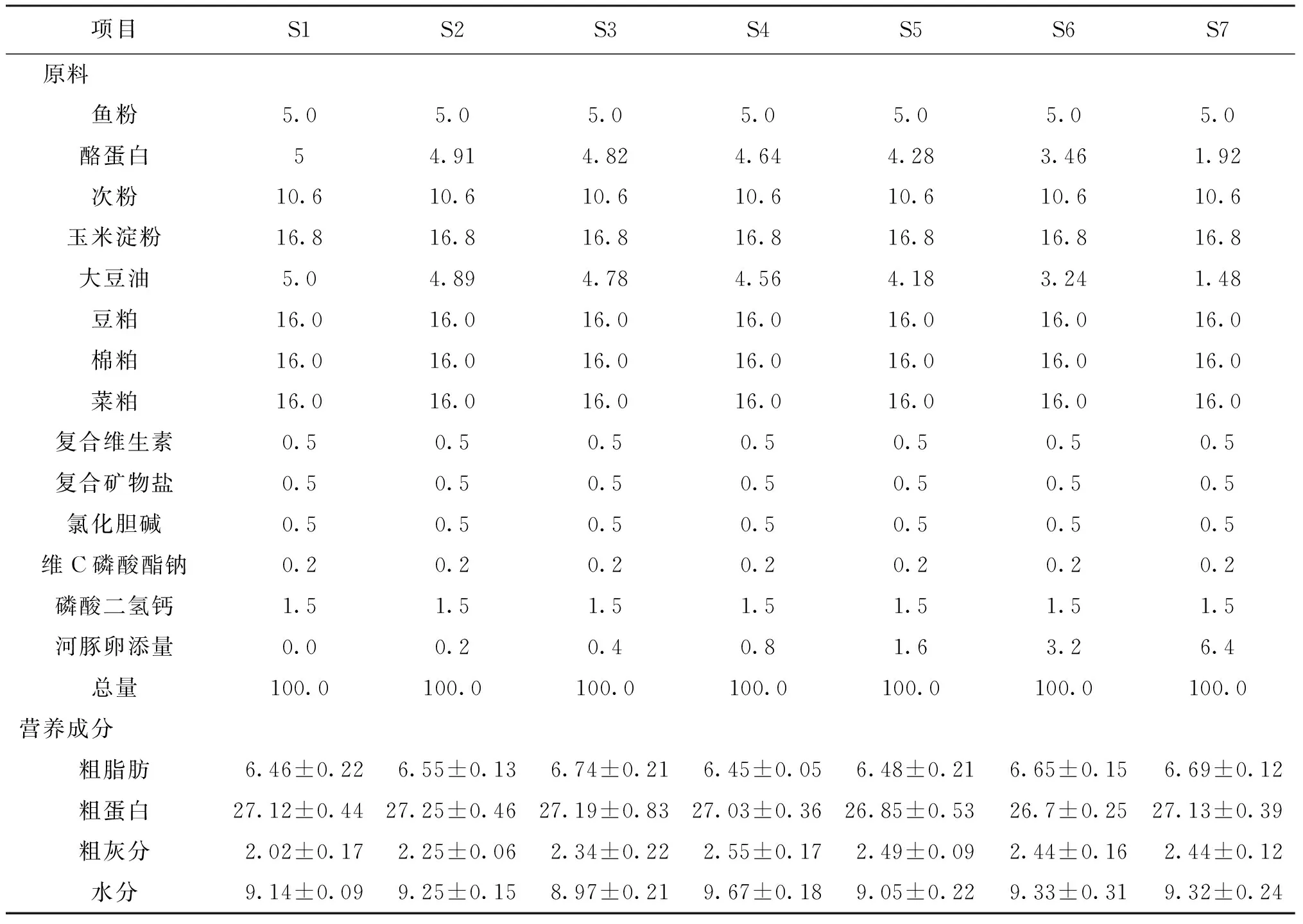
表2 饲料组成和营养成分分析Tab.2 The composition and nutrients analysis of feed %
1.2 实验用鱼与饲养管理
实验鱼选自中国水产科学研究院淡水渔业研究中心无锡宜兴基地。实验开始前,将鱼放入室内450 L循环养殖桶中,在(28±1)℃水温下暂养15 d。在此期间,投喂市售商品膨化饲料(粗蛋白质28.0%,粗脂质6.0%)(宁波天邦股份有限公司)。挑选初始体重为(0.66±0.01)g、体质健壮、无病无伤的吉富罗非鱼用于实验。实验设1个对照组和6个实验组,各组依次投喂S1、S2、S3、S4、S5、S6、S7组饲料,每组设置3个重复,每个重复25尾鱼,分别放入21个450 L循环养殖桶,桶内含水约360 L。实验期间,每天两次饱食投喂(8 ∶00和16 ∶00),并在鱼类摄食完毕后清除桶底粪便,每3 d换水1/3,使水体溶氧保持在6 mg/L以上,水温控制在(28±1)℃,pH值控制在7.4~7.8,氨氮含量<0.1 mg/L。养殖周期为8周。
1.3 样品采集与处理
采样前,吉富罗非鱼禁食24 h。用浓度为200 mg/L的MS-222预先麻醉,记录每桶鱼的尾数并且称重,每桶随机取4尾鱼抽取血液,吸取20 μL用于血常规检测,剩余血液经4 ℃ 5 000 r/min离心15 min收集血清,放入-40 ℃冰箱保存备用。采血后进行解剖,取肝脏组织称重后,用生理盐水漂洗、吸干其表面水分后再放入-40 ℃冰箱保存;同时取剩余内脏团并称重。
1.4 指标测定及计算
1.4.1 生长指标
成活率(SR)、体增重(WG) 、特定生长率(SGR)、饲料转化率(FCR)、肝脏比(HSI)和脏体比(VSI)。计算公式如下:
SR=100%×Nt/N0;
WG=Wt-W0;
FCR=Wf/(Wt-W0);
SGR=(lnWt-lnW0)/d×100%;
HSI=100%×Wl/Wt;
VSI=Wv/Wt×100%
式中,Nt为终末鱼尾数;N0为初始鱼尾数;Wt为终末鱼体重(g);W0初始鱼体重(g);Wf为尾均摄食饲料总量(g);d为养殖天数;Wv为内脏重;Wl为肝脏重。
1.4.2 血常规指标
根据Qiang等[9]描述的方法使用血细胞分析仪(Mindray,bc-5300,Shenzhen,China)对血常规指标包括白细胞(WBC)、红细胞(RBC)、血红蛋白(HGB)以及红细胞比容(Hct)进行计数,所有试剂购自深圳迈瑞生物医疗电子股份有限公司(深圳)。
1.4.3 血液生化指标
血清中总蛋白(TP,双缩脲法)、甘油三酯(TG,氧化酶法)、总胆固醇(TC,氧化酶法)、葡萄糖(己糖激酶法)的浓度以及谷草转氨酶(AST)和谷丙转氨酶(ALT,IFFT酶比色法)的活性使用自动生化分析仪(Mindray,BS-400,Shenzhen,China)测定,所有试剂盒均购自于深圳迈瑞有限公司(深圳,中国)。血清溶菌酶(LZM)活性、皮质醇(COR)、肿瘤坏死因子(TNF-α)、白细胞介素1(IL-1β)和γ-干扰素(IFN-γ)的浓度参照试剂盒说明书进行测定,试剂盒购自上海朗顿生物科技有限公司(上海)。
1.5 海豚链球菌感染实验
1.5.1 供试菌株及来源及培养基的制备
供试海豚链球菌菌株由广西水产科学研究院提供,从患病吉富罗非鱼上分离鉴定而来。本次实验所用培养基为脑心浸液液体培养基,按培养基说明书配置1 L溶液,经121 ℃灭菌15 min后分装,4 ℃冷藏备用。
1.5.2 海豚链球菌菌液的制备
将海豚链球菌接种于已制备好的无菌脑心浸液液体培养基中,放入摇床,过夜振荡培养(37 ℃,180 r/min)。细菌浓度通过平板计数达到1010~1011数量级后,离心收集细菌,用0.85% NaCl重悬,稀释浓度至5×106~5×108CFU/mL,用于后续实验。
1.5.3 海豚链球菌感染实验
根据文献[10,11]的方法,配制5×106、1×107、5×107、1×108、5×108CFU/mL 5个海豚链球菌液浓度水平,随机选取60尾与实验鱼同等规格的鱼进行预实验,选择注射后使吉富罗非鱼接近半数致死(96 h)的菌液浓度(5×107CFU/mL)用于正式实验。养殖实验结束后,将剩余吉富罗非鱼继续暂养10 d,正常投喂,以减少采样应激。正式实验时,按每100 g鱼体重/0.5 mL注射菌液(5×107CFU/mL)。实验期间正常投喂,水体溶氧保持在6 mg/L以上,水温控制在(28±1)℃,pH值控制在7.4~7.8,氨氮含量<0.1 mg/L。每天观察吉富罗非鱼活动情况,及时捞出死鱼,记录24、48、96、192 h吉富罗非鱼死亡数。
1.6 数据统计与分析
实验结果均采用平均值±标准误(mean ± SE,n=12)表示。使用SPSS 20.0统计软件中单因素方差分析和Duncan’s多重比较法对试验结果的差异显著性进行分析处理,P<0.05表示差异显著。
2 结果
2.1 河豚卵处理物对吉富罗非鱼生长性能的影响
由表3可知,养殖实验开始前七组罗非鱼的初始体重无显著差异,饲喂8周后,0.2%河豚卵处理物添加组罗非鱼的末体重(FBW)、WG和SGR显著高于对照组和其他河豚卵处理物添加组,且对照组罗非鱼FBW、WG和SGR与0.4%添加组无显著差异,但均显著高于其他添加组。HSI和VSI均在0.8%添加组达到最高,但各组间HSI无显著差异,0.8%河豚卵处理物添加组罗非鱼的VSI显著高于其他组,而随着河豚卵处理物添加水平提高,饲料转化率(FCR)呈现先下降后上升的趋势。
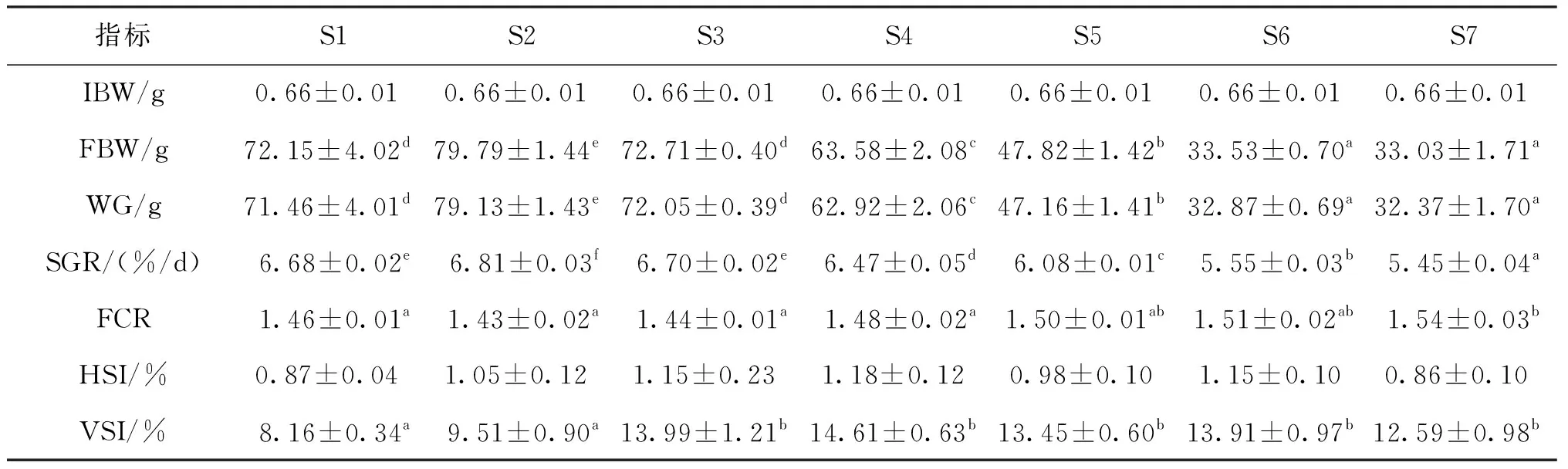
表3 河豚卵处理物对吉富罗非鱼生长性能的影响Tab.3 Effects of extract powder from puffer fish ovaries on growth performance of GIFT
2.2 河豚卵处理物对吉富罗非鱼血液生化的影响
饲喂8周后,不同水平的河豚卵处理物对吉富罗非鱼血液指标影响的结果见表4。随着河豚卵处理物添加水平提高,河豚卵处理物添加组罗非鱼血液中RBC、HGB、HCT的含量逐渐降低,且与对照组相比,HGB和HCT的值显著降低,而WBC的含量逐渐升高,且1.6%、3.2%以及6.4%添加组罗非鱼血液中WBC含量显著高于对照组。
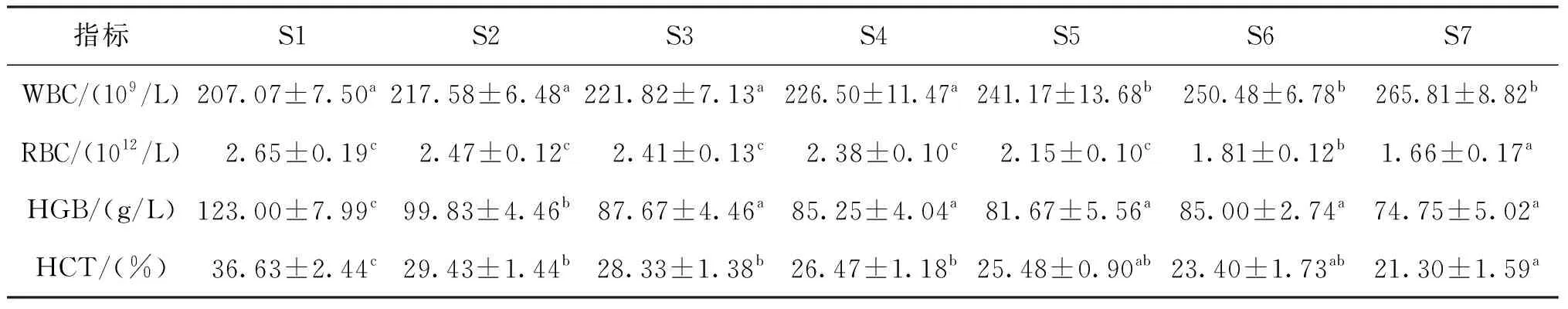
表4 不同添加水平的河豚卵处理物对吉富罗非鱼血液生化指标的影响Tab.4 Effects of different levels of extract powder from puffer fish ovaries on biochemical blood indicators of GIFT
2.3 河豚卵处理物对吉富罗非鱼血清生化指标的影响
饲喂8周后,对吉富罗非鱼血清生化指标影响的结果见表5。罗非鱼血清中TP的含量随着河豚卵处理物添加水平的增加而下降,对照组罗非鱼血清中TP、GLU的含量显著高于添加组;而TC和TG的含量随着河豚卵处理物添加浓度水平的增加而下降,且TC含量在6个实验组间无显著差异;对照组罗非鱼血清中AST、ALT的活性与0.2%、0.4%添加组无显著差异,但显著低于0.8%、1.6%、3.2%以及6.4%添加组。随着河豚卵处理物添加水平的增加,与对照组相比,河豚卵处理物添加组血清溶菌酶(LZM)含量逐渐增加,但无显著差异。
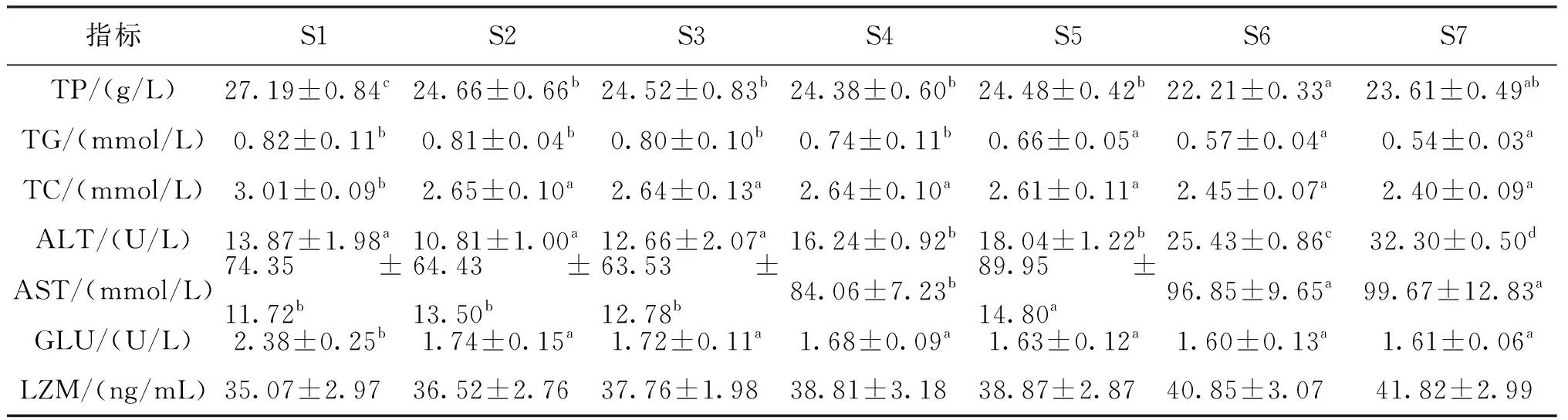
表5 不同添加水平的河豚卵处理物对吉富罗非鱼血清生化指标的影响Tab.5 Effects of different levels of extract powder from puffer fish ovaries on serum biochemistry of GIFT
2.4 河豚卵处理物对吉富罗非鱼血清皮质醇及部分促炎因子的影响
由图1可知,饲喂添加河豚卵处理物饲料后,与对照组相比,河豚卵处理物添加组罗非鱼血清皮质醇(COR)、血清肿瘤坏死因子(TNF-α)、白细胞介素1(IL-1β)和γ-干扰素(IFN-γ)的浓度均呈先上升后趋于稳定的趋势。与对照组相比,6.4%河豚卵处理物添加组罗非鱼血清COR、TNF-α、IL-1β和IFN-γ的浓度均显著增加。
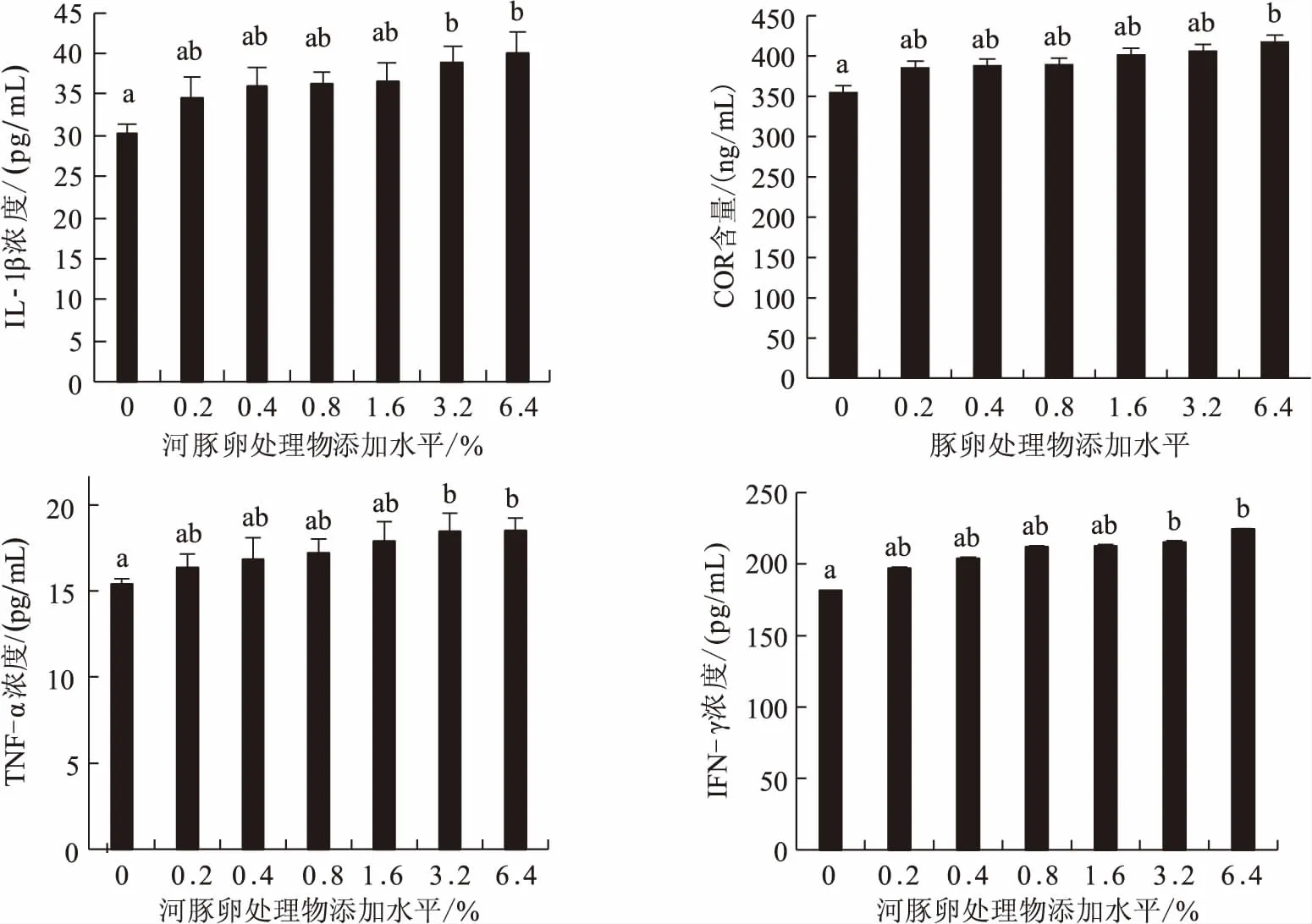
图1 不同添加水平的河豚卵处理物对吉富罗非鱼COR、TNF-α、IL-1β和IFN-γ的影响(n=12)
2.5 河豚卵处理物对吉富罗非鱼感染海豚链球菌后存活率的影响
不同添加水平的河豚卵处理物对吉富罗非鱼感染海豚链球菌后存活率的影响结果见图2。罗非鱼在感染海豚链球菌24 h内均未出现死亡;感染48~96 h,对照组罗非鱼累计存活率最低,与河豚卵处理物添加组差异显著;感染192 h后,6.4%河豚卵处理物添加组罗非鱼累计存活率达到95.2%,对照组累计存活率为43.3%,各河豚卵处理物添加组罗非鱼累计存活率显著高于对照组。
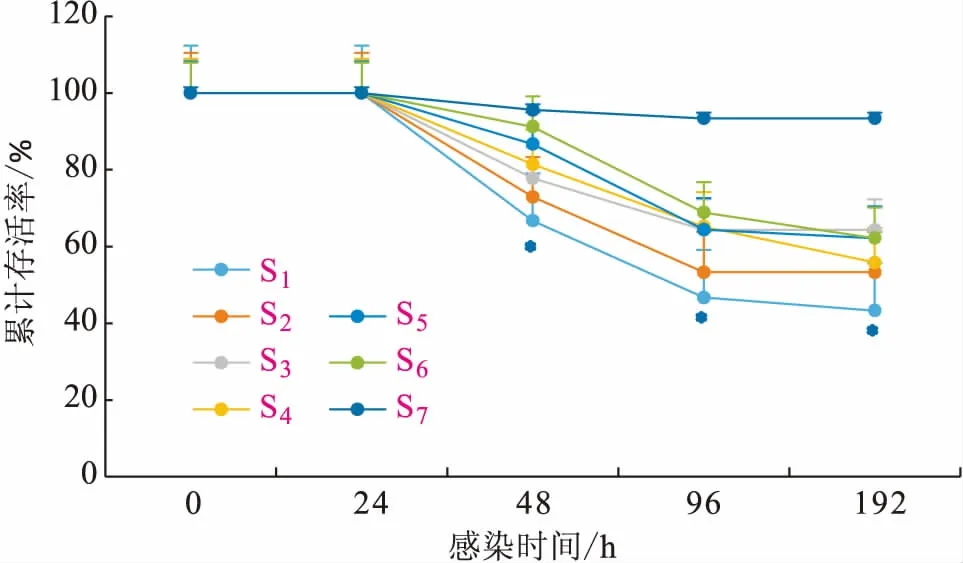
图2 不同添加水平的河豚卵处理物对吉富罗非鱼感染海豚链球菌累计存活率的影响Fig.2 Changes of cumulative survival rate after GIFT challenged with S.iniae under different extract powder from puffer fish ovaries levels
3 讨论
3.1 河豚卵处理物对吉富罗非鱼生长性能的影响
赵荣兴等[12]研究发现向饲料中添加河豚毒素
饲养河豚不仅能提高鱼体的免疫力,降低鱼病的发生率,而且添加河豚毒素的饲料可以作为河豚生长的营养饲料。本实验中河豚卵处理物虽经过脱毒处理,但其内仍存在一定浓度的TTX。饲料中微量的TTX可能在对罗非鱼免疫能力增强,同时微量的外源毒素胁迫能更好调动鱼体代谢与抗应激能力,提高鱼体对营养物质的吸收从而促进生长。但随着河豚卵处理物浓度的增高,罗非鱼的生长也呈现出明显的抑制作用。HSI和VSI是可用来说明鱼体健康状况的两个指标[13],在0.8%河豚卵处理物添加组中,HSI和VSI达最高值。因此我们推测随着河豚卵处理物添加量增加,可能会抑制罗非鱼肝、内脏的生长发育,并且显著抑制罗非鱼的WG。因此我们推测,微量添加的河豚卵处理物(0.2%)对吉富罗非鱼的生长有一定的促进作用。
3.2 河豚卵处理物对吉富罗非鱼血液生化的影响
鱼的血液组成受新陈代谢、营养状况和疾病的影响[14]。血液作为免疫系统的重要组成部分,血液生化指标的改变也是衡量生物体健康程度的一个重要标准[15,16]。RBC在血液中承担着氧气运输的作用[17]。RBC、WBC、HGB和HCT等血液参数水平的变化反映个体的健康状况[18]。RBC影响氧气和二氧化碳的输送。HGB是一种在鱼体内携带氧气的蛋白质,因此其浓度与RBC计数密切相关[19]。本研究中,对照组RBC和HCT值最高,随着河豚卵处理物添加水平的提高,呈逐渐下降的趋势。与此同时,HGB的浓度随着河豚卵巢处理物添加水平的提高也呈下降趋势。强俊等[10]推测,在最适温度下,食物摄入量增加,代谢能力提高,导致氧气需求增加,RBC含量增加。然而,本实验中随着河豚卵处理物添加水平的提高,高添加组中较高的TTX含量造成罗非鱼摄食量减少,代谢能力降低。可能对氧气需求减少,导致RBC含量减少。HGB和WBC在免疫系统中发挥作用。WBC数的变化可用于检测鱼类的疾病或伤害[20]。在本研究中,WBC含量逐渐升高,这与强俊等[10]及Slatea等[21]人的观察结果一致。WBC含量增多表明河豚卵处理物可能提高鱼体免疫力。
3.3 河豚卵处理物对吉富罗非鱼血清生化的影响
血清GLU、TP、ALT和TC等指标是一些具有代表性的血清生化指标,通常会被用来观察应激对鱼体的影响[22]。研究表明,TG和TC含量反映了脂质的吸收情况[23]。在本研究中,对照组罗非鱼的TC和TG含量最高,说明高添加水平的河豚卵处理物可能有利于罗非鱼脂肪的吸收,也可能对罗非鱼的脂质代谢有一定的促进作用。肝脏中的多种酶活性的变化可以很好地反映鱼体的代谢与功能的变化[24],Senior[20]研究发现血清中ALT的变化能及时反映肝脏的损伤情况。此外,血清TP维持着鱼体血浆渗透压以及pH的平衡,并且在鱼体中参与营养运输、凝血、免疫和能量供应等活动[25]。河豚卵处理物添加组的甘油三酯含量下降,可能是因为鱼体需要抵抗TTX的应激效应,导致脂肪酸氧化供能需求增加,进一步导致脂质分解供能增加[26]。一些研究指出,TG含量的增加表明肝脏中的脂肪积累,并导致脂肪肝或肝脏肥大[27]。另一方面,Griffith[28]认为血清TC与TP的变化是密切相关的,TC是血液中各种胆固醇的集合,肝脏作为胆固醇最为重要的调节器官[29],在饲料中添加河豚卵处理物条件下,TC的显著变化可能反映了肝脏功能的异常与损伤。结合罗非鱼诸多血清指标下降的情况,这可能是由于罗非鱼无法适应高水平河豚卵处理物而产生的变化。
AST、ALT主要分布于肝细胞中,当肝细胞受损伤时,ALT和AST在血清中的含量升高,其变化趋势与肝细胞受损程度相一致[30,31]。本试验中,随着河豚卵处理物添加水平的提高,ALT、AST急剧上升,也表明添加高水平河豚卵处理物对罗非鱼肝脏有损伤,使罗非鱼生长性能降低,思考其原因可能是因为高水平河豚卵处理物组中含有较高浓度的TTX,超过一定浓度的TTX造成鱼体肝脏的损伤,这与生长指标中所呈现的现象相互印证。但添加水平小于0.4%时,ALT、AST较对照组有下降,说明饲料中添加0.2%和0.4%河豚卵处理物可能对罗非鱼肝脏有一定保护作用。
3.4 河豚卵处理物对吉富罗非鱼感染存活率的影响
感染实验中我们采用5×107CFU/mL浓度的海豚链球菌菌液对吉富罗非鱼进行腹腔注射,6.4%河豚卵处理物添加组累计存活率显著高于对照组与其他河豚卵处理物添加组,这与沈凡等[32]研究结果有所差异。6.4%河豚卵处理物组末体重(33.03 g)显著低于对照组末体重(72.15 g),我们推测规格上的较大差异是造成累计存活率差异的原因之一。同时,本研究中河豚卵处理物添加组吉富罗非鱼WBC的数量明显上升,TNF-α, IL-1β,以及IFN-γ等促炎因子的浓度均呈先上升后趋于稳定的趋势,河豚卵处理物实验组饲料中均含有一定浓度的TTX ,长期外源毒素胁迫可能激活了吉富罗非鱼体内的免疫防御系统,在面对海豚链球菌侵染时,使得吉富罗非鱼具有较强的抵抗力。此外,溶菌酶是鱼类的免疫系统的一种防御酶,它负责分解多种细菌的细胞壁,从而对鱼体细菌感染提供一些保护[33]。相关研究报道,机体感染病原菌后,血液溶菌酶活性会出现增加[18],或无显著影响[34]的结果。在本研究中,随着河豚卵处理物添加水平增加,血清溶菌酶活性升高,类似结论在其他研究中也有出现[35]。本研究中添加组罗非鱼感染后存活率远高于对照组。因此,饲料中添加河豚卵处理物的可提高罗非鱼抵抗海豚链球菌感染的能力,然而河豚卵处理物的添加引起的罗非鱼免疫系统改变,对于其具体的作用机制尚未可知,需要进一步的研究。
