海参性腺酶解物制备及其体外清除自由基活性测定
2020-07-24吴国宏熊何健
吴国宏,熊何健,李 露
海参性腺酶解物制备及其体外清除自由基活性测定
吴国宏1,熊何健1,李 露2
(1. 集美大学食品与生物工程学院,福建 厦门 361021; 2. 劲牌有限公司研究院,湖北 黄石 435100)
【】酶解海参性腺并分析其体外清除自由基活性。采用外源性蛋白酶水解工艺制备海参性腺酶解产物,通过酶解效果比较分析,考察其体外清除DPPH自由基和羟自由基能力。确定木瓜蛋白酶为水解用酶,利用响应面优化实验确定酶解条件为酶解时间14 h、酶添加量3 000 U/g、料液比1∶40;酶解液灭酶后经离心、浓缩、干燥后得到粉状海参性腺酶解物,其主要成分质量分数分别为蛋白肽48.4%、矿物质16.8%、粗脂肪12.4%、水分9.8%;酶解产物清除DPPH自由基和羟自由基的 IC50值分别为3.39、5.83 mg/mL。海参性腺酶解物具有良好的抗氧化活性。
海参性腺;木瓜蛋白酶;酶解;抗氧化
海参性腺含多种生物活性物质,许多珍贵的性腺色素如海胆紫酮、β胡萝卜素、虾青素、角黄素、玉米黄质等[1-2],以及丰富的精氨酸、皂甙、刺参脂质、钒、硒、铁、锌等营养物质[3-4],是优良的保健食品素材。王婷等[5]利用木瓜蛋白酶酶解海参生殖腺得到海参精多糖对人子宫颈癌 Hela 细胞和人肝癌 Hep G2 细胞的体外生长有抑制作用,具有显著体外抗肿瘤活性。何传波等[6]通过中性蛋白酶对海参内脏进行水解,得到的酶解产物对小鼠具有一定抗疲劳功效和体抗氧化作用。赵玲等[7]利用3种蛋白酶对海参冻干粉进行酶解,得到酶解多肽对羟自由基、超氧自由基和DPPH自由基均有清除作用,且清除能力均随样品质量浓度的升高而增强。目前,福建霞浦海参加工过程中,性腺多被直接废弃,造成资源浪费,并给当地水域环境造成不良影响。
本研究采用木瓜蛋白酶酶解海参性腺,通过单因素分析和响应面优化实验确定最适酶解条件,并探讨酶解产物清除自由基活性,为海参性腺在保健食品、特膳食品领域的开发应用提供技术基础。
1 材料与方法
1.1 材料与试剂
海参性腺:新鲜海参性腺采自福建霞浦(含水量为85% ~ 87%),不分雌雄体,冷冻干燥后备用。测得主要成分质量分数分别为粗蛋白(38.4±0.5)%,灰分(18.8±0.3)%,粗脂肪(14.0±0.2)%,水分(8.8±0.1) %,多糖(8.4±0.2)%,皂甙(1.1±0.2)%,其它11.6%。
细胞色素C、胰岛素、杆菌肽、氧化型谷胱甘肽、乙氨酸-乙氨酸-乙氨酸、1,1-二苯基-2-三硝基苯肼、木瓜蛋白酶、福林酚,SIGMA公司;羟自由基试剂盒,南京建成有限公司。
1.2 仪器与设备
FD-1-50真空冷冻干燥机,北京博医康实验仪器有限公司;Ultimate3000高效液相色谱仪,美国DIONEX公司。
1.3 理化指标测定方法
总灰分含量测定,参照GB 5009.4-2010;水分测定,参照GB 5009.3-2010;粗脂肪测定,参照GB/T 14772-2008;总蛋白氮测定,微量凯氏定氮法,参照GB 5009.5-2010;多糖测定,参照SN/T 4260-2015。
1.4 蛋白酶的筛选
称取适量海参性腺,按质量1∶50的料液比加入蒸馏水,在50 ℃的恒温水浴中密封振荡,在蛋白酶最佳酶解温度处保温5 min,用稀NaOH或稀HCl调节至各蛋白酶最佳工作时的pH值,加当量的蛋白酶,密封振荡酶解6 h后,将酶解液置于95 ~ 100 ℃加热15 min钝化灭酶,4 000 r/min离心15 min,取酶解液上清液部份测定其水解度和清除DPPH自由基能力[8]。
1.5 响应面法实验因素的选取
以海参性腺蛋白水解度为响应值,选择影响酶解反应的酶解时间、加酶量和料液比等条件进行单因素实验,分析各因素对水解度的影响。在上述单因素实验结果的基础上,运用Design Expert8.0.6.1软件进行数据拟合与方差分析,从而确定海参性腺的最佳酶解条件[9]。
1.6 蛋白水解度的测定
采用甲醛滴定法[10],测定样液中氨基酸态氮的含量。
蛋白质水解度是指水解液中游离的氨态氮和总氮的比值,即水解度(DH)的测定公式表示为:DH=/。式中为酶解液氨态氮质量(mg);为样品总氮质量(mg)。
1.7 羟自由基清除活性测定
用1 cm光径比色皿,在波长为550 nm处,蒸馏水调零,测各样品管的光密度值。计算公式:
羟自由基清除率 =[i-(j+0)] /i,(1)
公式中,j为无样品对照管在550 nm下光密度,i为样品测定管在550 nm下光密度,0为调零组。
1.8 DDPH自由基清除活性测定
参照Shimada等方法,测定酶解液清除DPPH自由基能力[11]。根据以下公式计算样品的清除率:
DDPH自由基清除率 = [j-(i-0)] /j,(2)
公式中,j为无样品对照管在517 nm下光密度,i为样品测定管在517 nm下光密度,0为样品溶剂在517 nm下光密度。
1.9 蛋白肽分子质量的测定
参考国标GB22729-2008,采用液相色谱法进行测定,记录样品出峰时间,根据标准曲线求出海参性腺酶解蛋白肽的分子质量分布[12]。
校正曲线所用的标准品:乙氨酸-乙氨酸-乙氨酸(MW 307 u),GSSG(MW 613 u),杆菌肽(MW 1 636.7 u),胰岛素(MW 6 512 u),细胞色素C(MW 12 384 u)
2 结果与分析
2.1 水解用酶的选择
选择木瓜蛋白酶、碱性蛋白酶、风味蛋白酶、中性蛋白酶和胰蛋白酶在其适宜的酶解条件下对海参性腺进行酶解,料液比1∶50、酶添加量2 500 U/g、酶解6 h,测定参性腺酶解液的水解度及其对DPPH自由基清除率,结果见表1。风味蛋白酶水解能力最强,水解度最高,达到32.01%,但水解物的DPPH清除率只有15.90%。风味蛋白酶是复合蛋白酶,有端肽酶活性[13],容易水解产生游离氨基酸,不利于获得小分子的活性肽,因而酶解物清除DPPH活性偏低。木瓜蛋白酶的水解能力仅次于风味蛋白酶,水解度为27%,清除DPPH自由基活性最高,清除率为25.80%,故选用木瓜蛋白酶作为本研究的水解用酶,进行后续研究。
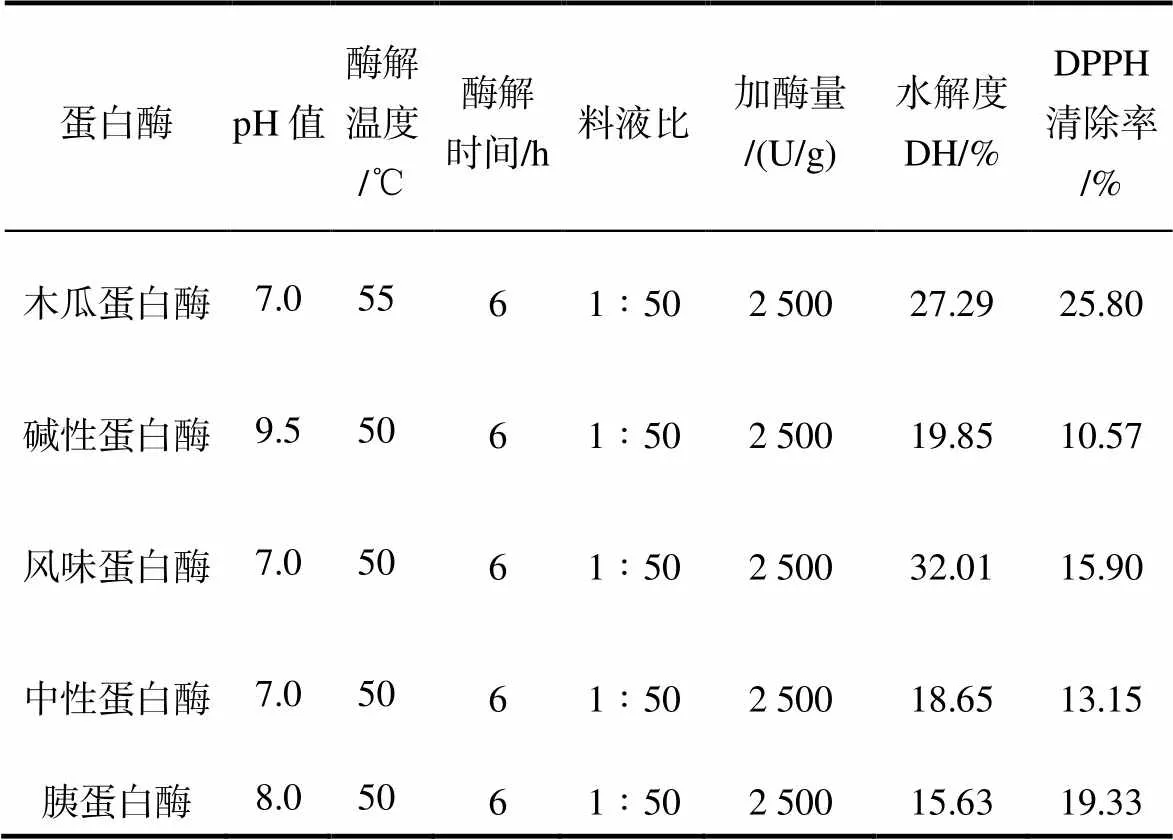
表 1 不同蛋白酶对海参性腺的酶解效果
2.2 加酶量对水解度的影响
料液比1∶50、pH 7.0、酶解温度55 ℃、酶解时间9 h条件下,比较加酶量对木瓜蛋白酶水解度的影响(图1)。从图1可能看到,随着加酶量增大水解度呈现上升趋势,但当加酶量达到2 500 U/g后水解度上升趋势随加酶量增加曲线斜率变小,曲线呈现平缓增加,这可能是因为当酶的用量大于其最佳浓度时,水解效果不会明显提高,反而会引起酶的自溶作用的增强[14]。
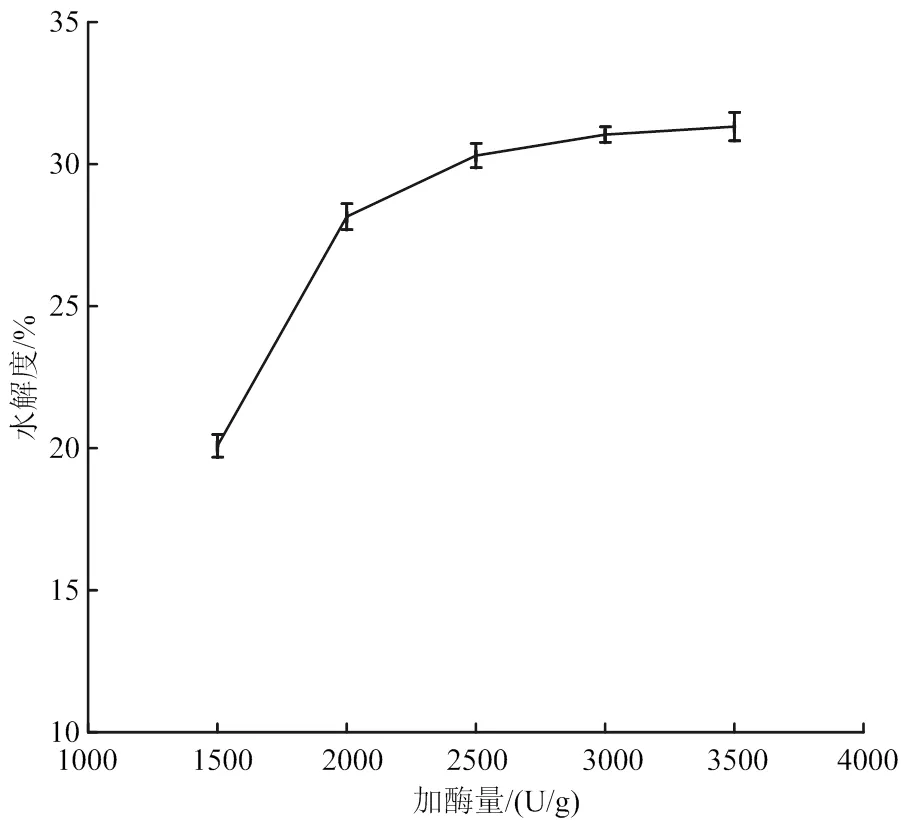
图1 酶添加量对水解度的影响
2.3 液料比对水解度的影响
加酶量2 500U/g、pH 7.0、酶解温度55℃、酶解时间9 h条件下,比较料液比对木瓜蛋白酶水解度的影响(图2),当料液比为1∶30到1∶40时,水解度随着料液比增大而增加;当料液比大于为1∶50时,水解度随着料液比增大开始下降。这是由于酶解反应必须在水溶液中进行,料液比的增大有利于酶解产物扩散,但底物浓度过低会导致酶解液中氨基酸和多肽浓度降低,由于反应物分散度增大使得酶促反应速率下降,导致水解度降低[15],并在后续浓缩、干燥等加工处理中增加了生产工艺的生产成本。所以,料液比在1∶40 ~ 1∶50附近海参性腺酶解液可达到较高水解度。
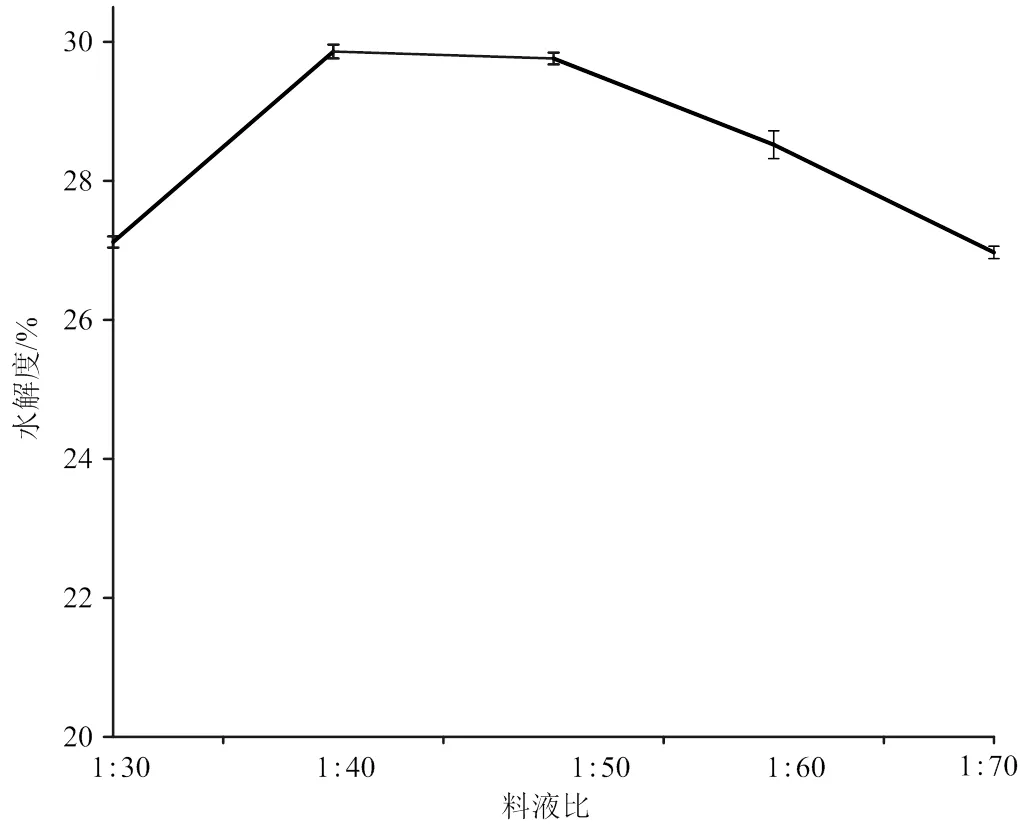
图2 料液比对水解度的影响
2.4 酶解时间对水解度的影响
料液比1∶50、加酶量2 500 U/g、pH 7.0、酶解温度55 ℃条件下,分析酶解时间对木瓜蛋白酶水解度的影响(图3)。从图3中可以看到,海参性腺水解度的增量变化随着酶解时间增加而增加,但随着酶解时间增加水解度上升趋势出现了曲线斜率变小,曲线呈现平缓增加,在酶解12 h内水解度增加量显著,12 h后水解度的增量变化在变小,水解趋于完成。
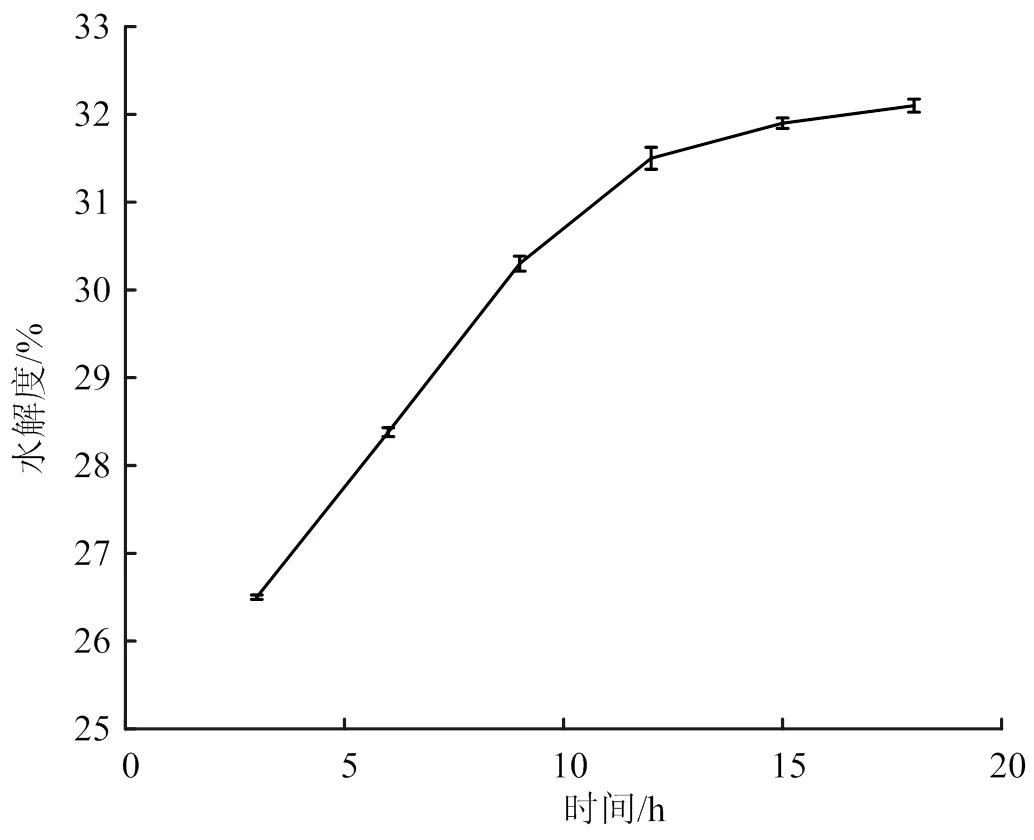
图3 酶解时间对水解度的影响
2.5 酶解条件的响应面优化
2.5.1 响应面实验结果和分析 选择海参性腺酶解时间、料液比和加酶量为因素,以酶解海参性腺的水解度为响应值,在单因素实验基础上,利用响应面设计对木瓜蛋白酶水解条件进行优化,实验设计及结果见表2。利用Design Expert 8.0.6.1软件对表3的数据进行方差分析,结果见表3。
使用Design Expert对表2实验数据进行多元回归拟合,得到的海参性腺水解度对酶解时间(A)、料液比(B)、加酶量(C)的模型方程为:=-19.44+3.19+1.25+9.16×10-5-0.02+3.33×10-5-4.1×10-5-0.082-0.012+9.3×10-72。二次多项回归模型方程中各项系数绝对值大小可以反映各因素对海参性腺酶解度的影响程度,二次项式系数为负值,所以该模型方程的抛物线开口朝下,表明该模型方程存在最大值并可以优化分析。观察模型方程的一次项系数可得到影响海参花水解度因素的主次顺序为:C>A>B,加酶量的回归系数最大,是影响海参性腺酶解率最重要的线性变量,呈极具统计学意义 (< 0.01),其次是酶解时间具有统计学意义 (< 0.05),再次是料液比,其影响不具统计学意义[16]。
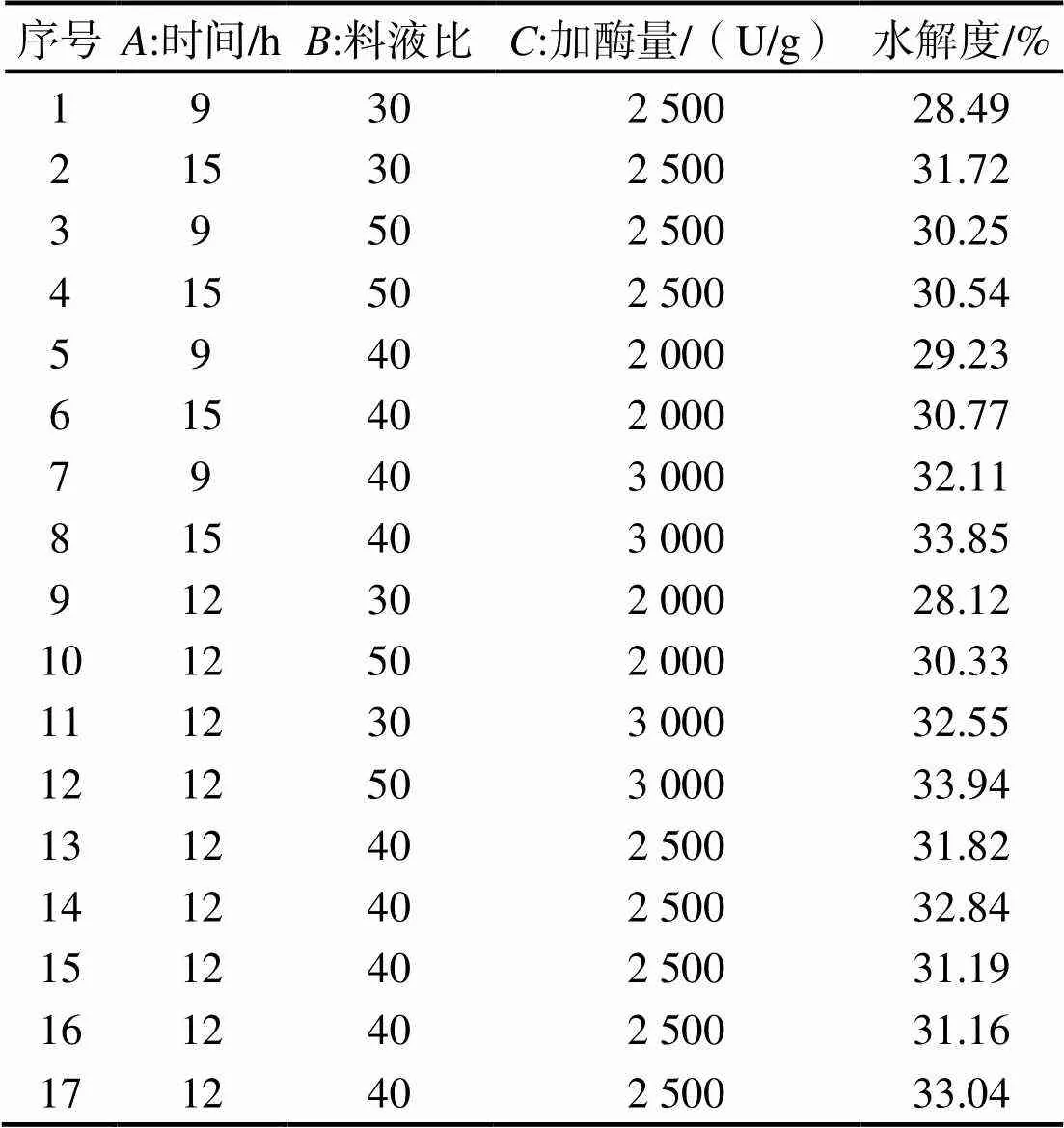
表2 响应面实验设计及结果
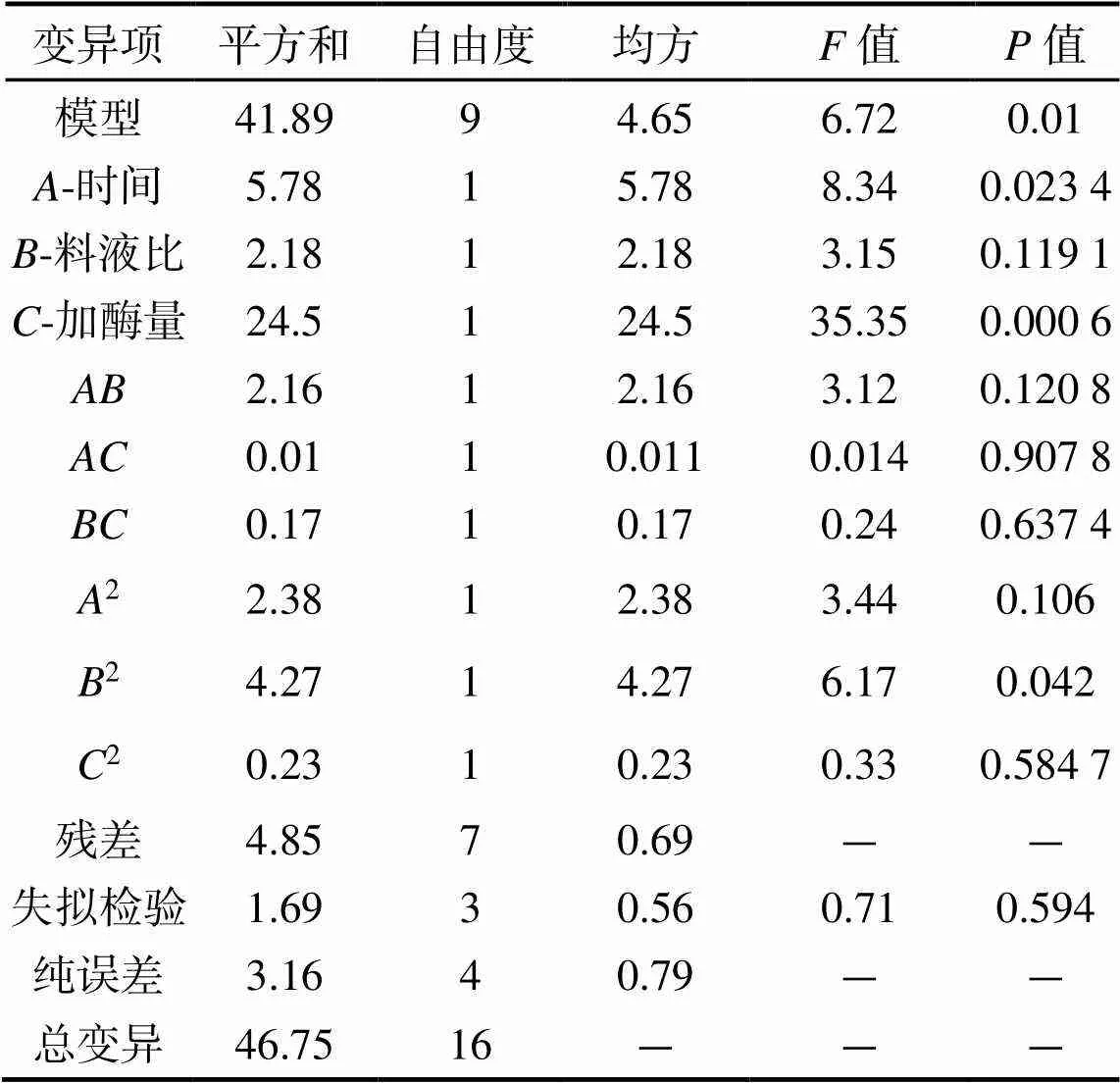
表3 回归模型方差分析
对模型进行方差分析,结果见表3,方程中各变量对水解度回归模型值的影响概率(< 0.05),表明该二次多项回归模型表现显著,回归模型失拟检验(> 0.05)不显著,说明回归模型稳定,并与实际情况拟合较好能够满足响应面分析,可以用此模型对实验进行响应面分析和预测[17]。
2.5.2 响应面分析和条件优化 响应面分析是通过Design Expert 8.06 软件对各因素的交互作用绘制的三维空间曲面图(图 4),由图4可知,当料液比固定时,水解度变化较敏感的,呈先上升后趋于平缓,加酶量上升较水解度时间更加显著。同时酶解时间与加酶量二因素相关系数小表示交互作用很小。当加酶量固定时,水解度变化是敏感的,呈先上升后下降趋势,水解度随时间表上升较比料液比更加显著。料液比和时间二因素相关系数较大表示其交互作用较强。当时间固定时,水解度随料液比的变化比加酶量的更加显著,同时料液比与加酶量二因素相关系数较小表示其对水解度的影响相对较小。
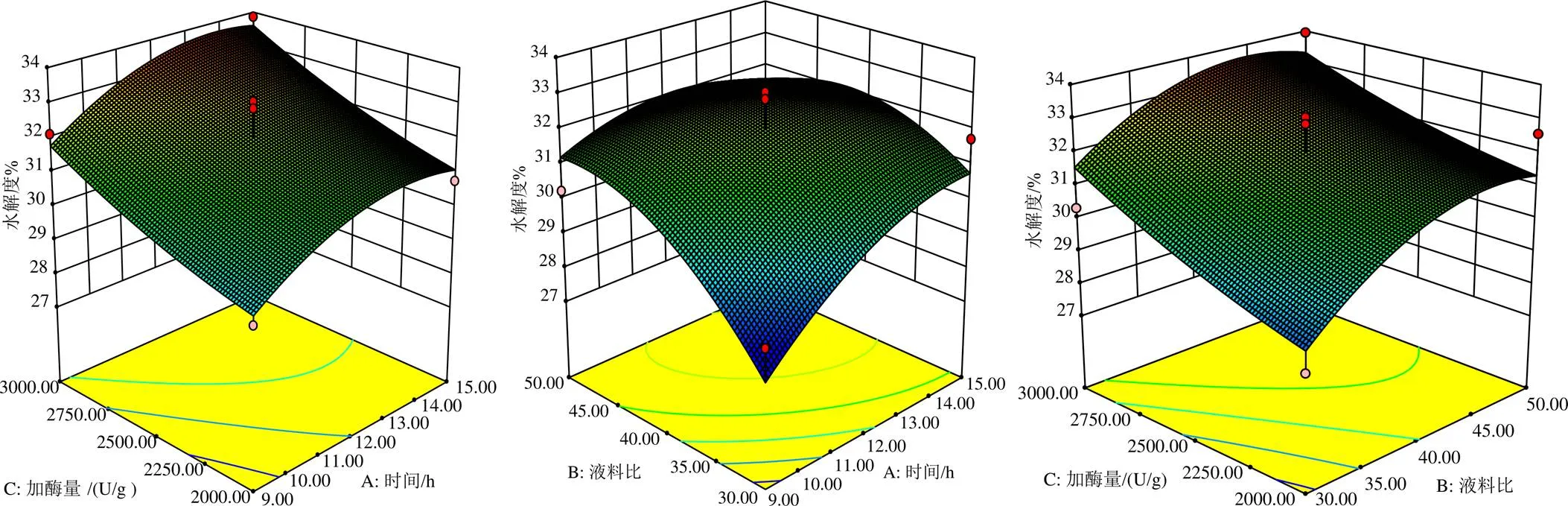
图4 因素间相互作用的响应面
Design Expert对于实验的优化结果:酶解时间13.9 h,加酶量为3 000 U/g时,料液比为1∶39.25,最大水解度为34.27%。通过验证性实验,当酶解时间14 h,料液比为1∶40,加酶量为3 000 U/g时,水解度为34.06%。说明验证实验结果与响应面分析所得到结论相一致。
2.6 酶解产物成份分析
海参性腺经酶解液经过滤、浓缩、冷冻干燥后得海参海参性腺酶解物,基本营养成分如表4所示。酶解物中除蛋白肽外,还保留较高含量的多糖、海参皂苷等活性物质。

表4 海参性腺酶解物营养成分
2.7 海参性腺酶解产物清除羟自由基活性
海参性腺酶解物清除·OH自由基活性如图5所示。随浓度升高,羟自由基的清除率增加,在10 mg/mL时清除羟自由基为67%。在2 ~ 10 mg/mL浓度范围内,海参性腺酶解物清除羟自由基活性与浓度呈线性关系,回归方程:=3.95+ 26.96,2= 0.994。海参性腺酶解物和GSH清除羟自由基的IC50分别为5.83 mg/mL,10.66 mg/mL。海参性腺酶解物清除·OH自由基活性显著高于GSH。
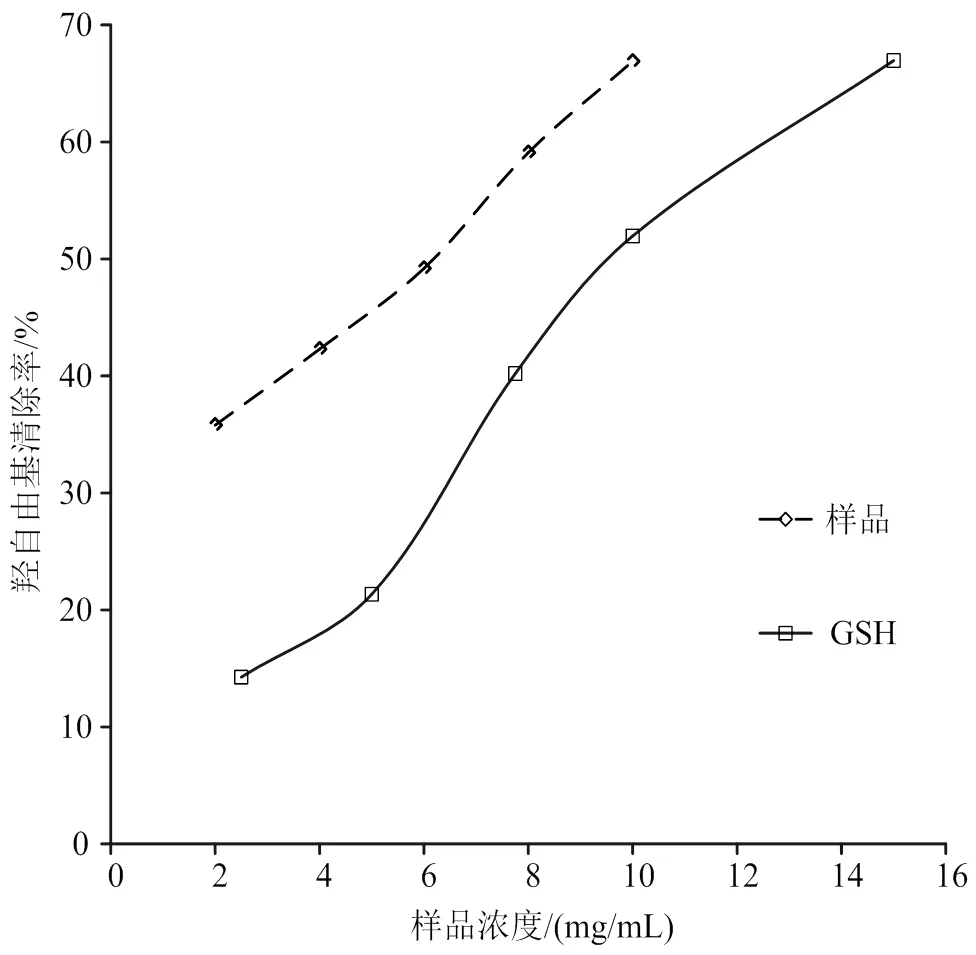
图5 酶解物和GSH对·OH清除效果
2.8 海参性腺酶解产物清除DPPH自由基活性测定
海参性腺酶解物清除DPPH自由基活性如图6所示。酶解物活性随浓度增加而增大,在6.0 mg/mL时达到最大,DPPH自由基清除率为77%。在0.25 ~ 6.0 mg/mL浓度范围内,清除率()与浓度()呈线性关系,回归方程= 12.02+ 9.214,2= 0.985 ,IC50值为3.39 mg/mL。GSH清除DPPH自由基的IC50为0.71 mg/mL。酶解物清除DPPH自由基能力弱于GSH。
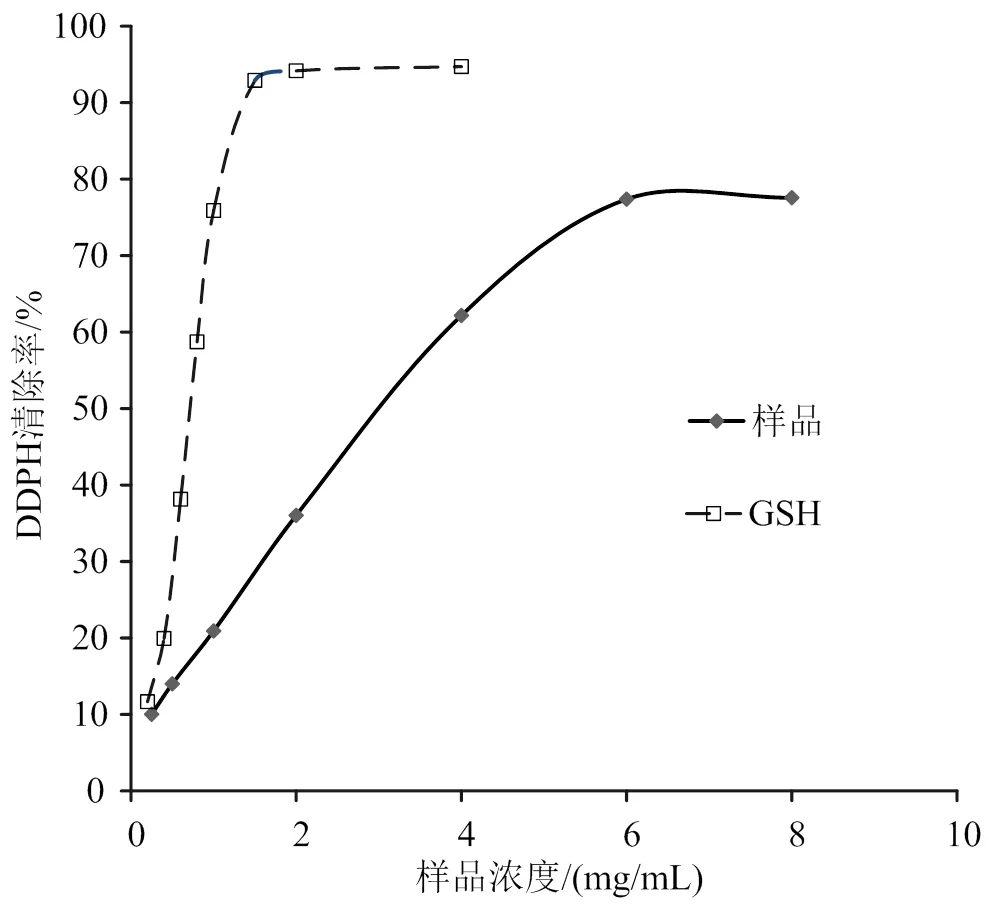
图6 酶解物和 GSH对 DPPH·清除效果
2.9 海参腺性酶解物中蛋白肽分子质量分布
肽标准品的凝胶色谱图如图7所示。根据细胞色素C、胰岛素、杆菌肽、GSSG、Gly-Gly-Gly洗脱出峰时间,由log(MW)与(洗脱时间)成线性关系,对应线性关系方程为log(MW)= -0.215 7+ 6.698 1,相关系数2= 0.960 4。
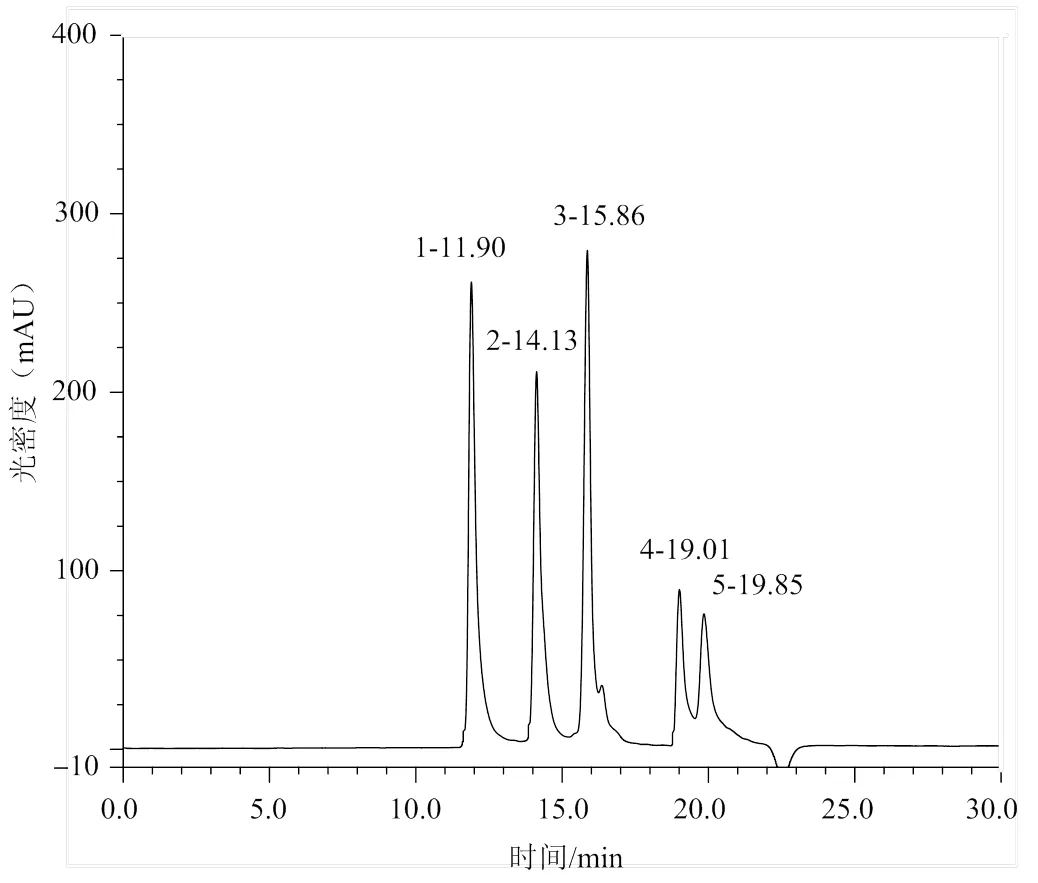
图7 标准品凝胶柱(TSKgel G2000SWXL)色谱
酶解物中蛋白肽分子量的分布如图8所示,由图可以看出,酶解物中蛋白肽的分子质量主要在500 u以下,达到93%,酶解反应趋于完全。现有文献报道[18],食物中蛋白质经过特定酶水解获得分子质量在2 ku以下的蛋白肽可以直接进入小肠被吸收,从而提高了胃肠对多肽和氨基酸的吸收速率。袁坤山等[19]利用木瓜蛋白酶酶解糙刺参内脏,酶解产物的分子质量在500 u以下的组分所占多肽比例为80.00%,所得糙刺参内脏蛋白酶解物具有较高抗氧化活性,其Vc抗氧化活性当量值为44.95 mg/g。
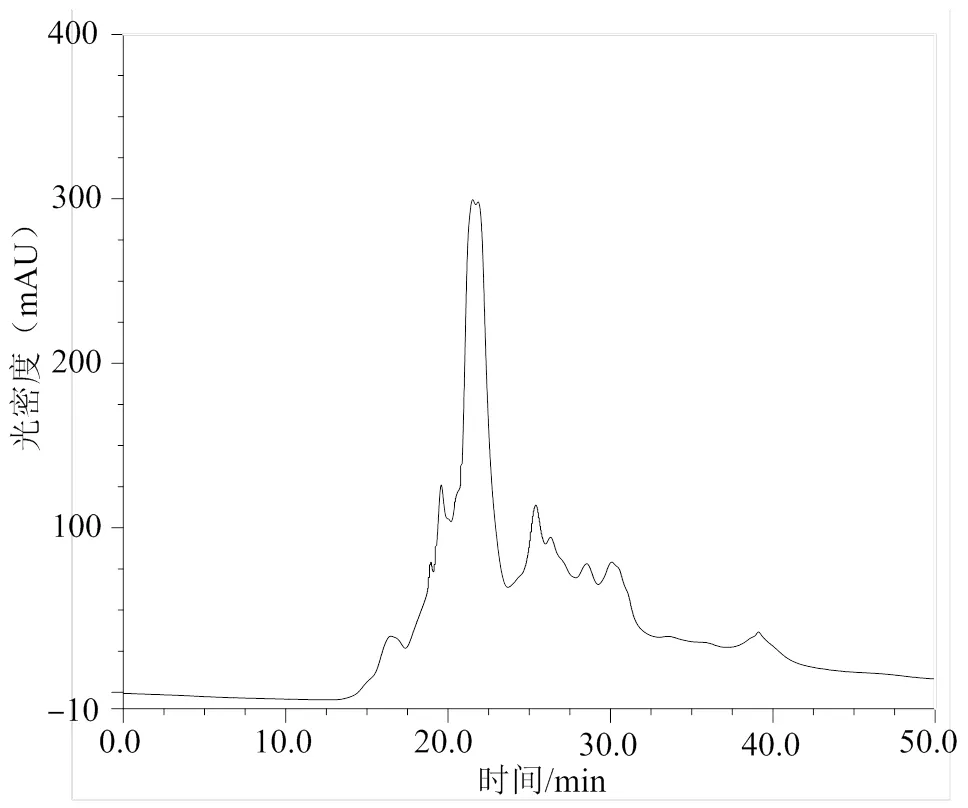
图8 海参性腺酶解产物中蛋白肽的分子质量分布
3 结论
本研究利用福建省养殖的海参性腺为原料,以水解度和DPPH 自由基清除率为指标,综合考虑蛋白质水解程度和酶解物抗氧化活性,确定木瓜蛋白酶为水解用酶。以水解度为指标,通过单因素实验和响应面设计分析优化木瓜蛋白酶酶解海参性腺工艺条件:料液比为1∶40,加酶量3 000 U/g,酶解时间14 h,酶解温度55 ℃,pH 7.0,此条件下海参性腺最大水解度为34%。在体外抗氧化活性研究中,酶解产物具有较高清除 DPPH 自由基和羟自由基能力,其中清除DPPH自由基和羟自由基的IC50值分别为 3.39、5.83 mg /mL。本方法保留了海参性腺中多重活性成分,提高了养殖海参的利用价值,对福建省海参产业开发具有一定参考价值。
[1] 韦豪华, 张红玲, 李兴太. 海参化学成分及生物活性研究进展[J]. 食品安全质量检测学报, 2017, 8(6): 2054-2061.
[2] 宋玉昆, 徐晟, 杨洋, 等. 海参肠脂质的提取及组成研究[J]. 中国食品学报, 2018,18(2): 148-153.
[3] GRAUSO L, YEGDANEH A, SHARIFI M, et al. Molecular networking-based analysis of cytotoxic saponins from sea cucumberMarine drugs, 2019, 17(2): 86-92.
[4] 郑烨, 邵丽华. 济南市售海参、鲍鱼中元素含量调查及营养价值评价[J]. 中国城乡企业卫生, 2018, 33(1): 22-25.
[5] 王婷, 刘京熙, 张健, 等. 海参精多糖提取工艺优化及其体外抗肿瘤活性[J]. 食品工业科技, 2016, 37(17): 68-74.
[6] 何传波, 魏好程, 熊何健, 等. 海参内脏酶解产物抗氧化和抗疲劳活性[J]. 食品科学, 2017, 38(21): 201-206.
[7] 赵玲, 耿晓晓, 刘淇, 等. 海参水煮液酶解多肽的抗氧化活性[J]. 渔业科学进展, 2013, 34(5): 69-73.
[8] 杨佳洪, 黄义松, 魏好程, 等. 海参内脏酶解工艺条件的优化[J]. 食品工业科技, 2017, 38(3): 180-185.
[9] 岑万, 林君如, 钟佳泽, 等. 响应面法优化海参肠酶解工艺的研究[J]. 福建轻纺, 2019 (7): 24-29.
[10] 杨文博, 张英华. 蛋白质水解度的测定方法研究[J]. 中国调味品, 2014, 39(3): 88-90.
[11] 王姣, 魏好程, 何传波,等.鲍内脏多糖的抗氧化活性[J]. 食品科学, 2017, 38(15): 115-121.
[12] HU F, CI A T, WANG H, et al. Identification and hydrolysis kinetic of a novel antioxidant peptide from pecan meal using Alcalase[J]. Food Chemistry, 2018, 261 (4): 301-310.
[13] YAN M Y, TAO H T, QIN S. Effect of enzyme type on the antioxidant activities and functional properties of enzymatic hydrolysates from sea cucumber () viscera[J]. Journal of Aquatic Food Product Technology, 2016, 25(6): 940-952.
[14] AUWAL S M, ZAREI M, ABDULHAMID A, et al. Optimization of bromelain-aided production of angiotensin I-converting enzyme inhibitory hydrolysates from stone fish using response surface methodology[J]. Marine Drugs, 2017, 15(4): 104.
[15] LI Y N, KONG X, CHEN J W, et al. Characteristics of the copper, zinc superoxide dismutase of a hadal sea cucumber (sp.) from the[J]. Marine Drugs, 2018, 16(5): 169.
[16] BRIONES-LABARCA V, GIOVAGNOLI-VICUÑA C, CAÑAS-SARAZÚA R. Optimization of extraction yield, flavonoids and lycopene from tomato pulp by high hydrostatic pressure-assisted extraction[J]. Food Chemistry, 2019, 278(4): 751-759.
[17] LI Y, LI J, LIN S J, et al. Preparation of antioxidant peptide by microwave- assisted hydrolysis of collagen and its protective effect against H2O2-induced damage of RAW264.7cells[J]. Marine Drugs, 2019, 17(11): 642.
[18] 杨东达, 秦洪, 黄雅燕, 等. 海参内脏酶解制备海参肽工艺[J]. 华侨大学学报(自然科学版), 2017,38(4): 531-536.
[19] 袁坤山, 郑艺, 于跃芹, 等. 响应面法优化糙刺参内脏团制备抗氧化肽的酶解工艺[J]. 食品科技, 2014,39(8): 225-231.
Enzymatic Hydrolysis and Antioxidant Activity of Sea Cucumber Gonad
WU Guo-hong1,XIONG He-jian1,LI Lu2
(1.,,361021,;2.,435100,)
【】Enzymatic hydrolysis of sea cucumber gonads and analysis its free radical scavenging activity in vitro. 【】An exogenous protease hydrolysis process was used to prepare the enzymolysis product. The enzymolysis effect was compared and analyzed, and its ability to scavenge DPPH free radicals and hydroxyl free radicals in vitro was investigated.【】We have dentified papain as an enzyme for hydrolysis. The response surface optimization experiment was used to determine the conditions of enzymolysis: the enzymolysis time was 14 h. The concentration of enzyme used was 3000 U/g, and the material-liquid ratio was 1∶40. The sea cucumber enzymatic hydrolysate obtained is in a powdery form after centrifuge concentration and drying after the enzyme was inactivated. The content of its main components were protein-peptide 48.4%, minerals 16.8%, crude fat 12.4%, moisture 9.8%. The IC50values of the enzymolysis products to scavenge DPPH free radicals and hydroxyl free radicals were 3.39 and 5.83 mg/mL, respectively. 【】The antioxidant activity of the sea cucumber gonad hydrolysate was good.
sea cucumber gonad; protein peptide; protein hydrolysis; antioxidant
TS254.1
A
1673-9159(2020)05-0105-07
10.3969/j.issn.1673-9159.2020.05.013
2020-01-02
福建省中青年教师教育科研项目(JT180287);厦门市科技计划项目(3502Z20153014); 国家海洋局海洋公益性行业科研专项(201405016)
吴国宏(1977-),男,实验师,研究方向为食品科学。E-mail:stormwgh@sohu.com
熊何健(1968-),男,研究员,研究方向为食品科学。E-mail:hjxiong@jmu.edu.cn
吴国宏,熊何健,李露. 海参性腺酶解物制备及其体外清除自由基活性测定[J].广东海洋大学学报,2020,40(5):105-111.
(责任编辑:刘岭)
