金枪鱼精巢鱼精蛋白制备及活性评价
2020-07-24杨绣荣邬华威
王 斌,杨绣荣,邬华威,2,何 宇
金枪鱼精巢鱼精蛋白制备及活性评价
王 斌1,杨绣荣1,邬华威1,2,何 宇1
(1. 浙江海洋大学食品与医药学院,舟山 316004;2. 宁波今日食品有限公司,宁波 315502)
【】建立并优化金枪鱼精巢中鱼精蛋白的制备方法,并研究其肝素拮抗效应。通过单因素和响应面试验,优化金枪鱼鱼精蛋白的提取工艺,采用羧甲基-琼脂糖凝胶CL-6B(CM Sephaorse CL-6B)离子交换层析对金枪鱼鱼精蛋白粗品进行纯化,并通过坂口反应、Tricine-十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳、氨基酸分析和肝素结合力-滴定法测定样品纯度和效价。确定金枪鱼鱼精蛋白的提取最佳工艺条件为提取温度36 ℃、硫酸浓度0.4 mol/L、液料比为6∶1、提取时间65 min,在此条件下得率为12.51% ± 1.2%。采用CM Sephaorse CL-6B离子交换层析对金枪鱼鱼精蛋白粗品进行纯化,获得Ⅰ、Ⅱ、Ⅲ 3个组分。坂口反应显示组分Ⅲ呈现阳性反应,Tricine-SDS-PAGE电泳表明其分子质量为6.5~21.1 ku,氨基酸质量分数为76.90% ± 0.37%,碱性氨基酸质量分数为39.00% ± 0.27%,精氨酸质量分数为25.86% ± 0.32%,肝素结合力-滴定法测定结果显示组分Ⅲ的效价约为标品鱼精蛋白的2/3。以上结果证明组分Ⅲ为目标蛋白,即金枪鱼鱼精蛋白。
金枪鱼;精巢;鱼精蛋白;活性
金枪鱼广泛分布于热带和温带水域,年捕获量超过600万t,占公海渔业总产量70%以上,是世界远洋渔业的重要作业鱼种之一[1-2]。商业金枪鱼品种主要包括蓝鳍金枪鱼()、黄鳍金枪鱼()、鲣()、长鳍金枪鱼()、大眼金枪鱼()和马苏金枪鱼()6种[3]。
金枪鱼是水产类罐头生产的重要原料,在国际罐头贸易中扮演重要角色[3]。鲣鱼占金枪鱼总捕获量的58%,在加工成罐头过程中,产生鱼骨、鱼皮、内脏等超过鱼体总质量50%的下脚料,主要用于生产鱼粉、宠物食品和鱼饲料等,未充分体现出金枪鱼的经济价值[4-7]。研究表明金枪鱼下脚料中富含有大量活性蛋白、磷脂、不饱和脂肪酸和钙质等活性物质[8],是制备胶原蛋白、鱼油、磷脂和活性肽的优质原料[9-12]。
精巢组织是金枪鱼加工下脚料的主要组成之一,约占鱼体质量的7%[13]。精巢组织中含有的碱性蛋白——鱼精蛋白,在医学领域经常被用来作为肝素拮抗剂和注射胰岛素的载体,在食品加工过程中主要被用作天然防腐剂,具有较高经济价值[13]。但是,利用金枪鱼精巢制备鱼精蛋白的研究尚未见报道。因此,本研究在测定金枪鱼鱼精营养成分基础上,建立了鱼精蛋白的制备工艺,为金枪鱼精巢的高效利用提供参考数据。
1 材料与方法
1.1 材料与处理
冷冻金枪鱼()解冻,切割,取出精巢,-20 ℃冰冻24 h,装于密封泡沫盒,4 h内运至试验室,-20 ℃储存。试验前,样品解冻,除杂,纯水洗涤,沥干,部分样品37 ℃恒温干燥箱烘至恒重,研磨成粉末,测定常规营养成分。
1.2 试验方法
1.2.1 常规营养成分的测定方法 粗蛋白、脂肪和灰分分别参照GB 5009.5-2016、GB 5009.6-2016和5009.4-2016方法进行测定[14],核酸含量采用定磷法测定[15]。
1.2.2 氨基酸组成与含量测定 参照王继隆等[16]方法测定样品氨基酸组成与含量。
1.2.3 鱼精蛋白提取 参考刘燕妮[13]方法提取金枪鱼精巢鱼精蛋白。金枪鱼精巢室温解冻、匀浆后,用4倍体积的乙酸乙酯浸泡,间歇性搅拌24 h后,过滤烘干,最后粉碎。称取10 g金枪鱼精巢粉末,置于100 mL烧杯中,加入100 mL 0.14 mol/L NaCl溶液,均质匀浆1 min,于0 ℃下搅拌20 min,静置10 min后,4 000 r/min低温离心10 min,弃去上清液。在沉淀物中,按设计的硫酸浓度、提取温度、液料比和提取时间进行试验,提取液于4 000 r/min低温离心10 min,上清液用3倍体积的4 ℃、体积分数95%乙醇,冰浴下静置30 min,于0 ℃、4 000 r/min离心15 min,取沉淀用丙酮洗涤2次,冷冻干燥,得鱼精蛋白粗品。用考马斯亮蓝G250染色法测定蛋白含量,鱼精蛋白得率计算公式如下:
鱼精蛋白得率 = 蛋白含量/精巢重量 × 100%
1.2.3.1 单因素试验优化鱼精蛋白提取工艺 硫酸浓度对鱼精蛋白得率的影响:在液料比(mL/g)3∶1、温度0 ℃、提取时间1 h的条件下,考察硫酸浓度(0.2、0.4、0.6、0.8、1.0、1.2 mol/L)对鱼精蛋白得率的影响。
液料比对鱼精蛋白得率的影响:在硫酸浓度为0.4 mol/L、温度0 ℃、提取时间1 h的条件下,考察液料比(3∶1、4∶1、5∶1、6∶1、7∶1、8∶1)对鱼精蛋白得率的影响。
提取时间对鱼精蛋白得率的影响:在硫酸浓度为0.4 mol/L、浸提温度0 ℃、液料比6∶1的条件下提取,考察提取时间(10、15、30、60、90、120 min)对鱼精蛋白得率的影响。
提取温度对鱼精蛋白得率的影响:在硫酸浓度为0.4 mol/L、液料比6∶1、提取时间30 min的条件下提取,考察提取温度(0、15、25、35、45、55、60 ℃)对鱼精蛋白得率的影响。
1.2.3.2 响应面法优化鱼精蛋白提取工艺 在单因素试验得到的优化条件的基础上,运用Design Expert 8.0.6.1软件按照Box-Behnken原理进行响应面试验设计(表1),优化鱼精蛋白提取工艺。
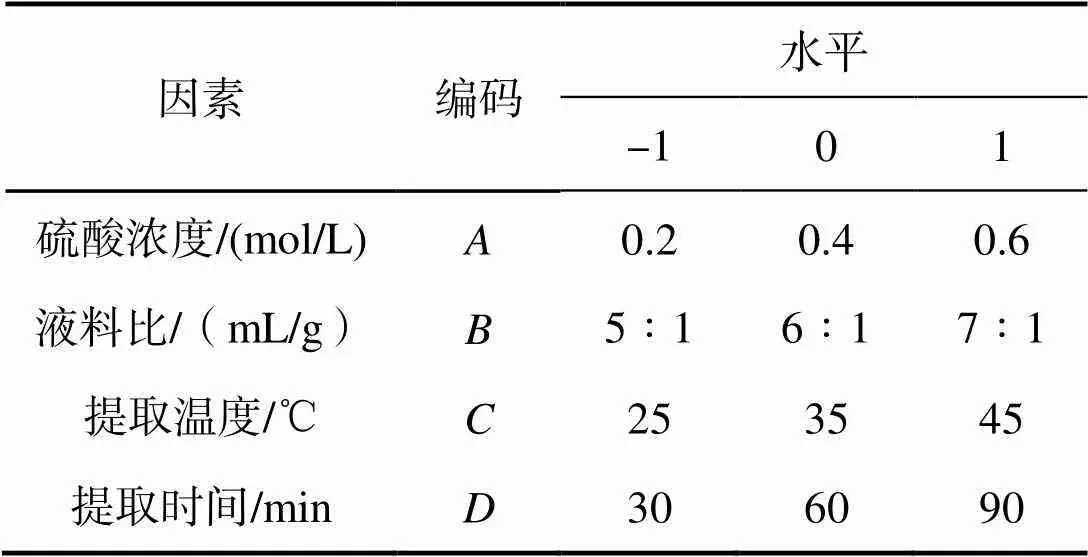
表1 Box-Behnken 设计的因素编码和水平
1.2.4 鱼精蛋白的纯化 将100 mL羧甲基-琼脂糖凝胶CL-6B(CM Sephaorse CL-6B)摇匀,后倒入250 mL烧杯中,加100 mL超纯水,搅拌均匀,抽滤去除液体,加200 mL 0.5 mol/L NaOH溶液,浸泡30 min,抽滤去除液体,用纯水洗至中性。将预处理过的CM Sephaorse CL-6B装入层析柱(直径 1.0 cm,高30 cm)至柱体积约30 mL。用25 mmol/L CH3COOH-CH3COONa缓冲液平衡3个柱体积。取2 mL 20 mg/mL鱼精蛋白溶液注入层析柱,220 nm检测,流速为2 mL/min,CH3COOH- CH3COONa缓冲液洗至检测仪记录线回到基线后,按照4 mL/管收集,共收集27管。对其以0.8~2.0 mol/L NaCl溶液线性梯度洗脱(1 ~ 7号管,0.8 mol/L; 8 ~ 16号管,1.0 mol/L; 17 ~ 27号管,2.0 mol/L),按色谱峰合并样品,透析24 h脱盐,冻干、备用。实验重复3次,计算各色谱峰样品的得率。
1.2.4 金枪鱼鱼精蛋白粗品鉴定
1.2.4.1 Tricine-SDS-PAGE电泳 参考历朝龙等[17]的方法进行Tricine-SDS- PAGE电泳试验。配制体积分数18%分离胶和5%浓缩胶,100 V电泳60 min,用考马司亮蓝R-250染色液染色15 min后,脱色液脱色并拍照。
1.2.4.2 坂口反应试验 参考翁连进等[18]的方法进行坂口反应试验。取1 mL 1 mg/mL的样品溶液于试管中,依次加入0.5 mL 质量分数10% NaOH、100 μL 体积分数0.2% α-萘酚乙醇溶液、50 μL质量分数10% NaClO溶液,振荡,观察溶液颜色,显红色为阳性反应。
1.2.4.3 肝素结合力-滴定法测定鱼精蛋白效价 参考郭玉东等[19]的方法进行肝素结合力-滴定试验方法。称取测定样品3份,用无菌水配制成0.05、0.10和0.15 mg/mL 3个质量浓度的待测液。取2 mL待测液,置于比色皿内并滴加肝素钠标准品溶液,于500 nm处测定吸光度值,加入一定体积90 U/mL肝素钠标准品溶液,直至比色皿种吸光度值陡增,停止滴加。记录滴定的肝素钠标准品溶液总体积,并按下列公式计算1 mg样品中和肝素的效价(U/mg):
样品效价=t× 90 /(s×s)
其中,t表示滴定的肝素钠标准品溶液总体积;s表示待测液体积;s表示测定样品的浓度。
2 结果与分析
2.1 金枪鱼精巢常规营养成分分析
金枪鱼精巢营养成分测定结果如表2所示:粗蛋白质量分数最高,为52.71% ± 0.42%,其次是核酸(27.59% ± 0.43%)、粗脂肪(10.36% ± 0.79%)和灰分(3.34% ± 0.14%)。

表2 金枪鱼卵巢常规营养成分(n = 3)
2.2 金枪鱼鱼精蛋白的提取工艺研究
2.2.1 单因素试验结果分析 图1(A)表明:随着硫酸浓度的提高,鱼精蛋白提取率逐渐升高,到达0.4 mol/L时,蛋白得率最大(< 0.05);而后,随着硫酸浓度增大,鱼精蛋白的结构破坏逐渐增强,得率开始下降。因此,最优硫酸摩尔浓度值为0.4 mol/L。
由图1(B)表明:鱼精蛋白提取率随液料比的增加而逐渐提高,6∶1时达到最大(< 0.05)。故确定最佳液料比为6∶1。
由图1(C)表明:鱼精蛋白提取率随时间延长而逐渐提高,1 h时提取率最高(> 0.05)。而后,由于时间延长,硫酸对鱼精蛋白的破坏作用增强,提取率略有下降。因此,选择最佳提取时间为1 h。
由图1(D)表明:温度对鱼精蛋白得率有一定影响,温度过低使得鱼精蛋白提取不充分,而温度过高造成硫酸对鱼精蛋白的破坏作用增强[15]。因此,最佳提取温度为35 ℃。
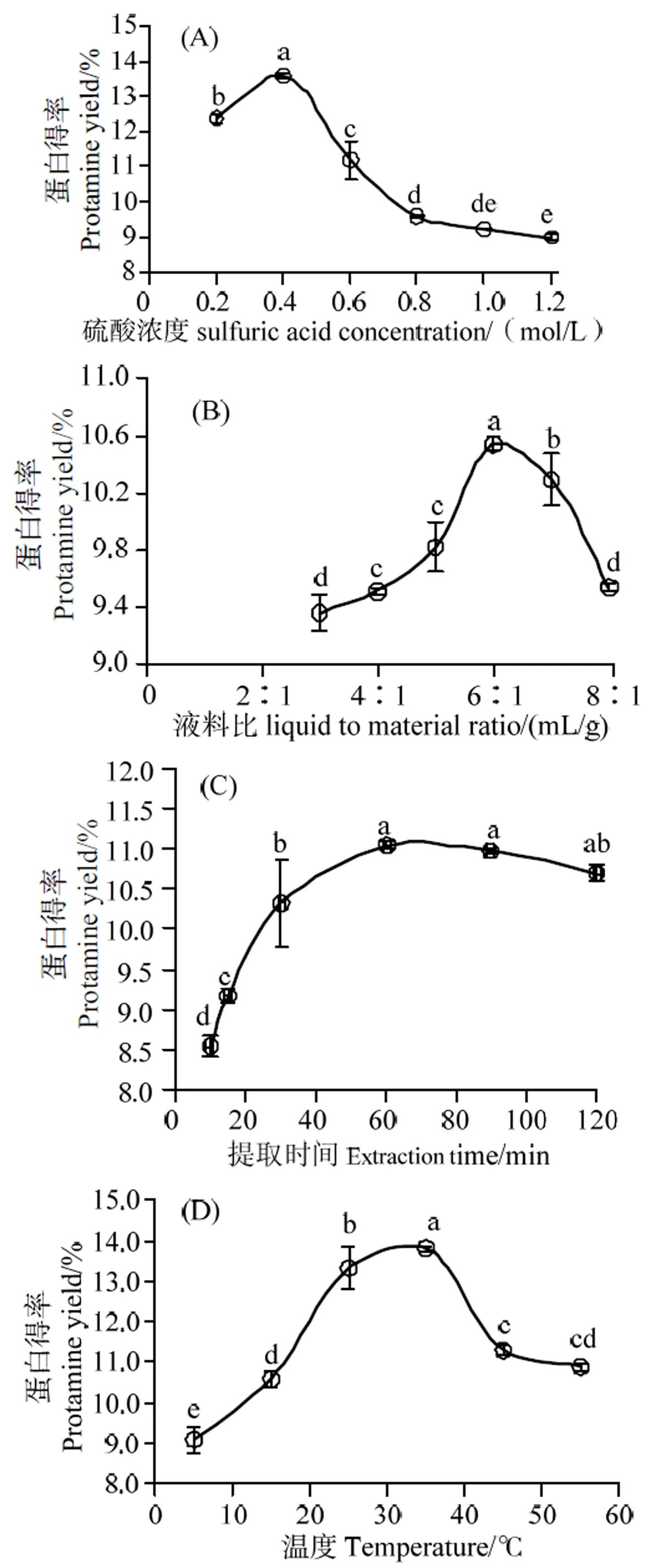
A,硫酸浓度;B,液料比;C,提取时间;D,温度
2.2.2 响应面试验结果分析
2.2.2.1 响应面二次模型方差及显著性分析 在单因素试验基础上,运用响应面设计考察硫酸浓度()、液料比()、提取温度()、提取时间()4个因素对鱼精蛋白得率的影响,结果如表3所示。用SPSS软件对数据进行回归分析,建立鱼精蛋白得率的回归方程为:鱼精蛋白得率= 13.676 + 0.17- 0.14+ 0.31+ 0.5+ 0.61- 0.12- 0.19- 0.57+ 0.12+ 0.14- 2.042- 1.192- 1.222- 1.132。
表3 Box-Benhnken试验设计及结果
如表4所示,在二次多元回归拟合方程的方差分析中,模型值< 0.000 1,说明此模型极显著;失拟项值为0.345 2 > 0.05,方程2为0.975 1,模型的变异系数CV为2.50%,信噪比为20.296且大于4,表明模型方程拟合度较好,该模型可用于蛋白得率预测。二次多元拟合模型的校正决定系数adj2等于0.950 3,表明约有95.03%的鱼精蛋白得率的变化可由此模型进行解释。、、、、2、2、2和2项为显著影响因素(< 0.05);各因素的值大小反映了其对试验响应值影响的重要性,值越大则影响越大。因此,鱼精蛋白得率受各因素影响程度大小为:提取温度>提取时间>硫酸浓度>液料比。

表4 响应面二次模型方差分析
注:**和*分别表示差异极显著(< 0.01)和显著(< 0.05)
Notes:** and * indicate the differences are very significant (< 0.01) and significant (< 0.05), respectively
2.2.2.2 响应面优化3D曲面图分析 通过响应面曲面图(图2)和等高线分析可以反映出两两因素交互作用,等高线的形状越接近于椭圆形,则两个因素交互作用越显著;反之,等高线的形状越接近于圆形,则两个因素交互作用越不显著;响应面曲面图为凸型,则说明蛋白得率存在极大值。图2结果表明:硫酸浓度()和液料比()、液料比()和提取温度()之间的两两交互作用对鱼精蛋白得率的影响显著;硫酸浓度()与提取温度()、硫酸浓度()和提取时间()、液料比()和提取时间()、提取温度()和提取时间()的交互作用不显著。该结果与表3结果相一致。
2.3.3 验证 响应面模型最后预测出的最优条件:提取时间为65.35 min、液料比为6.08∶1、硫酸浓度为0.42 mol/L、温度为36.59 ℃、蛋白得率13.12。结合实际操作,改为提取时间65 min、液料比6∶1、硫酸浓度0.42 mol/L、温度36 ℃。3次平行试验结果为12.51% ± 1.2%,与预测结果较接近,证明该模型可以较好地预测鱼精蛋白的得率。
2.4 CM Sephaorse CL-6B离子交换层析分离
从图3可以看出,金枪鱼鱼精蛋白粗品经过CM Sephaorse CL-6B分离得到Ⅰ、Ⅱ、Ⅲ共3个峰,得率分别为25.12%,34.26%和27.37%。
2.5 金枪鱼鱼精的鉴定与组成分析
鱼精蛋白含有丰富的精氨酸,碱性条件下精氨酸的胍基与次氯酸钠及α-萘酚形成红色物质,即坂口反应呈阳性。图4结果表明:0.1%精氨酸(图4A)、金枪鱼鱼精蛋白粗品(图4B)和组分Ⅲ(图4E)显示红色,具有显著的阳性反应。Tricine-SDS-PAGE电泳结果(图5)表明:鱼精蛋白组分Ⅲ有多个组分构成,分子质量处于6.5 ~ 21.1 ku之间。已有研究表明鱼精蛋白并非由单一组分构成,如虹鳟()鱼精蛋白由6种差别极小的成分组成[20],而鲭()鱼精蛋白由Ⅰ和Ⅱ两个组分组成,且组分Ⅰ中还包含3个成分[21]。图5结果表明:金枪鱼鱼精蛋白的组分要多于虹鳟和鲭,但具体结果组成需要更加细致的分析和鉴定方法进行确定。
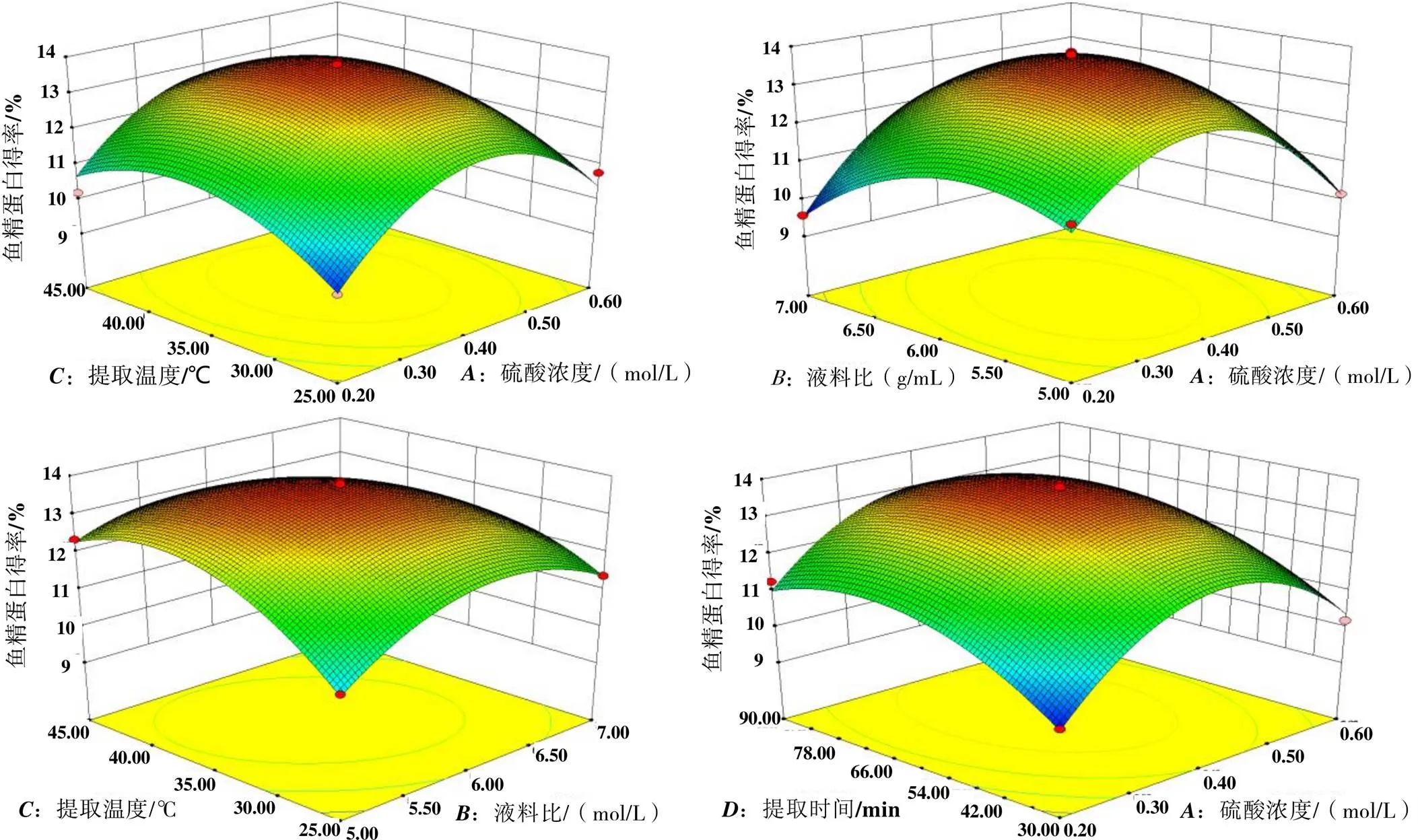

图3 金枪鱼鱼精蛋白粗品经CM Sephaorse CL-6B离子交换层析

(A)0.1%精氨酸;(B)鱼精蛋白粗品;(C)组分I;(D)组分II;(E)组分III。
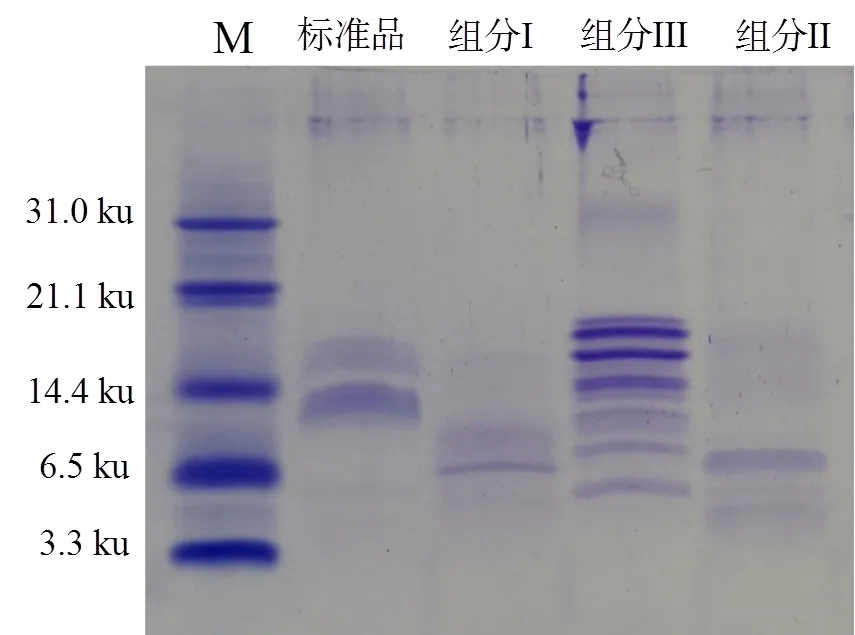
图5 纯化后金枪鱼鱼精蛋白Tricine-SDS-PAGE电泳图谱
经测定,金枪鱼鱼精蛋白组分III蛋白质量分数为77.63% ± 1.2%。为更加细致分析金枪鱼鱼精蛋白的性质,本实验对其氨基酸组成与含量进行了测定(表5),结果表明:组分III氨基酸质量分数为76.90% ± 0.37%,碱性氨基酸质量分数为38.99% ± 0.27%,约占所测氨基酸总量的1/3,主要包括精氨酸、赖氨酸、组氨酸3种碱性氨基酸,其分别占总氨基酸的25.86% ± 0.32%、11.30% ± 0.19%和1.83% ± 0.11%。金枪鱼鱼精蛋白组分III的碱性氨基酸含量与鲤()[22]和鲢()[23]鱼精蛋白相当,但低于鲑()[24]鱼精蛋白精氨酸含量。

表5 金枪鱼鱼精蛋白组分III的氨基酸组成
2.6 金枪鱼鱼精蛋白拮抗肝素作用分析
鱼精蛋白中的阳离子精氨酸基团和肝素中的阴离子基团通过1∶1的静电结合,在数秒内形成清晰可见的白色悬浮的中性鱼精蛋白-肝素盐聚合体,使抗凝血酶-肝素复合物分离,恢复原有的抗凝血酶活性[25]。肝素结合力-滴定法测定硫酸鱼精蛋白生物活性被各国药典广泛采用,其操作简单,试验误差小[26]。滴定结果表明:组分Ⅲ和对照品(标品)溶液均出现了不透明的白色浑浊物质,而组分Ⅰ和Ⅱ溶液未见明显白色悬浮颗粒。表6结果表明:组分Ⅲ的效价约为是对照品的2/3,而组分Ⅰ和Ⅱ并未与肝素结合。因此,结合坂口反应、Tricine-SDS-PAGE、氨基酸分析和肝素结合力-滴定结果,确定组分Ⅲ为金枪鱼鱼精蛋白。
鱼精蛋白药物(即硫酸盐鱼精蛋白)在逆转低分子肝素活性方面具有显著效果,被用作手术后肝素抗凝血活性的拮抗剂。金枪鱼加工过程中每年将产生数十万吨的精巢组织,尚未被有效利用。因此,以金枪鱼精巢为原料,开发鱼精蛋白药物,将显著增加金枪鱼精巢的附加值。

表6 肝素结合力-滴定法测定金枪鱼鱼精蛋白效价
注:上标字母相同表示无显著性差异(> 0.05)
Notes:Values with same superscripts indicate no significant difference (> 0.05)
3 结论
通过单因素和响应面试验确定金枪鱼鱼精蛋白的提取工艺最佳条件为:温度36 ℃、硫酸浓度0.4 mol/L、液料比6∶1、时间65 min。在此条件下,金枪鱼鱼精蛋白的得率最高,为12.51%±1.2%。鱼精蛋白粗品经CM Sephaorse CL-6B离子交换层析纯化,通过坂口反应、Tricine-SDS-PAGE电泳、氨基酸分析和肝素结合力-滴定试验,确定组分Ⅲ为金枪鱼鱼精蛋白,其分子质量为6.5 ~ 21.1 ku,碱性氨基酸质量分数为38.99%±0.27%,精氨酸占总氨基酸的25.86%±0.32%,其与肝素结合的效价约为对照品(标品)的2/3。
[1] PONS M, BRANCH T A, MELNYCHUK M C, et al. Effects of biological, economic and management factors on tuna and billfish stock status[J]. Fish and Fisheries, 2017, 18(1): 1-21.
[2] 张朋, 贺卯苏, 迟长凤, 等. 金枪鱼()碎肉蛋白降压肽的酶解制备及活性研究[J]. 海洋与湖沼, 2014, 45(5): 1092-1098.
[3] 苏阳, 章超桦, 曹文红, 等. 南海产3种金枪鱼普通肉、暗色肉营养成分分析与评价[J]. 广东海洋大学学报, 2015, 35(3): 87-93.
[4] 谭洪亮, 郁迪, 王斌, 等. 金枪鱼鱼骨胶原肽的制备及抗氧化活性研究[J]. 水产学报, 2014, 38(1): 143-148.
[5] 王斌, 邬华威, 李龙岩. 金枪鱼鱼卵营养成分分析及营养评价[J]. 广东海洋大学学报, 2020, 40(2): 111-116.
[6] QIU Y T, WANG Y M, YANG X R, et al. Gelatin and antioxidant peptides from gelatin hydrolysate of skipjack tuna () scales: preparation, identification and activity evaluation[J]. Marine Drugs, 2019, 17(10): 565.
[7] 韩姣姣, 李妍妍, 崔晨茜, 等. 金枪鱼胰脏酶解液对Ⅱ型糖尿病小鼠肾脏功能的调控机制[J]. 中国食品学报, 2018, 18(9): 33-40.
[8] YU D, CHI C F, WANG B, et al. Characterization of acid-and pepsin-soluble collagens from spines and skulls of skipjack tuna ()[J]. Chinese Journal of Natural Medicines, 2014, 12(9): 712-720.
[9] CHI C F, HU F Y, WANG B, et al. Influence of amino acid compositions and peptide profiles on antioxidant capacities of two protein hydrolysates from skipjack tuna () dark muscle[J]. Marine Drugs, 2015, 13(5): 2580-2601.
[10] SAIDI S M, DERATANI A, BELLEVILLE M, et al. Antioxidant properties of peptide fractions from tuna dark muscle protein by-product hydrolysate produced by membrane fractionation process[J]. Food Research International, 2014, 65(65): 329-336.
[11] HUANG S L, JAO C L, HO K P, et al. Dipeptidyl-peptidase IV inhibitory activity of peptides derived from tuna cooking juice hydrolysates[J]. Peptides, 2012, 35(1): 114-121.
[12] SEO J K, LEE M J, GO H J, et al. Antimicrobial function of the GAPDH-related antimicrobial peptide in the skin of skipjack tuna,[J]. Fish & Shellfish Immunology, 2014, 36(2): 571-581.
[13] 刘燕妮. 鱼精蛋白的制备、纯化及其絮凝和抑菌活性研究[D]. 青岛: 中国海洋大学, 2015.
[14] 中华人民共和国卫生部. 食品安全国家标准[S]. 北京: 中国标准出版社, 2016.
[15] 刘春雨, 刘玉慧, 李晓辉, 等. 蜈蚣粉发酵前后水溶性活性物质含量对比研究[J]. 湖南中医杂志, 2016, 32(11): 167-169.
[16] 王继隆, 刘伟, 李培伦, 等. 野生和养殖大麻哈鱼肌肉营养成分与品质评价[J]. 广东海洋大学学报, 2019, 39(2): 126-132.
[17] 历朝龙. 生物化学与分子生物学实验技术[M]. 浙江大学出版社, 2000: 69-76.
[18] 翁连进, 甘林火, 王士斌, 等. 氨对L-精氨酸UV法测定的影响[J]. 中国医药工业杂志, 2004, 35(9): 547-548.
[19] 郭玉东, 吴彬, 胡宇驰, 等. 硫酸鱼精蛋白生物测定标准研究[J]. 药物分析杂志, 2017, 37(8): 1541-1547.
[20] AIKEN J M, MCKENZIE D, ZHAO H Z, et al. Sequence homologtes in the protamine gene family of rainbow trout[J]. Nucleic Acids Research, 1983, 11(14): 4907-4922.
[21] OKAMOTO Y, OGAWA K, MOTOHIRO T, et al. Primary structure of scombrine γ, protamine isolated from spotted mackerel ()[J]. Journal of Biochemistry, 1993, 113(6): 658-664.
[22] 钟立人, 王南舟, 毋瑾超, 等.鲤鱼鱼精蛋白的提取及其抗菌活性的研究[J].浙江农业大学学报,1997, 23(S1):23-26.
[23] 刘光宪, 祝水兰, 何家林, 等. 鲢鱼鱼精蛋白超声波辅助提取工艺优化及其抗菌活性研究[J]. 食品与机械, 2017, 33(9): 151-155.
[24] AUSIO J, VAN HOLDE K E. The histones of the sperm ofinclude a novel, cysteine-containing H-1 histone[J]. Cell Differentiation, 1988, 23(3): 175-189.
[25] WEENING J J, GROND J, HOEDEMAEKER P J. Effect of increased glomerular permeability on the localization of immune aggregates and protamine-heparin aggregates in the rat[J]. Laboratory Investigation; a Journal of Technical Methods and Pathology, 1983, 49(5): 619-625.
[26] SAUTIERE P, GUSSE M, BRIAND G, et al. Primary structure of scylliorhinine S4, a protamine isolated from sperm nuclei of the dog-fish[J]. Biochimica et Biophysica Acta, 1984, 791(1): 82-86.
Preparation and Heparin Antagonistic Effect of Protamine from Skipjack Tuna () Milts
WANG Bin1, YANG Xiu-Rong1, WU Hua-Wei1,2, HE Yu1
(1.,,316004,; 2..,.,315502,)
【】To establish an extraction method of protamine from skipjack tuna () milts and to determine the antagonistic effect of protamine to heparin. 【】The extraction process of tuna protamine was optimized by a single factor and response surface methodology. The crude protamine was purified by CM Sephaorse CL-6B ion exchange chromatography with the Sakaguchi detection methods. Tricine-SDS-PAGE, amino acid analysis and heparin titration. 【】The optimum extraction conditions of tuna protamine were the temperature of 36 ℃, H2SO4concentration of 0.4 mol/L, liquid-to-solid ratio of 6∶1, and extraction time of 65 min. Under the optimum conditions, the yield of crude protamine was 12.51% ±1.2%. The crude protamine was fractionated into three components (I, II and III) by CM Sephaorse CL-6B column. Components III showed the positive reaction in Sakaguchi reaction, and its molecular weight was measured using Tricine-SDS-PAGE and ranged from 6.5 to 21.1 ku. Amino acid analysis indicated that the contents of total amino acids, alkaline amino acids and arginine were 76.90% ± 0.37%, 39.00% ± 0.27% and 25.86% ± 0.32%. Results from heparin binding force - titration assay indicated that component III was approximately two-thirds of standard protamine. Therefore, component Ⅲ was confirmed to be tuna protamine.
Skipjack tuna (); milt; protamine; activity
R151.3
A
1673-9159(2020)05-0064-08
10.3969/j.issn.1673-9159.2020.05.008
2020-04-09
国家自然科学基金(81673349);舟山市科技专项(2019c21015)
王斌(1977-),男,教授,研究方向为海洋生物资源综合利用。E-mail:wangbin4159@hotmail.com
王斌,杨绣荣,邬华威,等. 金枪鱼精巢鱼精蛋白制备及活性评价[J]. 广东海洋大学学报,2020,40(5):64-71.
(责任编辑:刘朏)
