尼罗罗非鱼Cullin-1基因克隆及表达
2020-07-24刘鑫潮简纪常
刘鑫潮,黄 瑜,简纪常
尼罗罗非鱼基因克隆及表达
刘鑫潮,黄 瑜,简纪常
(广东海洋大学水产学院,广东省水产经济动物病原生物学及流行病学重点实验室暨水产经济动物病害控制广东省普通高等学校重点实验室,广东 湛江 524088)
【】探究尼罗罗非鱼()()基因在尼罗罗非鱼抵抗病原细菌过程中的作用。从尼罗罗非鱼脾脏组织中克隆基因(记为),对其进行生物信息学分析,应用实时荧光定量PCR技术分析在健康鱼胸腺、鳃、肝、脾、肠道、头肾、脑、肌肉、皮肤、血液组织,以及经无乳链球菌刺激后病鱼脾、肠道、头肾中的表达。【】(GenBank登录号XM_003459470.5)编码区为2 331 bp,编码776个氨基酸,理论分子质量为89 ku,理论等电点为8.16。氨基酸序列分析显示,有1个高度保守的泛素样蛋白结构域Nedd8(ubiquitin-like domain),N′ 端有一个的信号肽序列。系统进化树分析表明,序列与伯氏拟丽鱼()相似性最高,为98.7%。qRT-PCR显示在健康尼罗罗非鱼各组织中均有表达,其中在头肾中表达量最高,其次是胸腺、脑、皮肤,在肠道中表达量最低。经无乳链球菌刺激后,表达量在脾脏和肠道中均显著上调,头肾、脾脏和肠道均在48 h表达量最大。参与尼罗罗非鱼抵抗无乳链球菌过程中的免疫应答。
尼罗罗非鱼;;基因表达;免疫应答;无乳链球菌
尼罗罗非鱼()有肉质细嫩、味道鲜美、营养价值高、环境适应能力强、生长速度快等特点,是我国南方重要的养殖品种[1]。然而随着养殖规模的不断扩大,近年来链球菌病频发,严重影响国内尼罗罗非鱼养殖业稳定发展[2-4]。罗非鱼免疫研究有助于抗菌药物及疫苗的开发,研究其免疫系统及免疫应答有重要意义。
()在蛋白质降解和泛素化中有重要作用,是SCF(SKP1-CUL1-Fbox)E3泛素连接酶复合物的重要组成部分,可介导泛素化蛋白参与细胞周期进程、信号转导和转录,在先天免疫应答中有调控作用。目前对该基因的研究报道主要是在植物的细胞周期调控[5]和人的肿瘤[6-7]、癌症[8]等方面,在尼罗罗非鱼中尚未见报道。本研究通过克隆尼罗罗非鱼基因(),分析该基因氨基酸序列,研究在健康和经无乳链球菌刺激的罗非鱼体内的表达模式,为更好地研究罗非鱼免疫机制提供理论基础和实验支持。
1 材料与方法
1.1 材料
健康尼罗罗非鱼购自湛江市某罗非鱼养殖场,在广东省水产经济动物病原生物学及流行病学重点实验室于(28±2) ℃条件下暂养1周,体质量约100 g。RNA提取试剂盒(TransZol Up Plus RNA Kit)、cDNA合成试剂盒、qPCR试剂盒购自北京全式金公司;克隆质粒 pMD18-T载体购自TaKaRa 公司(大连);RNAlater、DNA 胶回收纯化试剂盒购自Thermo公司;PCR引物由生工生物工程(上海)股份有限公司合成。克隆感受态细胞大肠杆菌() DH5α及无乳链球菌(ZQ0910)菌种由广东省水产经济动物病原生物学及流行病学重点实验室提供。
1.2 方法
1.2.1 罗非鱼总RNA提取和反转录 随机取健康罗非鱼,剖取适量脾脏组织于2.0 mL无RNA离心管,浸泡于1 mLTrizol后立刻使用研磨器研磨,按照TransZol Up Plus RNA Kit说明书提取罗非鱼脾脏总RNA。根据TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix说明书将提取的RNA反转录成cDNA。于-80℃下保存备用。
空白对照腹腔注射灭菌的0.1 mL磷酸盐缓冲溶液(PBS),实验组注射0.1 mL PBS重悬过的1×107cfu mL-1无乳链球菌。分别在注射后0、3、6、12、24、48、72、96 h各取罗非鱼3尾,取适量脾脏、头肾和肠道组织,放入2.0 mL无RNA离心管,浸泡于1 mL Trizol 后立即用研磨器研磨。同法提取RNA,并反转成cDNA。– 80 ℃下保存备用。
1.2.2 尼罗罗非鱼基因的克隆 根据本实验室所测得的罗非鱼转录组数据(https://www.ncbi. nlm.nih.gov/bioproject/PRJNA244908),利用Primer Premier 5.0分别设计克隆引物-F/R和荧光定量引物--436F/--532R(表1),以β-actin为内参。以罗非鱼脾脏cDNA为模板,利用引物F/R对罗非鱼基因编码序列片段进行扩增,反应体系(20 μL):Premix Taq 10 μL,ddH2O 7 μL,cDNA模板1 μL,F/R各1 μL。反应条件:94 ℃ 5 min、94 ℃ 30 s、52 ℃ 30 s、72 ℃ 2 min 20 s,33个循环;72 ℃ 10 min,4 ℃下保存。PCR产物经电泳检测、目的条带切胶回收后与载体pMD 18-T连接,连接产物转化至DH5α感受态细胞,涂布于含Amp+的LB琼脂平板,于37 ℃条件下培养12 h。挑取单菌落于含Amp+的LB液体培养基,于37 ℃、200 r/min条件下培养1 h,通过菌落PCR鉴定,阳性菌送生工生物(广州) 股份有限公司测序。
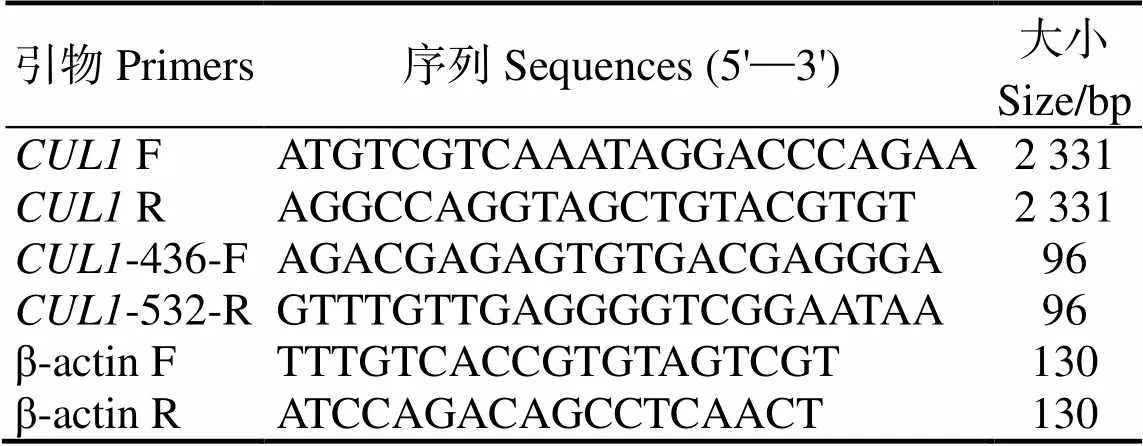
表1 引物
1.2.3基因序列分析 将阳性克隆的测序结果用DNAMAN软件拼接,从而获得On-CUL1编码序列和推导氨基酸序列,用ExPASy (http:// expasy.org/tools/) 进行蛋白质分析得到理论等电点预测、分子质量和亲水性参数等。用InterProScan程序(http://www.ebi.ac.uk/Tools/pfa/ iprscan/)预测结构域。用Soft Berry-Psite (http://lin-ux1.softberry. com/berry.phtmltopic=psite&group=pro-grams&sub group=prolocInterProscan)预测氨基酸基本功能位点分布。用PORTER (http://www. distill. ucd.ie/porter)、SWISSM-MODEL (http://swissmodel.expasy.org/11 intera-ctive)预测二级结构、三维结构。通过在线BLAST(http://blast.ncbi.nlm.nih.gov/Blast.cgi)对核苷酸序列和氨基酸序列进行同源性比对。用DNAMAN程序对On-CUL1氨基酸序列进行多重比对。通过MEGA6.0软件,用N-J法构建系统进化树。
1.2.4 qPCR验证罗非鱼CUL1组织分布 以β-actin为内参基因,cDNA为模版,通过ABI7500 Real-Time定量PCR仪(Bio-Rad,CA,USA)进行qRT-PCR。引物见表1。反应结束后应用ABI 7500 Software V2.0.5,采用2-△△Ct法计算在组织中的相对表达量。用SPSS 17.0软件进行统计分析。数据用单因素方差分析,表示为平均值±标准差,显著性水平= 0.05。
2 结果与分析
2.1 尼罗罗非鱼CUL1基因克隆与序列分析
克隆的(GenBank登录号:XM_003459470.5)全长为2 331 bp,可编码776个氨基酸(图1)。分析推导的氨基酸序列,CUL1蛋白理论分子质量为89 ku,等电点为8.16,其中亮氨酸(Leu)比例最高,为11.7%,其次为赖氨酸(Lys),为8.5%,其中带正电荷的氨基酸有103个,带负电荷的氨基酸有107个。
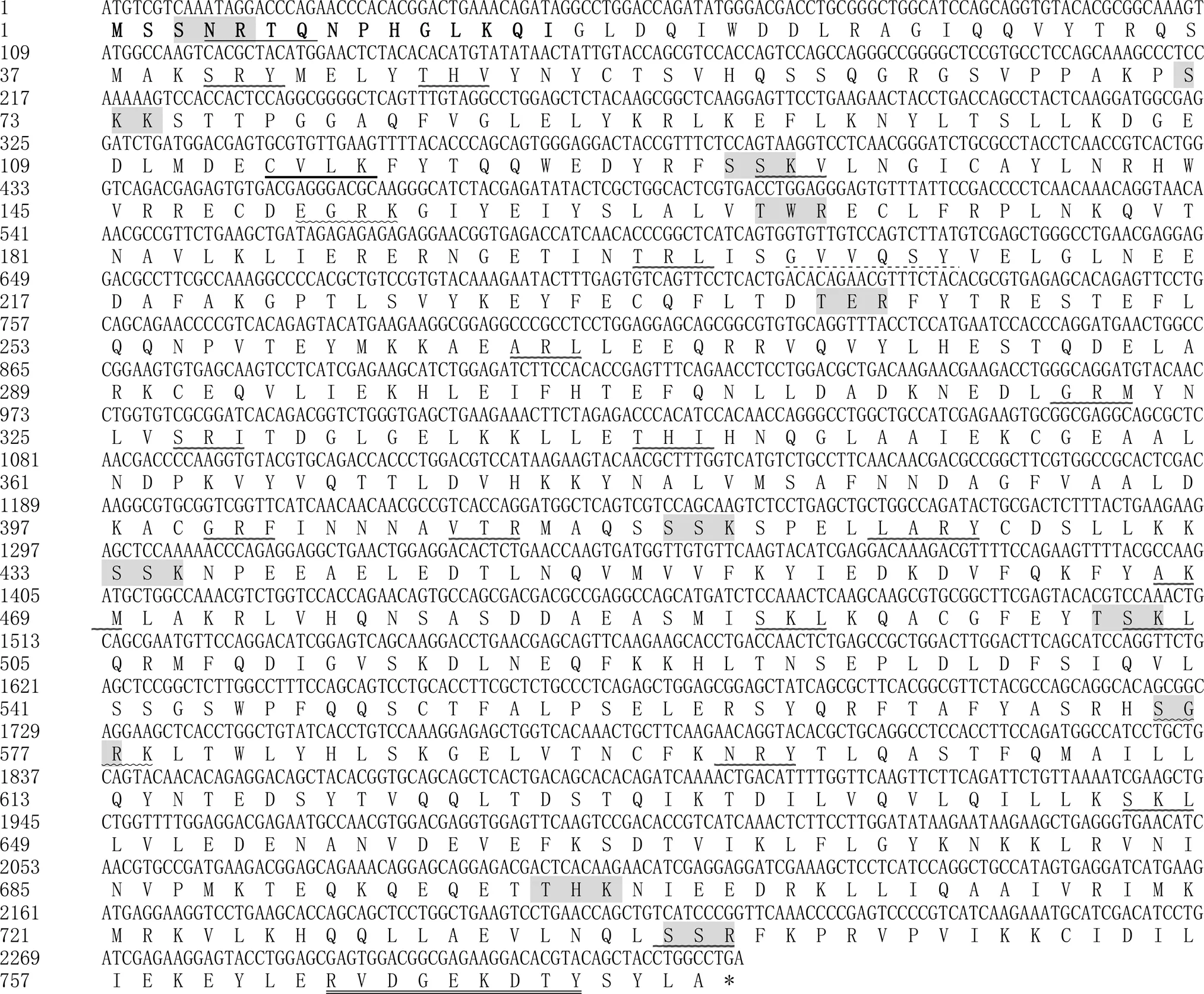
“”,N-糖基化位点;“”,蛋白激酶C磷酸化位点;“”,酪氨酸激酶磷酸化位点;“”,豆蔻酰化位点;“”,酰胺化位点;“”,异戊二烯基结合位点;“”,微体c端定位信号;“*”,终止子;加粗部分,信号肽。
经预测,CUL1序列无跨膜结构域(图2),有1个N-糖基化位点,11个蛋白激酶C磷酸化位点,1个酪氨酸激酶磷酸化位点,1个豆蔻酰化位点,2个酰胺化位点,1个异戊二烯基结合位点,17个微体c端定位信号;存在信号肽,1 ~ 20为信号肽区域,其中信号肽剪切位点在第20 ~ 21位氨基酸之间;该蛋白总平均亲水值为0.937,可能是疏水性蛋白。ProtScale分析表明,On-CUL1蛋白疏水性氨基酸含量较高,疏水区域较大,为疏水性蛋白,与理化分析结果一致。因此推测基因编码的蛋白质为疏水性蛋白。
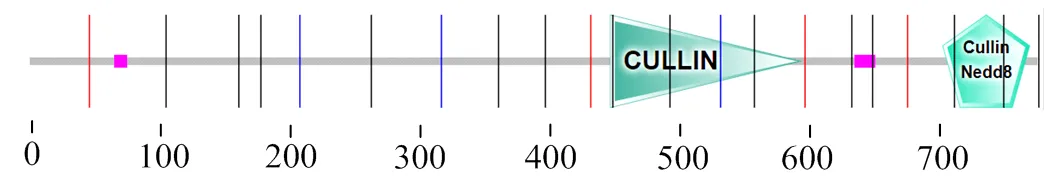
图2 On- CUL1氨基酸序列保守结构域分析
2.2 On-CUL1二级结构和三级结构
经预测,罗非鱼CUL1蛋白二级结构(图3)有无规则卷曲(24.23%)、α-螺旋(64.95%)、β-折叠(3.61%)、拓展链(7.22%)。图4为对On-CUL1蛋白同源建模结果,是以2hac.1.A为模版,分别用罗非鱼和人类的CUL1氨基酸序列构建的三维结构。对氨基酸三维建模佐证了二级结构的正确性。
2.3 罗非鱼CUL1序列同源比对及进化分析
克隆的与NCBI数据库中其他物种序列的比对结果表明,与伯氏朴丽鱼()同源性最高,为98.71%,与大黄鱼()的为94.25%,与金头鲷()的为94.21%。与非洲爪蟾()、伯氏朴丽鱼、大西洋鲑()、野猪()、人()、大杜鹃()的基因同源性比对结果(图5)显示,二者相似性均达到90%以上,分别为95.24%、98.71%、96.78%、95.68%、95.45%、95.88%,说明功能十分保守,进化变异极小。推测它们是同源序列氨基酸序列的系统进化树可见,罗非鱼与伯氏朴丽鱼及斑点叉尾鮰()聚为一支(图6),显示了较高的同源性。

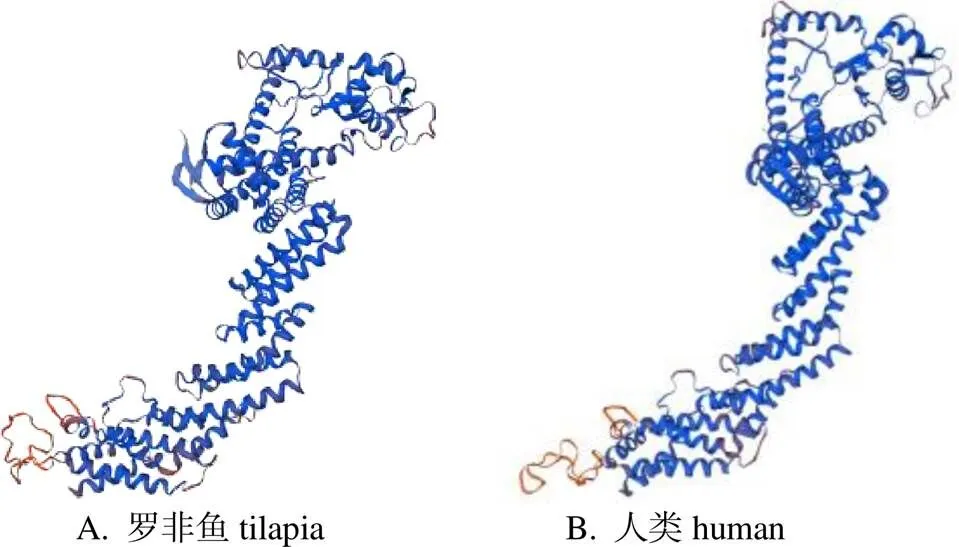
Fig. 4 Three-dimensional structure of CUL1 in tilapia and Homo sapiens

S. salar, XP_014045939.1; O. niloticus, XP_003459518.1; H. burtoni, XP_014185177.1; H. sapiens, NP_001357590.1; X. tropical, NP_001039255.1; S. scrofa, XP_020919247.1; C. canorus, XP_009566761.1;“.”为相同的氨基酸序列

图6 N-J 法构建CUL1氨基酸系统进化树
2.4 尼罗罗非鱼CUL1组织表达分析
图7显示,在10个组织中均可表达,在头肾中表达量最高,其次是胸腺、脑和皮肤,在肠道、肝脏和鳃中表达量较低。经无乳链球菌()刺激后,在头肾、脾脏和肠道中不同时间点的表达量差异较大(图8),但均在48 h达到表达高峰。
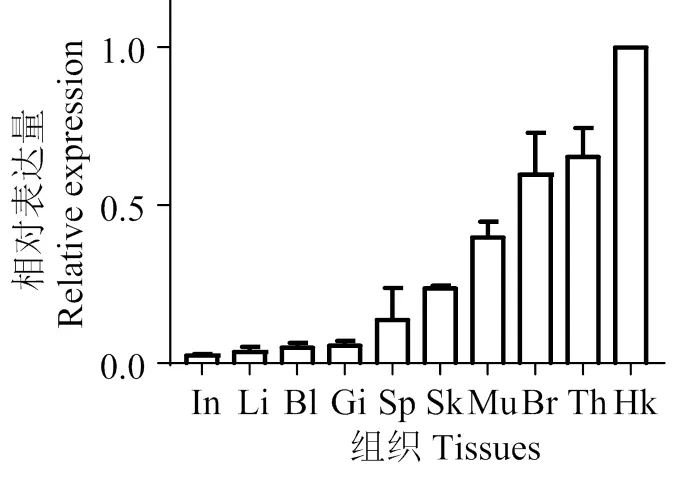
In,肠道;Li,肝;Bl,血液;Gi,鳃;Sp,脾;Sk,皮肤;Mu,肌肉;Br,脑;Th,胸腺;HK,头肾
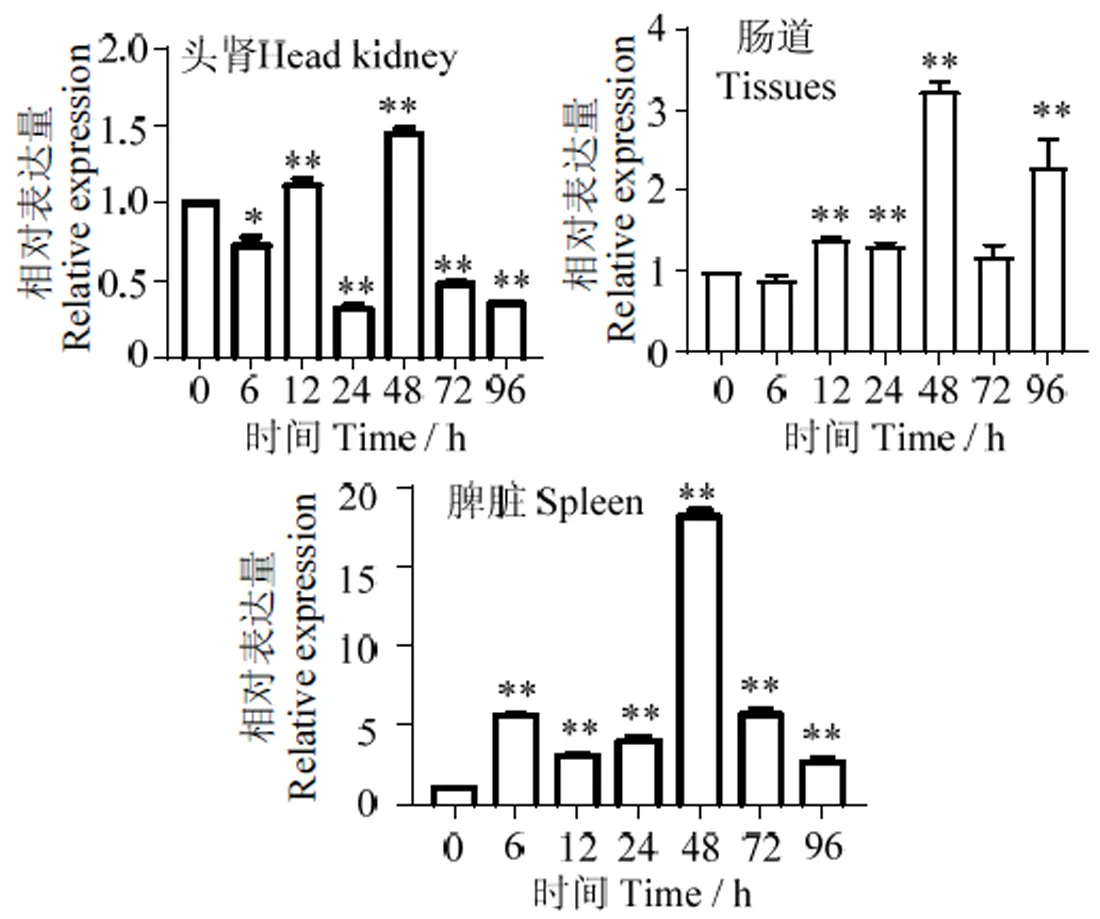
*,与0 h比较P<0.05;**,与0 h比较P<0.01
3 讨论
本研究克隆获得尼罗罗非鱼序列,其ORF为2 331 bp,编码776个氨基酸,与其他鱼类之间同源性较高,其中许多氨基酸和功能位点是保守的。推导得到编码CUL1的氨基酸序列,预测该序列含有一个信号肽区域和一个泛素样蛋白结构域,该结构域有1个蛋白激酶C (PKC) 磷酸化位点(氨基酸位点739 ~ 741),暗示该蛋白有完整的抗原结合位点,这在抗原信息传递过程中有重要作用[9]。经比对,与伯氏朴丽鱼的同源性为98.71%,该蛋白在系统进化树中与伯氏朴丽鱼聚为一支,而与其他物种亲缘关系较远。综上,CUL1蛋白在进化过程中保守性较高,在不同物种间可能有一定差异性。
人在不同组织中均可表达,主要是免疫系统、肌肉、肠道、脑和肺等中有较高的表达。目前尚未见在鱼类中表达的研究报道。本研究显示,在头肾中表达量最高,其次是胸腺、脑、皮肤、肌肉和脾脏,在肠道中表达量最低。头肾是罗非鱼的重要免疫器官之一,含有大量B和T淋巴细胞,可制造白细胞与毁灭陈旧红细胞[10-12]。胸腺亦为罗非鱼的重要免疫器官,是T细胞增殖分化的主要场所[13-14],在脑组织中的高量表达可能是因为无乳链球菌独特的感染方式,无乳链球菌可穿过血脑屏障感染鱼类脑部,被巨噬细胞吞噬后随血液进入颅腔,从而引发疾病[15-16]。皮肤和肠道是重要的黏膜免疫组织,罗非鱼皮肤是免疫保护的第一道防线,其表面可分泌黏液,分布有大量的T淋巴细胞及其他白细胞,从而有参与细胞免疫应答的基础[17-18]。而CUL1在尼罗罗非鱼中的研究尚浅,具体抵御病原细菌入侵的机制尚不清楚,需进一步研究。
经无乳链球菌刺激后,在头肾、肠道、脾脏组织中,表达总体上均呈先升后降的趋势,于48 h时达到高峰。在肠道组织中,于48 h时表达量达到高峰,其表达量约为对照组的3倍,在96 h时再次出现一个小高峰,可能与肠道免疫系统的二次免疫有关。在头肾组织中,在6、24 h时表达量下调,于48 h达到高峰,其表达量约为0 h时表达量的2倍。这可能与头肾这一重要的免疫器官在感染初期无乳链球菌可抑制免疫应答功能[19]相关。脾脏组织经无乳链球菌感染后呈大幅度上调趋势,于48 h时达到高峰,其表达量约为对照组0 h时的18倍以上。脾脏是无乳链球菌感染主要的感染器官[20],脾脏中的高水平表达说明罗非鱼脾脏在对机体的免疫保护上可能发挥着更大的作用[21]。以上结果均表明,在宿主免疫防御中起重要作用,为参与免疫的研究提供重要依据。
4 结论
本研究成功克隆,On-CUL1有1个高度保守的泛素样蛋白结构域CUL1 Nedd8,序列在不同物种间的保守性极高。在10种组织中均有表达,其中头肾、胸腺、脑中表达量较高。经无乳链球菌刺激后,肠道、头肾、脾脏的表达量呈时序性上调,在刺激48 h时,三组织中的表达量均最高,说明参与了尼罗罗非鱼抵御细菌侵染过程中的免疫应答反应。
[1] 黄家庆, 徐田祥. 小体积高密度网箱养殖尼罗罗非鱼技术[J]. 齐鲁渔业, 2004, 21(7): 17-19.
[2] 张新艳, 樊海平, 钟全福, 等. 罗非鱼无乳链球菌的分离、鉴定及致病性研究[J]. 水产学报, 2008, 32 (5): 772-779.
[3] 黄锦炉. 罗非鱼无乳链球菌病病原学、病理学及基因的原核表达研究[D]. 雅安:四川农业大学, 2012.
[4] 谢彩霞, 汪志文, 鲁义善, 等. 尼罗罗非鱼基因的克隆和mRNA表达分析[J]. 广东海洋大学学报, 2020, 40(1): 8-14.
[5] 周蕊, 余泽华. 泛素化途径与细胞周期的关系[J]. 生命科学, 2003, 15(3): 147-150.
[6] ZHOU Y H, XIA J Z, XU W H, et al. Cullin-1 promotes cell proliferation in human breast cancer and is related to diabetes[J]. International Journal of Biological Markers, 2016, 31(4):375-381.
[7] 雍红梅.基因在乳腺癌发生发展中功能及分子机制研究[D]. 徐州: 徐州医学院, 2012.
[8] WANG W, LIU Z H, QU P, et al. Knockdown of regulator of cullins-1 (ROC1) expression induces bladder cancer cell cycle arrest at the G2 phase and senescence[J]. PLoS One, 2013, 8(5):1-11.
[9] 汪志文, 张海艳, 黄瑜, 等. 尼罗罗非鱼基因的分子克隆与mRNA表达分析[J]. 基因组学与应用生物学, 2017, 36(1): 190-200.
[10] HANSEN J D, KAATTARI S L. The recombination activating gene 1 (RAG1) of rainbow trout (): cloning, expression, and phylogenetic analysis[J]. Immunogenetics, 1995, 42(3): 188-195.
[11] HANSEN J D, KAATTARI S L. The recombination activating gene 2 (RAG2) of the rainbow trout Oncorhynchus mykiss[J]. Immunogenetics, 1996, 44(3): 203-211.
[12] HANSEN J D, STRASSBURGER P, DU PASQUIER L. Conservation of a master hematopoietic switch gene during vertebrate evolution: isolation and characterization of Ikaros from teleost and amphibian species[J]. European Journal of Immunology, 1997, 27(11): 3049-3058.
[13] GAN Z, WANG B, ZHOU W, et al. Molecular and functional characterization of CD59 from Nile tilapia () involved in the immune response to[J]. Fish & Shellfish Immunology, 2015, 44(1): 50-59.
[14] CESTA M F. Normal structure, function, and histology of the spleen[J]. Toxicologic Pathology, 2006, 34(5): 455-465.
[15] SCHUCHAT A. Epidemiology of group B streptococcal disease in the United States: shifting paradigms[J]. Clinical Microbiology Reviews, 1998, 11(3): 497-513.
[16] ROBINSON J A, MEYER F P. Streptococcal fish pathogen[J]. Journal of Bacteriology, 1966, 92(2): 512-513.
[17] KOZONO Y, ABE R, KOZONO H, et al. Cross-linking CD21/CD35 or CD19 increases both B7-1 and B7-2 expression on murine splenic B cells[J]. Journal of Immunology, 1998, 160(4): 1565-1572.
[18] 罗晓春, 谢明权, 黄玮, 等. 鱼类粘膜免疫研究进展[J]. 水产学报, 2005, 29(3): 411-416.
[19] MERINO-CONTRERAS M L, GUZMAN-MURILLO M A, RUIZ-BUSTOS E , et al. Mucosal immune response of spotted sand bass(Steindachner, 1868) orally immunised with an extracellular lectin of[J]. Fish & Shellfish Immunology, 2001, 11(2): 115-126.
[20] 唐玫, 马广智, 徐军. 鱼类免疫学研究进展[J]. 免疫学杂志, 2002, 18(z1): 112-116.
[21] 樊博琳, 黎源, 汪志文, 等. 尼罗罗非鱼基因克隆及其组织表达分析[J]. 广东海洋大学学报, 2018, 38(6): 6-12.
Cloning and Tissue Expression Analysis of the Cullin-1 in Nile Tilapia()
LIU Xin-chao, HUANG Yu, JIAN Ji-chang
(,,524088,)
【】To explore the role of cullin-1 (CUL1) gene of the Nile tilapia () inthe defense of pathogenic bacteria. 【】The CUL1 gene (named) was cloned from the spleen of the Nile tilapia (), and bioinformatics analysis of the gene was performed, and the expression of On-in the thymus, gills, liver, spleen, intestine, head kidney, brain, muscle, skin, and blood tissues of healthy fish, and the spleen, intestine, and head kidney ofstimulated fish was analyzed by fluorescence quantitative PCR. 【】The coding region of On-CUL1 gene was 2 331 bp, and encoding a 776 amino acids protein with a theoretical molecular mass 89 ku, and isoelectric point 8.16. On-CUL1 had a highly conserved ubiquitin-like domain,Nedd8 (ubiquitin-like domain), and a signal peptide sequence at the Nterminal.showed the highest similarity with(98.7%).was expressed in all tissues of healthy Nile tilapia, with the highest expression in head kidney, followed by thymus, brain and skin, and the lowest expression in intestine.After it was stimulated by inactivated. The expression ofwas significantly up-regulated in the spleen and intestine. The expression levels in the body kidney, spleen and intestine peaked at 48 h. 【】was involved in the immune response of Nile tilapia against
;; gene expression; immune response;
Q78;Q959.483
A
1673-9159(2020)05-0027-07
10.3969/j.issn.1673-9159.2020.05.004
2020-03-06
国家自然科学基金(31572651);高校重大科研成果培育计划类项目(GDOU2013050309);广东省普通高校青年创新人才项目(230419083)
刘鑫潮(1996-),男,硕士,研究方向为水产经济动物病害控制。E-mail: 767322063@qq.co
简纪常,男,教授,研究方向为水产经济动物病害防治。E-mail: jianjc@gmail.com
黄瑜,男,博士,研究方向为水产经济动物病害防治。 E-mail: huangyu@gdou.edu.cn
刘鑫潮,黄瑜,简纪常. 尼罗罗非鱼Cullin-1基因克隆及表达[J]. 广东海洋大学学报,2020,40(5):27-33.
(责任编辑:刘庆颖)
