低氧胁迫对军曹鱼幼鱼抗氧化、免疫能力及能量代谢的影响
2020-07-24王维政曾泽乾黄建盛郭志雄李洪娟
王维政,曾泽乾,黄建盛,2,郭志雄,李洪娟,陈 刚,2
低氧胁迫对军曹鱼幼鱼抗氧化、免疫能力及能量代谢的影响
王维政1,曾泽乾1,黄建盛1,2,郭志雄1,李洪娟1,陈 刚1,2
(1. 广东海洋大学水产学院,广东 湛江 524088;2. 南方海洋科学与工程广东省实验室(湛江),广东 湛江 524025)
【】研究低氧胁迫对军曹鱼 () 幼鱼抗氧化、免疫能力和能量代谢的影响。幼鱼于 (2.98±0.40) mg/L的低溶氧条件下养殖1周,分别测定其肝脏和肌肉组织的抗氧化、免疫相关酶活力以及能量供应物质。低氧胁迫过程中,幼鱼肝脏组织超氧化物歧化酶 (SOD) 活力显著升高 (< 0.05) 后逐渐下降 (< 0.05),肌肉组织SOD活力呈波动上升趋势 (< 0.05),肝脏和肌肉组织谷胱甘肽过氧化物酶 (GPX) 活力和丙二醛 (MDA) 含量均显著升高 (< 0.05)后,呈逐渐下降趋势,肝脏组织过氧化氢酶(CAT) 先降(< 0.05) 后升至正常水平,肌肉组织CAT活力先升(< 0.05) 后呈下降趋势;肝脏组织碱性磷酸酶(AKP) 活力先降后升高(< 0.05),随后恢复至与对照组水平(> 0.05),肝脏酸性磷酸酶(ACP) 活力先显著上升(< 0.05),随后恢复至正常水平(> 0.05);肌肉组织和肝脏组织乳酸脱氢酶(LDH) 活力变化趋势一致,均为先显著升高(< 0.05),之后呈降低趋势;肝糖原在低氧胁迫后呈先下降(< 0.05),后恢复至对照组水平(> 0.05),肌糖原各时间点含量无显著性差异(> 0.05)。军曹鱼幼鱼在低氧胁迫后发生氧化损伤,刺激自身免疫系统,通过调整相关酶活力及能量代谢的方式提高其适应低氧的能力。
军曹鱼;低氧胁迫;抗氧化;免疫;能量代谢
近年来,随着气候变化和污染加剧,水体富营养化频频发生,水体缺氧问题日益严重,我国多个近岸海域均发现有缺氧或低氧现象[1]。水体溶氧对鱼类生长、发育、代谢、行为等有关键性作用[2-3]。鱼类暴露在低氧环境时,机体会产生大量的活性氧(ROS),如不及时消除,则诱导机体发生细胞凋亡、脂质氧化、组织损伤、DNA和蛋白质降解[4-5],造成氧化损伤。为此,多数鱼类长期以来已发展出各种策略以适应低氧环境,包括调节红细胞增殖、抑制红细胞凋亡、刺激血管生成等增加氧气输送和改变代谢效率、减少消耗能量的生物合成途径等减少机体耗氧量策略[6]。
军曹鱼() 又称海鲡、海龙鱼等,隶属鲈形目鲈亚目军曹鱼科军曹鱼属,主要分布于太平洋(东太平洋除外)、大西洋和印度洋等热带水域,我国沿海也有分布,为暖水性海洋鱼类[7]。其生长速度极快,营养丰富,抗病力强,有较高的经济价值,是海水网箱养殖中最具养殖前景的鱼类之一,且随着大规模种苗生产技术的成熟,逐渐成为我国南方海水养殖中最重要经济鱼类之一[8]。目前,关于军曹鱼的研究主要集中在生长、营养和代谢等方面,而低氧胁迫方面的研究报道较少,郭志雄等[9]和黄建盛等[10]分别研究了急性低氧胁迫对大规格军曹鱼幼鱼氧化应激、能量代谢、糖代谢和血液生化指标的影响,以及李洪娟等[11]研究了军曹鱼幼鱼对低氧-复氧后氧化应激和能量利用的响应,但这些研究均为急性低氧胁迫方面,而关于慢性低氧胁迫方面的研究还未见报道。笔者以低氧胁迫一周为条件,研究军曹鱼幼鱼在低氧胁迫下抗氧化、免疫能力及能量代谢的变化情况,为军曹鱼的低氧适应机制以及耐低氧新品种选育提供科学依据。
1 材料与方法
1.1 材料
军曹鱼为广东海洋大学东海岛海洋生物研究基地繁育的幼鱼。幼鱼运回实验室后,于循环水养殖系统(自行设计)暂养1周。养殖系统主要包括养殖水槽模块、颗粒物去除模块、氨氮去除模块、供气设备、回水管道等。其中,水槽规格为70 cm × 50 cm × 60 cm,单个水槽运行水体175 L,顶部一侧以PVC管进水,另一侧设溢水出水孔,24 h内水体经系统可交换12次(约90 L/h)。暂养期间水温(26±1)℃,盐度28 ~ 30,pH 7.8±0.2,持续充气,自然光周期,每天8:00、16:00各投喂1次,投喂1 h后及时清除残饵和粪便,实验前停饲1 d。
1.2 方法
1.2.1 实验设计 挑选体质健康、活力良好、体质量(12.52±1.32) g的军曹鱼幼鱼90尾,随机放入3个水槽,每个水槽30尾,进行低氧胁迫实验。关闭流水以及气石,用薄膜封盖水槽,在1 h内将水体溶氧自然降至接近3 mg/L,随后通过控制水流量及充气量维持该溶氧水平,调整3 h后开始计时,进行为期1周的低氧胁迫实验。实验期间用溶氧仪(台湾衡欣,AZ8403型) 实时监控溶氧水平,通过化学碘量法(GB7489-87) 校正溶氧仪读数,水体溶氧为(2.98±0.40) mg/L。其他环境条件及投喂方式与暂养一致。
1.2.2 样品采集 在低氧胁迫前(0 d)及胁迫1、4、7 d时取样,以胁迫前样品为对照组,每水槽每个时间点取鱼3尾,用100 mg/L MS-222海水溶液麻醉,逐尾剖取肝脏和肌肉组织,分别放入2 mL冻存管,迅速置于液氮中,置-80℃冰箱保存,待测。
1.2.3 酶活力与含量的测定 取军曹鱼肝脏、肌肉组织,分别按每克待测组织加入9 mL生理盐水的比例在冰水浴条件下用匀浆机制备成匀浆液,将匀浆液在4℃、2 000 r/min条件下离心10 min,取上清液分装于2 mL离心管,放入4 ℃冰箱保存,用于酶活力,蛋白质、肝糖原及肌糖原含量的测定。
超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPX)、酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、乳酸脱氢酶(LDH) 活力,丙二醛(MDA)、肝糖原、肌糖原、蛋白质含量均采用VICTOR NivoTM酶标仪(铂金埃尔默,美国,型号:HH359400031)测定,所用试剂盒购于南京建成生物科技有限公司。按照试剂盒说明书,SOD活力(U/mg) 采用羟胺法测定;CAT活力(U/mg) 采用钼酸铵法测定;GPX的活力(U/mg) 采用比色法测定;ACP或AKP的活力(金氏单位/g) 采用微板法测定;LDH活力(nmol/g) 采用微板法测定;MDA含量(nmol/mg) 的测定采用TBA法;糖原含量(mg/g) 采用比色法测定;蛋白质含量(g/L) 采用考马斯亮蓝法测定。所测指标分别重复3次。
1.3 数据分析
数据采用平均值±标准差表示,用SPSS 19.0对所得的实验数据进行单因素方差分析,不同时间点的数据进行Duncan氏多重比较,< 0.05时差异显著,< 0.01时差异极显著。
2 结果
2.1 低氧胁迫对军曹鱼幼鱼氧化应激指标的影响
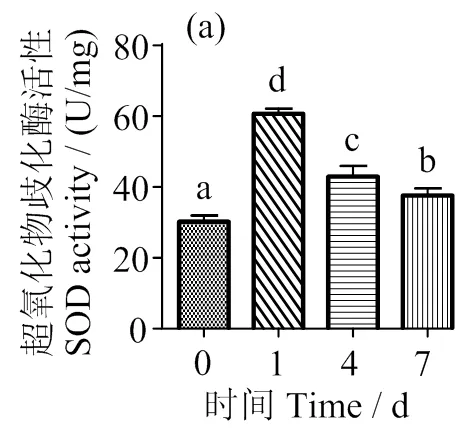
由图1a和c可知,随着胁迫时间的延长,肝脏SOD和GPX活力变化趋势一致,先升高后下降,且1 d时显著高于对照组(<0.05),CAT活力在1 d时显著下降(<0.05) (图1b),之后恢复至正常水平,MDA含量在1 d时极显著升高(<0.01),随后显著下降(< 0.05)(图1d)。
凡含一个相同字母表示组间差异不显著(> 0.05)
The data with a same letter indicate no significant difference between groups(> 0.05)
图1 低氧胁迫对军曹鱼幼鱼肝脏SOD、CAT、GPX及MAD活性的影响
Fig. 1 Effects of hypoxic on the activity of SOD, CAT and GPX and the content of malondialdehyde in liver of juvenile cobia
由图2a可知,随着胁迫时间的增加,肌肉SOD活力呈上升趋势,在1、4、7 d时活力均显著高于对照组(<0.05),CAT、GPX活力,MDA含量均呈先升后降的趋势,CAT在1、4 d时显著高于对照组(< 0.05) (图2b),GPX在1、4、7 d时均显著高于对照组(< 0.05)(图2c),MDA在1、4 d时显著升高(< 0.05),7 d时降至正常水平(图2d)。
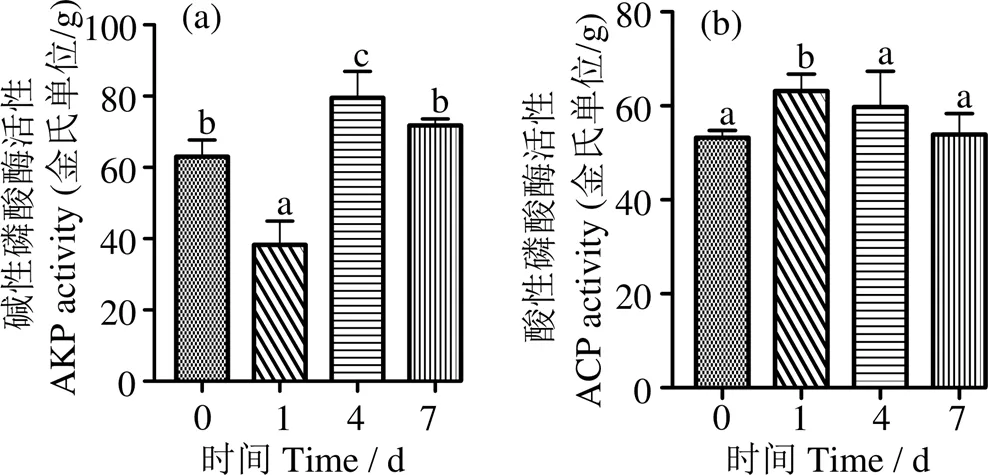
2.2 低氧胁迫对肝脏组织碱性磷酸酶和酸性磷酸酶活性的影响
由图3a可知,低氧胁迫1 d时,肝脏AKP活性显著下降,4 d时显著上升并高于对照组,随后在7 d时下降到对照组水平;肝脏ACP活性表现为先升高后下降,1 d时显著高于对照组(< 0.05),之后降至对照组水平(> 0.05) (图3b)。
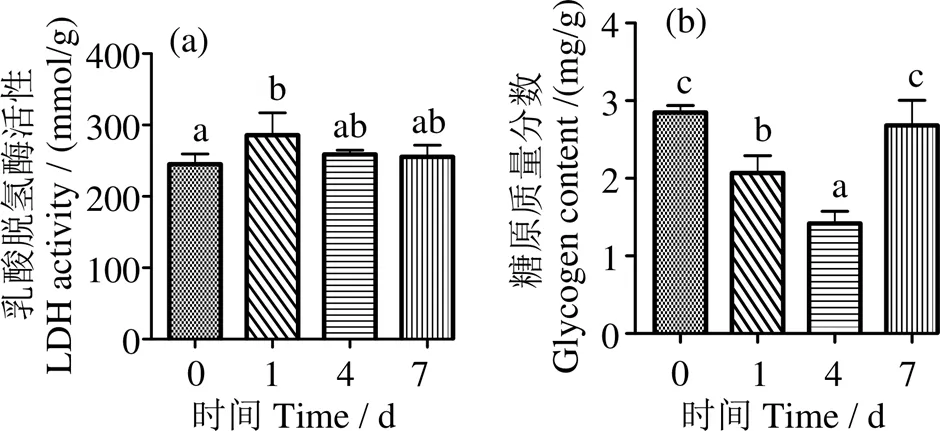
2.3 低氧胁迫对军曹鱼幼鱼能量代谢指标的影响
图4a显示,低氧胁迫后肝脏LDH活力在1 d时显著上升(< 0.05),随后下降,与对照组差异无统计学意义(> 0.05);肝糖原含量在1、4 d时显著下降并在4 d时最低(< 0.05),7 d时与对照组无显著差异(> 0.05) (图4b)。

凡含一个相同字母表示组间差异不显著(P > 0.05)
凡含一个相同字母表示组间差异不显著(P > 0.05)
凡含一个相同字母表示组间差异不显著(P > 0.05)
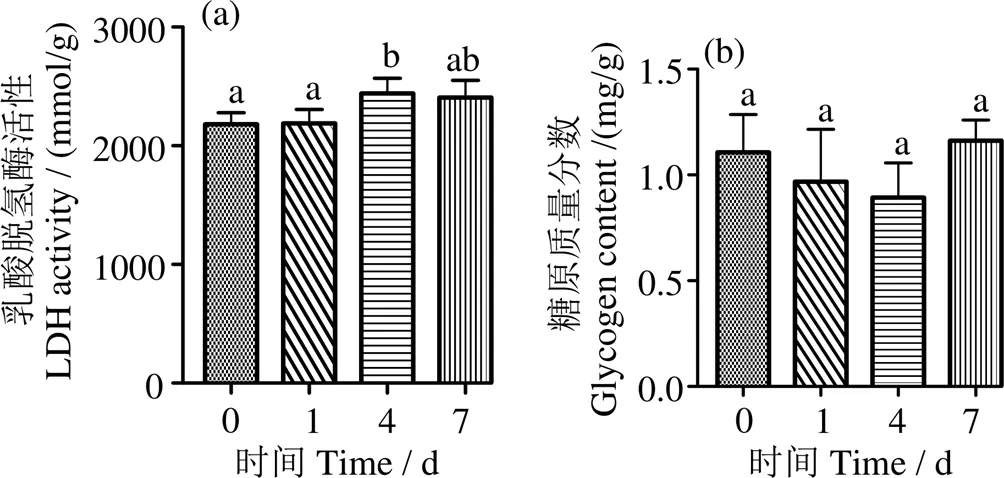
图5a显示,低氧胁迫4 d时肌肉LDH活力显著增大(< 0.05),其他时间点与对照组无显著性差异(> 0.05);低氧胁迫后,肌糖原含量平均值先降后升,但各时间点与对照组无显著性差异(> 0.05)(图5b)。
凡含一个相同字母表示组间差异不显著(P > 0.05)
3 讨论
3.1 低氧胁迫对军曹鱼幼鱼氧化应激的影响
在常氧状态下,ROS的产生和消除处于一种动态平衡,当鱼类受低氧胁迫时,体内的黄嘌呤脱氢酶可转化为黄嘌呤氧化酶,线粒体电子传递链载体失活,鱼体则产生大量的ROS[12-13],造成ROS的生成速率超过消除速率,发生氧化应激。为尽量减少ROS对机体的损伤,鱼类等需氧生物已进化出、一套抗氧化防御系统,如SOD、CAT和GPX等抗氧化酶[14]。SOD将O2-转化为H2O2,H2O2随后被CAT分解为H2O和O2,于是SOD-CAT就形成了鱼类对抗氧化损伤的第一道防线,而GPX则将H2O2和有机过氧化物转化为H2O,它们在维持自由基平衡和减少氧化损伤方面发挥着重要作用[15]。
在本研究中,低氧胁迫1 d时肝脏SOD和GPX活力显著增加,CAT活力显著下降,肌肉三种抗氧化酶活力均显著上升,表明军曹鱼在低氧胁迫1 d后机体处于氧化应激的状态,组织受到损伤,启动抗氧化防御体系来清除过量产生的ROS,这在斑马鱼()[16]的研究得以印证,其在3 mg/L的低氧胁迫后也引起内脏团的SOD和GPX活力升高,而在本实验室前期实验中,大规格军曹鱼幼鱼在急性低氧胁迫后肝脏SOD和GPX活力却显著降低[9],原因可能是胁迫的时间和低氧条件的不同,导致了结果的差异。对于低氧胁迫后肝脏CAT活力下降的情况,在河川沙塘鳢() 的研究中亦有肝脏CAT活力降低的现象,可能的原因是该时段肝脏产生过多的ROS,反过来抑制了CAT活性[17],此外,SOD产生的H2O2主要由CAT清除,SOD活力显著增高,产生了大量的H2O2,也可能会抑制CAT的活性,导致该时段CAT活力显著低于对照水平。
在低氧胁迫4 d时,肝脏SOD活力仍显著高于对照组,肌肉三种抗氧化酶也显著高于对照水平,说明军曹鱼在胁迫4 d时仍处于氧化应激状态,但肝脏和肌肉抗氧化酶均有恢复至对照水平的变化趋势,当低氧胁迫持续7 d时,肝脏CAT和GPX活性以及肌肉CAT活性已恢复至对照水平,说明军曹鱼可通过自身的调节逐渐适应低氧胁迫,该结果与瓦氏黄颡鱼()[13]在急性低氧胁迫后肝脏抗氧化酶活性先升高后下降的结果类似,但与大口黑鲈()[18]的结果有所不同,大口黑鲈在低氧胁迫后其肝脏SOD活性持续显著低于对照组,而CAT和GPX活性则表现为先显著高于对照组,后显著低于对照水平,对此,有研究发现,低氧诱导的氧化应激是一种物种和组织特异性的现象[19],不同鱼类对低氧胁迫的应激反应会有所不同。
MDA是自由基和多不饱和脂肪酸反应产生的环氧化合物,对鱼类的物质和能量代谢以及信息的传递产生影响,可作为氧化应激的一个指标[20]。本研究中,肝脏和肌肉MDA含量的变化趋势一致,均在1 d时显著上升,表明军曹鱼因低氧胁迫而受到脂质过氧化的损伤,与褐牙鲆()[21]研究结果相似,在溶氧不断下降的过程中,褐牙鲆幼鱼肌肉的MDA含量增加。从抗氧化指标可见,1 d时的肝脏和肌肉抗氧化酶活性显著增大,表明此时产生的自由基过多,抗氧化酶不能及时清除,导致脂质过氧化的发生,对肝脏和肌肉产生负面的影响,但随着时间的延长,MDA含量逐渐下降,说明军曹鱼可在长期低氧胁迫下进行自我调节,缓解应激状态。
此外,PILLET等[22]研究表明,肝脏对活性氧诱导的氧化应激最为敏感,本研究中,低氧胁迫后肝脏酶活力及MDA含量均明显高于肌肉,与文献[22]结果一致,说明肝脏最易受到氧化应激的损伤。
3.2 低氧胁迫对军曹鱼幼鱼肝脏碱性磷酸酶和酸性磷酸酶的影响
溶酶体可通过水解细菌细胞壁组分来清除细菌,因此常用作水生生物功能防御和健康状况的标志物,其对应激所产生的ROS极为敏感,一旦ROS过量产生,则溶酶体膜通透性降低,释放碱性磷酸酶(AKP) 和酸性磷酸酶(ACP) 等酶类[23]。后二者在鱼类免疫应答和多种代谢中起重要作用[24-25],当面临外界环境压力时,会产生ACP和AKP以降解外来物质。舌鳎()[26]、大黄鱼()[27]的研究中,与对照组相比,盐度的波动或降低盐度可显著提高舌鳎肝脏、大黄鱼肾脏ACP和AKP活性。这意味着机体抵御外界物质能力以及代谢能力增强,提供更多的能量来维持自身的稳态。本研究中,军曹鱼幼鱼在低氧胁迫期间,肝脏AKP和ACP活性分别在胁迫4 d和1 d显著升高,表明低氧作为一种环境应激因子,刺激军曹鱼的免疫应答,增强了免疫防御能力,同时也增强了代谢强度。此外,虽然AKP活性在7 d的低氧胁迫过程中整体上升,但是在胁迫1 d时的活性却显著下降,参考鲤()[25]在百草枯胁迫1 d时也出现AKP活性下降的情况,并结合本实验抗氧化酶活性结果,推测原因可能是,胁迫1 d 时ROS大量产生,造成军曹鱼的先天性免疫功能紊乱以及ROS抑制了AKP的活性。
3.3 低氧胁迫对军曹鱼幼鱼能量代谢的影响
脊椎动物糖原代谢是其获取能量的重要途径,对维持机体的能量代谢和重要功能物质的合成有重要作用[28]。研究表明,缺氧与厌氧代谢的激活有关[29],鱼类在低氧胁迫后肝糖原和肌糖原的含量会发生显著下降,说明在鱼类低氧应激过程中通过改变自身代谢途径的方式为机体提供能量[30]。本研究中,肝糖原在胁迫1、4 d时显著下降,说明在这期间,军曹鱼幼鱼为应对低氧环境启动厌氧糖酵解,大量分解糖原,以维持血糖的浓度。当胁迫持续到7 d时,肝糖原含量恢复到正常水平,说明随时间的延长,军曹鱼幼鱼通过各种生理生化调节,逐渐适应低氧环境,代谢趋于正常。另外,本研究可见,肌糖原含量仅平均值下降,与对照组无显著性差异,与大口黑鲈[31]和花鲈()[28]的研究结果类似,大口黑鲈和花鲈在低氧胁迫后肌糖原均未表现出显著的变化,原因可能是肝脏作为低氧胁迫主要的代谢器官,肝糖原的分解提供了大部分的能量,肌糖原仅参与小部分机体能量供应。
乳酸脱氢酶(LDH) 可催化丙酮酸与乳酸间的相互转化,其活性与组织内的氧分压密切相关,在低氧条件下活性增高,促进厌氧糖酵解,产生的乳酸反过来又会提高LDH的活性,因此,LDH活性一定程度上可反映厌氧呼吸水平[32]。本研究中,胁迫1 d时肝脏LDH活性显著升高,说明机体正在进行厌氧呼吸,且随着糖原含量的减少,肝脏糖异生作用被激活,以供应厌氧代谢所需的能量,因此,在缺氧过程中产生乳酸作为糖异生底物,刺激LDH活性,将乳酸转化为丙酮酸,生成葡萄糖,在郭志雄等[9]和黄建盛等[10]的研究中也出现了类似的结果,军曹鱼幼鱼在急性低氧胁迫后肝脏和血清LDH活性均显著升高。而肌肉LDH在胁迫1 d时无显著变化,在4 d时显著上升,也说明肌肉并非低氧过程中供应能量的主要组织,但随着胁迫时间的增加,积累的乳酸也导致其LDH活性上升。
4 结论
军曹鱼幼鱼在低氧胁迫后发生氧化损伤,刺激自身免疫系统,通过调整相关酶活力及能量代谢的方式提高其适应低氧的能力。
[1] 穆景利, 靳非, 赵化德, 等. 水体低氧的早期暴露对青鳉()后期的生长、性别比和繁殖能力的影响 [J]. 生态毒理学报, 2017, 12(2): 137-146.
[2] 徐贺, 陈秀梅, 王桂芹, 等. 低氧胁迫在水产养殖中的研究进展 [J]. 饲料工业, 2016, 37(2): 33-37.
[3] 狄治朝, 周涛, 许强华. 低氧胁迫与常氧条件下斑马鱼鳃中热休克蛋白基因家族的表达差异比较[J]. 大连海洋大学学报, 2018, 33(6): 690-695.
[4] DU S N, MAHALINGAM S, BOROWIEC B G, et al. Mitochondrial physiology and reactive oxygen species production are altered by hypoxia acclimation in killifish () [J]. Journal of Experimental Biology, 2016, 219(8): 1130-1138.
[5] WANG Q F, SHEN W L, HOU C C, et al. Physiological responses and changes in gene expression in the large yellow croakerfollowing exposure to hypoxia [J]. Chemosphere, 2017, 169: 418-427.
[6] ZHANG G S, ZHAO C, WANG Q T, et al. Identification of HIF-1 signaling pathway inusing RNA-Seq: effects of acute hypoxia and reoxygenation on oxygen sensors, respiratory metabolism, and hematology indices [J]. Journal of Comparative Physiology B, 2017, 187(7): 1-13.
[7] 王中铎, 史沛鑫, 苏惠娜, 等.军曹鱼群体遗传结构的AFLP分析[J]. 广东海洋大学学报, 2011, 31(1): 12-17.
[8] 陈强, 刘泓宇, 谭北平, 等. 饲料胆固醇对军曹鱼幼鱼生长、血液生化指标及脂代谢的影响[J]. 广东海洋大学学报, 2016, 36(1): 35-43.
[9] 郭志雄, 曾泽乾, 黄建盛, 等.急性低氧胁迫对大规格军曹鱼幼鱼肝脏氧化应激、能量利用及糖代谢的影响[J]. 广东海洋大学学报, 2020, 40(3): 134-140.
[10] 黄建盛, 陆枝, 陈刚, 等. 急性低氧胁迫对军曹鱼大规格幼鱼血液生化指标的影响[J]. 海洋学报, 2019, 41(6): 76-84.
[11] 李洪娟, 陈刚, 郭志雄, 等.军曹鱼() 幼鱼对环境低氧胁迫氧化应激与能量利用指标的响应[J]. 海洋学报, 2020, 42(4): 12-19.
[12] LUSHCHAK V I, BAGNYUKOVA T V. Hypoxia induces oxidative stress in tissues of a goby, the rotan[J]. Comparative Biochemistry & Physiology Part B, 2007, 148(4): 390-397.
[13] ZHANG G S, MAO J Q, LIANG F F, et al. Modulated expression and enzymatic activities of Darkbarbel catfish,for oxidative stress induced by acute hypoxia and reoxygenation[J]. Chemosphere, 2016, 151: 271-279.
[14] DASGUPTA S, GIULIO R T D, DROLLETTE B D, et al. Hypoxia depresses CYP1A induction and enhances DNA damage, but has minimal effects on antioxidant responses in sheepshead minnow () larvae exposed to dispersed crude oil[J]. Aquatic Toxicology, 2016, 177: 250-260.
[15] CAO L, HUANG W, SHAN X J, et al. Tissue-specific accumulation of cadmium and its effects on antioxidative responses in Japanese flounder juveniles[J]. Environmental Toxicology & Pharmacology, 2012, 33(1): 16-25.
[16] FENG J F, GUO Y, GAO Y F, et al. Effects of hypoxia on the physiology of zebrafish (): Initial responses, acclimation and recovery[J]. Bulletin of Environmental Contamination & Toxicology, 2016, 96(1): 43-48.
[17] 贾秀琪, 张宏叶, 王丽等. 低氧胁迫对河川沙塘鳢抗氧化酶及ATP酶活性的影响 [J]. 海洋渔业, 2017, 39(3): 306-313.
[18] YANG S, YAN T, WU H, et al. Acute hypoxic stress: effect on blood parameters, antioxidant enzymes, and expression of HIF-1alpha and GLUT-1 genes in largemouth bass ()[J]. Fish & Shellfish Immunology, 2017, 67: 449-458.
[19] LEVEELAHTI L, RYTKÖNEN K T, RENSHAW G M C, et al. Revisiting redox-active antioxidant defenses in response to hypoxic challenge in both hypoxia-tolerant and hypoxia-sensitive fish species[J]. Fish Physiology & Biochemistry, 2014, 40(1): 183-191.
[20] 区又君, 陈世喜, 王鹏飞, 等. 低氧环境下卵形鲳鲹的氧化应激响应与生理代谢相关指标的研究 [J]. 南方水产科学, 2017, 13(3): 120-124.
[21] 李洁, 唐夏, 张灵燕等. 溶解氧水平对褐牙鲆幼鱼能量代谢和氧化应激的影响研究[J]. 广西科学院学报, 2015, 31(1): 22-27.
[22] PILLET M, DUPONTPRINET A, CHABOT D, et al. Effects of exposure to hypoxia on metabolic pathways in northern shrimp () and Greenland halibut ()[J]. Journal of Experimental Marine Biology & Ecology, 2016, 483: 88-96.
[23] GUO J S, WU P H, CAO J L, et al. The PFOS disturbed immunomodulatory functions via nuclear factor-κB signaling in liver of zebrafish ()[J]. Fish & shellfish immunology, 2019, 91: 87-98.
[24] CHEN S J, XIE S W, CHEN M, et al. Hypoxia-induced changes in survival, immune response and antioxidant status of the Pacific white shrimp () fed with graded levels of dietary myo-inositol[J]. Aquaculture nutrition, 2019, 25(2): 518-528.
[25] MA J G, LI Y Y, WU M L, et al. Serum immune responses in common carp (L.) to paraquat exposure: The traditional parameters and circulating microRNAs [J]. Fish & Shellfish Immunology, 2018, 76: 133-142.
[26] KHAIRNAR S O, TIAN X, DONG S, et al. Effects of the amplitude and frequency of salinity fluctuations on antioxidant responses in juvenile tongue sole, Cynoglossus semilaevis[J]. Spanish Journal of Agricultural Research, 2016, 14(2): e0503.
[27] WANG Y J, LI W M, LI L S, et al. Effects of salinity on the physiological responses of the large yellow croaker Pseudosciaena crocea under indoor culture conditions [J]. Aquaculture Research, 2016, 47(11): 3410-3420.
[28] 常志成, 温海深, 张美昭, 等. 溶解氧水平对花鲈幼鱼氧化应激与能量利用的影响及生理机制 [J]. 中国海洋大学学报(自然科学版), 2018, 48(7): 20-28.
[29]SPEERS R B, SANDBLOM E G. Effects of environmental hypoxia on cardiac energy metabolism and performance in tilapia [J]. Am J Physiol Regul Integr Comp Physiol, 2010, 298(2): 104-119.
[30] LI M X, WANG X D, QI C L, et al. Metabolic response of Nile tilapia () to acute and chronic hypoxia stress [J]. Aquaculture, 2018, 495: 187-195.
[31]YANG S, WU H, HE K, et al. Response of AMP-activated protein kinase and lactate metabolism of largemouth bass () under acute hypoxic stress[J]. Science of the Total Environment, 2019, 666: 1071-1079.
[32] WANG Q F, SHEN W L, LIU C, et al. Effects of multi-environmental factors on physiological and biochemical responses of large yellow croaker,[J]. Chemosphere, 2017, 184: 907-915.
Effects of Hypoxia Stress on Antioxidation, Immunity and Energy Metabolism of Juvenile Cobia,
WANG Wei-zheng1, ZENG Ze-qian1, HUANG Jian-sheng1,2, GUO Zhi-xiong1, LI Hong-juan1, CHEN Gang1,2
(1.,524025,; 2.(),524025,)
【】To investigate the effect of hypoxia on antioxidant , immunity and energy metabolism of juvenile cobia. 【】,a 7-day hypoxia (2.98±0.40 mg/L) experiment was conducted, and the enzymes of antioxidant, immunity and the energy metabolism in liver and muscle were monitored. 【】The activity of superoxide dismutase (SOD) increased significantly (<0.05) and then decreased in liver while significantly increased (<0.05) in muscle after hypoxia stress. The activities of glutathione peroxidase (GPX) and the content of malondialdehyde (MDA) in both liver and muscle increased significantly (<0.05) and then decreased. However, the activities of catalase (CAT) increased significantly (<0.05) and then decreased in muscle, whereas it is decreased significantly (<0.05) and then increased in liver. Alkaline phosphatase (AKP) activity in liver decreased significantly (<0.05) at first and then increased significantly (<0.05), and eventually recovered to the level of control, but the activities of acid phosphatase (ACP) presented the opposite trend. The activities of lactate dehydrogenase (LDH) was the same in liver and muscle, both increased significantly (<0.05) and then decreased. In addition, the content of glycogen in liver declined (<0.05) after hypoxia stress, then recovered to the level of the control (>0.05). but the content of muscle glycogen had no significant difference (>0.05) in different time. 【】The juvenile cobia encountered oxidative damage after hypoxia stress, which stimulated the immune system and improved its ability to adapt to hypoxia byregulating the activity of relevant enzymes and energy metabolism.
; hypoxia; antioxidant; immune; energy metabolism
S965.399
A
1673-9159(2020)05-0012-07
10.3969/j.issn.1673-9159.2020.05.002
2019-11-29
现代农业产业技术体系专项资金资助(CARS-47);广东海洋大学大学生创新创业训练计划项目(CXXL2018131);南方海洋科学与工程广东省实验室(湛江)(ZJW-2019-06);2018年广东海洋大学起航计划项目(QHJHZR201818)
王维政(1995―),男,硕士研究生,主要研究方向海水鱼类养殖生理生态学。E-mail: 1029588896 @qq.com
黄建盛,副教授,主要研究方向海水鱼养殖生理生态学。E-mail:huangjs@gdou.edu.cn
陈刚,教授,主要研究方向海水鱼养殖生理生态学。E-mail:cheng@gdou.edu.cn
王维政,曾泽乾,黄建盛,等. 低氧胁迫对军曹鱼幼鱼抗氧化、免疫能力及能量代谢的影响[J]. 广东海洋大学学报,2020,40(5):12-18.
(责任编辑:刘庆颖)
