花生AhDREB转录因子对逆境胁迫的响应
2020-07-24肖丽娜李荣冲彭振英田丽彬韩燕崔凤万书波李国卫刘译阳
肖丽娜李荣冲彭振英田丽彬韩 燕崔 凤万书波李国卫刘译阳*
(1.山东师范大学生命科学学院,山东 济南 250014; 2.山东省农业科学院生物技术研究中心,山东 济南 250100)
AP2/ERF(PETAL/ethylene responsive element binding factor)类转录因子是一类与植物逆境胁迫相关的转录因子,DREB(Dehydration Responsive Element Binding Protein)转录因子则是AP2/ERF类转录因子的一个亚家族[1]。DREB转录因子含有一个由60个左右的氨基酸残基组成的AP2/ERF保守结构域,其中位于第14位的V(缬氨酸)和第19位的E(谷氨酸)对转录因子与顺式元件的结合非常重要[2]。DREB家族转录因子能与DRE/CRT元件特异性结合,从而调控下游抗逆基因的表达,最终提高植物对逆境的抵抗和适应能力[3]。拟南芥AtDREB基因家族可分为六个亚族,分别为A1~A6[4-5]。其A1和A4的表达受低温胁迫的诱导;A2和A3的表达受干旱和高温诱导;A5可能负反馈A1和A2,A6的表达也受到一定的胁迫的诱导[4-5]。
花生是我国重要的油料作物之一,出油率高达45%~50%,在我国广泛种植。低温、干旱和盐胁迫等逆境胁迫是限制植物生长发育和产量形成的重要因素,寻找新的抗逆基因,培育出抗逆花生新品种是育种家追求的目标[6]。然而,相对于模式植物,对花生低温和耐盐的非生物胁迫耐受性研究较少,对花生非生物胁迫相关基因的功能和转基因研究正处于起步阶段[7]。本研究采用生物信息学方法分析了AhDREB基因家族各成员的物理化学性质、进化关系、基因结构、表达情况等,为进一步研究AhDREB转录因子的生物学功能和提高逆境条件下的花生抗性奠定了一定的理论基础[8]。
1 材料与方法
1.1 植物材料及处理
供试品种为Tifrunner,由美国花生种质资源库提供,本实验室保存。花生种子在营养土与蛭石(2∶1)的混合土中萌发,培养于16h光照/8h黑暗(28℃/22℃)的光照培养箱中。将萌发后两周大小的幼苗进行高温、低温、高盐和干旱胁迫处理后,选取其倒三叶进行材料保存。高温处理时,将幼苗分别置于45℃培养箱中,分别在0h、6h、12h、24h取材;低温处理时,将幼苗分别置于4℃培养箱中,分别在0h、4h、8h、12h取材;20%PEG6000进行模拟干旱胁迫处理,分别在0h、4h、6h、12h取材;250 mmol/L NaCl进行高盐处理,分别在0d、1d、2d、4d取材。以上材料均用液氮冷冻,保存于-80℃冰箱,并用于后续实验。
1.2 花生AhDREB转录因子蛋白质序列的鉴定
从TAIR(https://www.arabidopsis.org/)中搜索下载拟南芥AtDREB转录因子家族的6个亚组的蛋白全长序列共55个,通过blastp在Peanut Base[9](https://peanutbase.org/)中进行检索,根据E-value<1.0e-10进行筛选,获得相应花生转录因子蛋白质序列,并删除重复序列。对所预测的花生AhDREB转录因子进行染色体位置、氨基酸数目、编码序列等进行统计。
1.3 花生和拟南芥DREB转录因子系统进化树的构建
拟南芥和花生DREB转录因子蛋白序列利用Clustal X进行多重序列比对,并运用MEGA5.2软件中的邻接法(NJ, neighbor-joining)构建进化树,校验参数Bootstrap设为1000次[10]。
1.4 花生AhDREB家族基因结构及保守域分析分析
将花生AhDREB基因组序列和编码序列利用在线GSDS(http://gsds.cbi.pku.edu.cn/)绘制外显子—内含子结构图[11]。利用在线软件MEME[12](http://meme-suite.org/)对花生AhDREB家族蛋白保守结构域进行分析,并利用Adobe Illustrator工具导出图片。
1.5 花生AhDREB基因家族在不同组织及非生物胁迫下的表达量分析
分析花生AhDREB基因家族在不同组织中的表达量时,从NCBI数据库下载已发表的花生22个不同组织的转录组数据(PRJNA291488)[13],查找并下载花生AhDREB基因表达的FPKM值,利用HemI软件绘制热图[14]。
分析花生AhDREB基因家族在不同胁迫条件下的表达量时,挑选萌发10d后的花生品种“丰花1号”幼苗,分为2个重复组,进行下述胁迫处理:2% NaCl处理24 h,20% PEG6000处理24h,低温(4℃)处理24h,高温(37℃)处理24h,不进行任何处理的作为对照。取各处理材料的叶片,用液氮速冻后用于提取总RNA,进行RNA-seq测序,并将原始测序数据上传至NCBI数据库(PRJNA553073)。利用此数据库,查找并下载花生AhDREB基因在上述胁迫下的相对表达量,使用Cuffdiff软件[15]并按以下标准鉴定差异表达基因:① 对照或处理的FPKM值至少有1个大于1;②|Log2 Fold changes|≥1; ③p≤0.05,利用HemI软件绘制热图。
1.6 花生AhDREB基因转录组数据的qRTPCR验证
花生RNA 提取采用RNA prep Pure多糖多酚植物总RNA提取试剂盒(天根)。反转录采用PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒(按操作说明进行)。qRT-PCR采用TB Green®remix Ex TaqTMII(Tli RNase H Plus)试剂盒(TaKaRa),按操作说明进行。AhDREB1特异性引物:上游引物:5'-TCCAAGCCATGAAGCCGTAG-3';下游引物:5'-ATTCACTTCCTCGACCACCG-3'。AhDREB12特异性引物:上游引物:5'-TTCGCGAACCAATCAGCAAC-3';下游引物:5'-CCGGAAAGTTCAAACGTGCG-3'。内参基因TUA5(NCBI登录号GO264294)的特异性引物为:上游引物:5'-CTGATGTCGCCGTGCTCTTGG-3';下游引物:5'-CTGTTGAGGTTGGTGTAGGTAGG-3'。所有试验均设3次生物学重复,数据分析采用2-ΔΔCT法。荧光定量PCR仪采用Roche的Light Cycler 2.0 instrument system。
2 结果与分析
2.1 花生AhDREB转录因子家族成员的鉴定
利用拟南芥AtDREB转录因子蛋白序列在花生数据库进行基因检索,共得到22个花生AhDREB转录因子蛋白序列。将这22个AhDREB转录因子的基因重新命名为AhDREB1到AhDREB22 (表1)。
分析结果发现,22个AhDREB基因数目不均匀地分布于A、B两个基因组中的12条染色体上,其中有8个位于A基因组,14个位于B基因组。在A基因组中,Aradu.A02和Aradu.A04各有1个AhDREB基因,其余的3条染色体存在2个。在B基因组中,Araip.B08上有4个,Araip.B06上有3个,Araip.B04和Araip.B07上分别有2个,其余的染色体上个只有1个。在22个基因中存在多对等位基因,例如,AhDREB5和AhDREB17为一对等位基因,AhDREB1和AhDREB9为一对等位基因。
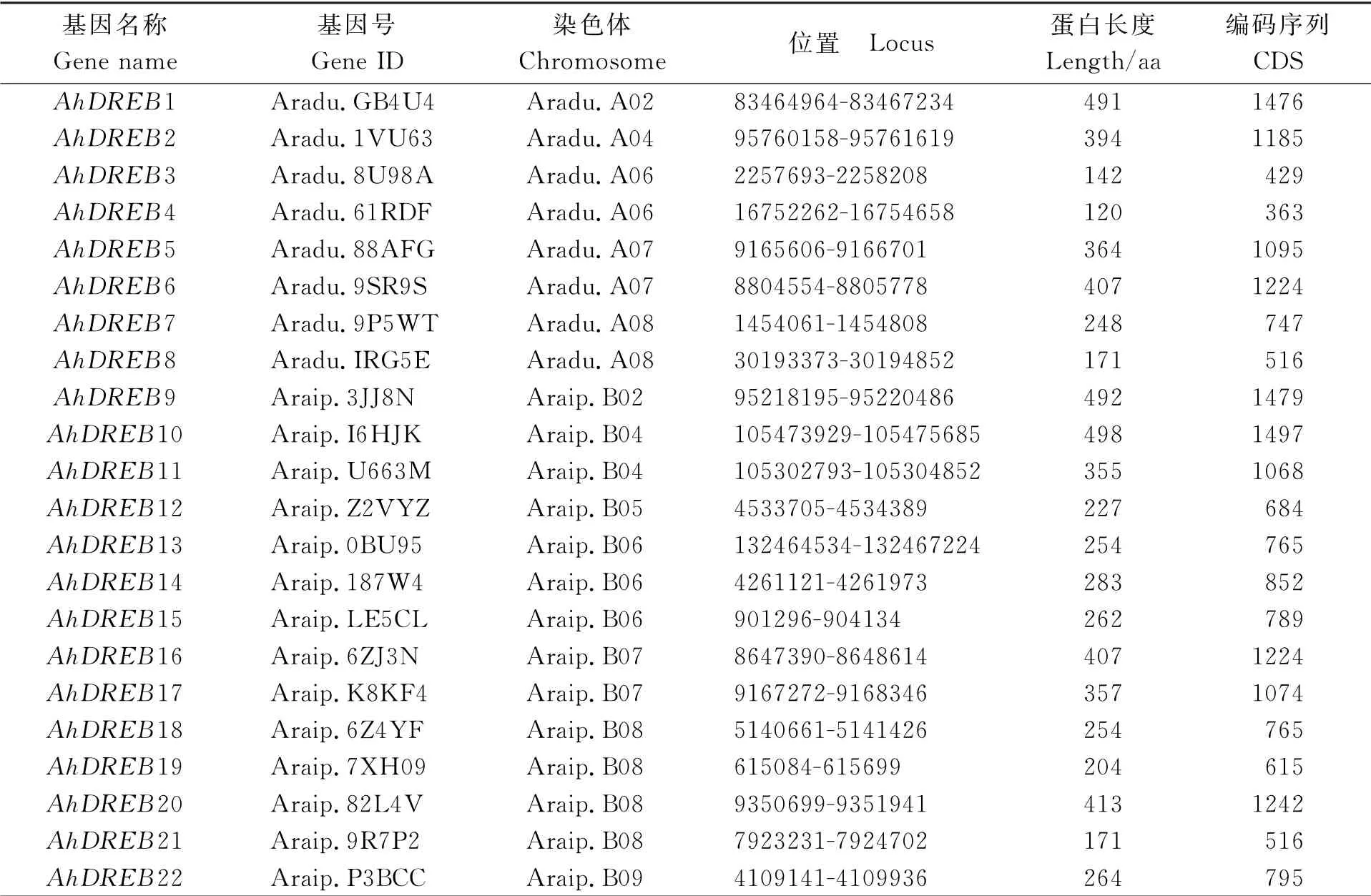
表1 AhDREB基因信息汇总Table 1 Summary of AhDREB gene information
2.2 花生AhDREB转录因子家族系统进化树的构建
以拟南芥AtDREB转录因子家族成员为参考,对花生22条序列进行进化树的构建(图1)。结果显示,与拟南芥AtDREB家族分类相对应,花生AhDREB家族22个成员也可分为6个亚家族:A1、A2、A3、A4、A5和A6,其成员数量分别为1、12、3、4、1和1个。其中,A1、A4和A5亚家族聚集成一组,A2、A3和A6亚家族聚集成一组,构成了进化树的两个紧密联系的大组。
2.3 花生AhDREB基因结构分析
分析AhDREB的6个亚家族基因结构,发现他们具有明显不同的特点(图2)。22个成员中,除AhDREB2和AhDREB13有4个外显子,AhDREB10和AhDREB15有3个外显子外,其余成员只有1~2个外显子,并且外显子较多的基因,氨基酸数目也相对较多,这说明在进化中该家族基因发生了外显子数目增加和长度增长,导致基因大小也随之增加。
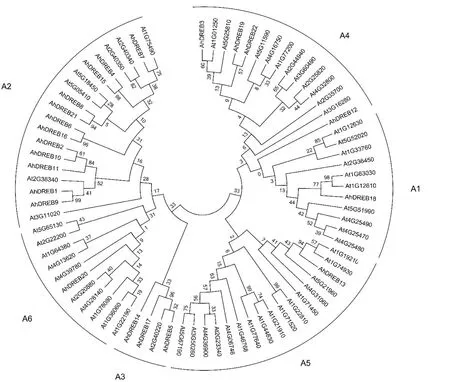
图1 花生和拟南芥DREB转录因子的系统进化树Fig.1 A phylogenetic tree of DREB transcription factors from peanut and Arabidopsis
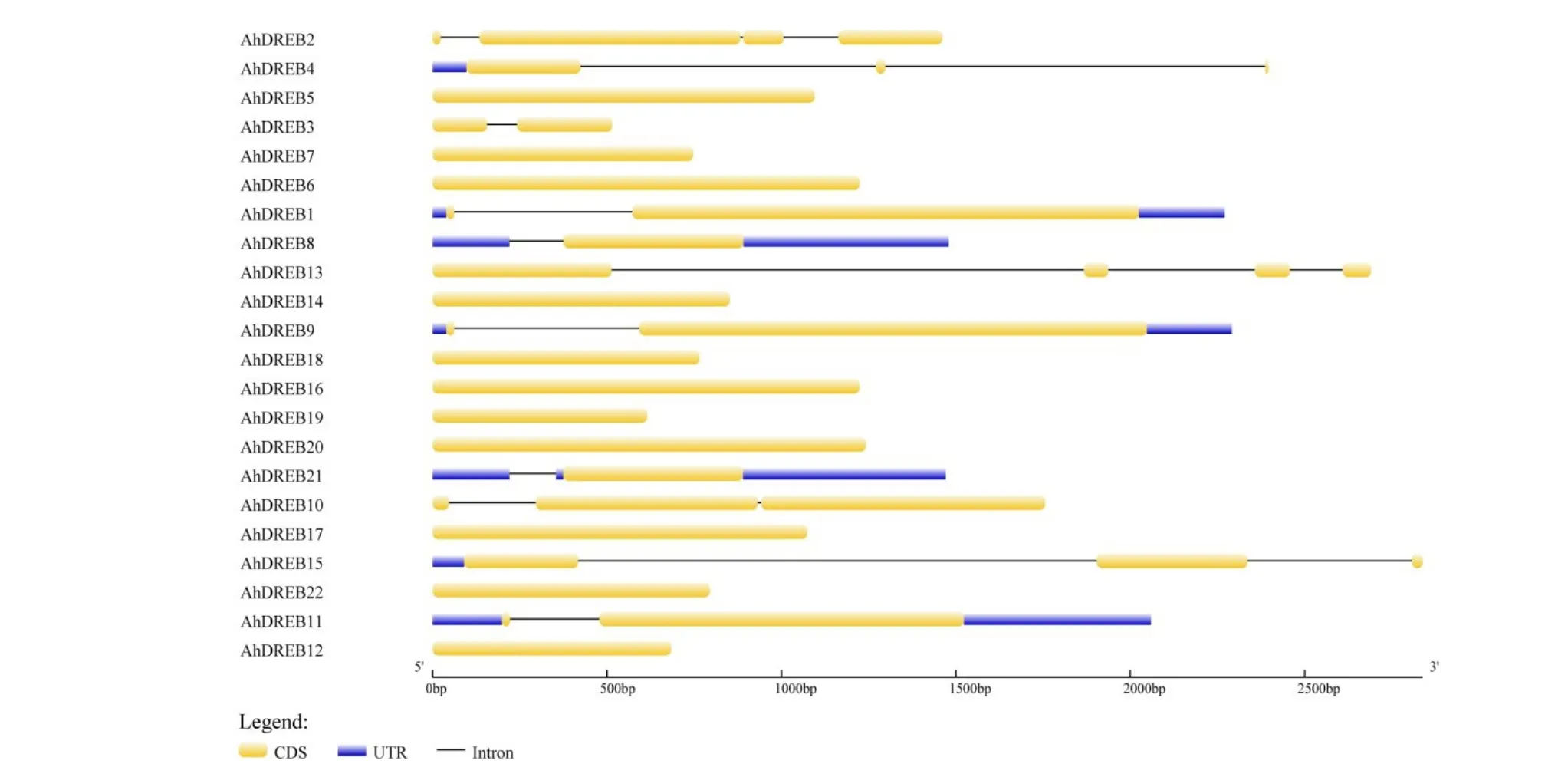
图2 花生AhDREB基因结构分析Fig.2 Gene structure analysis of AhDREB
2.4 花生AhDREB转录因子motif搜索及保守序列分析
利用MEME软件对AhDREB蛋白质序列进行motif搜索,并构建AhDREB转录因子进化树及motif分布图(图3)。结果显示,花生AhDREB转录因子共鉴定出6种motif,其中motif1和motif2分布最广泛,保守性最高,分别有29个和27个保守氨基酸。motif1和motif2对应的则是AP2/ERF结构域,motif1的第13位和第18位对应的是AP2/ERF结构域的第14位的缬氨酸(V)和第19位的谷氨酸(E),这是DREB与ERF家族的主要区别。另外其他4个保守序列motif3、motif4、motif5和motif6,也分布于不同的亚家族中,在亚家族内具有保守性。在A2亚家族中,所有成员均含有motif1、motif2和motif3,其 中AhDREB1、AhDREB2、AhDREB9和AhDREB10蛋白序列尾部含有特殊的motif4。A6和A3亚家族中的AhDREB20、AhDREB5、AhDREB17含有特有的motif6。A1、A5及A4亚家族中,除AhDREB3只含有motif1之外,其余成员都含有motif1和motif2,这与进化树中的分组相一致。上述结果表明,尽管AhDREB蛋白质序列大小存在一定的差异,但内部具有高度的保守性。亚家族内的AhDREB转录因子成员motif的种类、数目和分布相对具有一致性,这同样也反映了进化树分组的可靠性。
2.5 花生AhDREB转录因子基因家族的不同组织表达分析
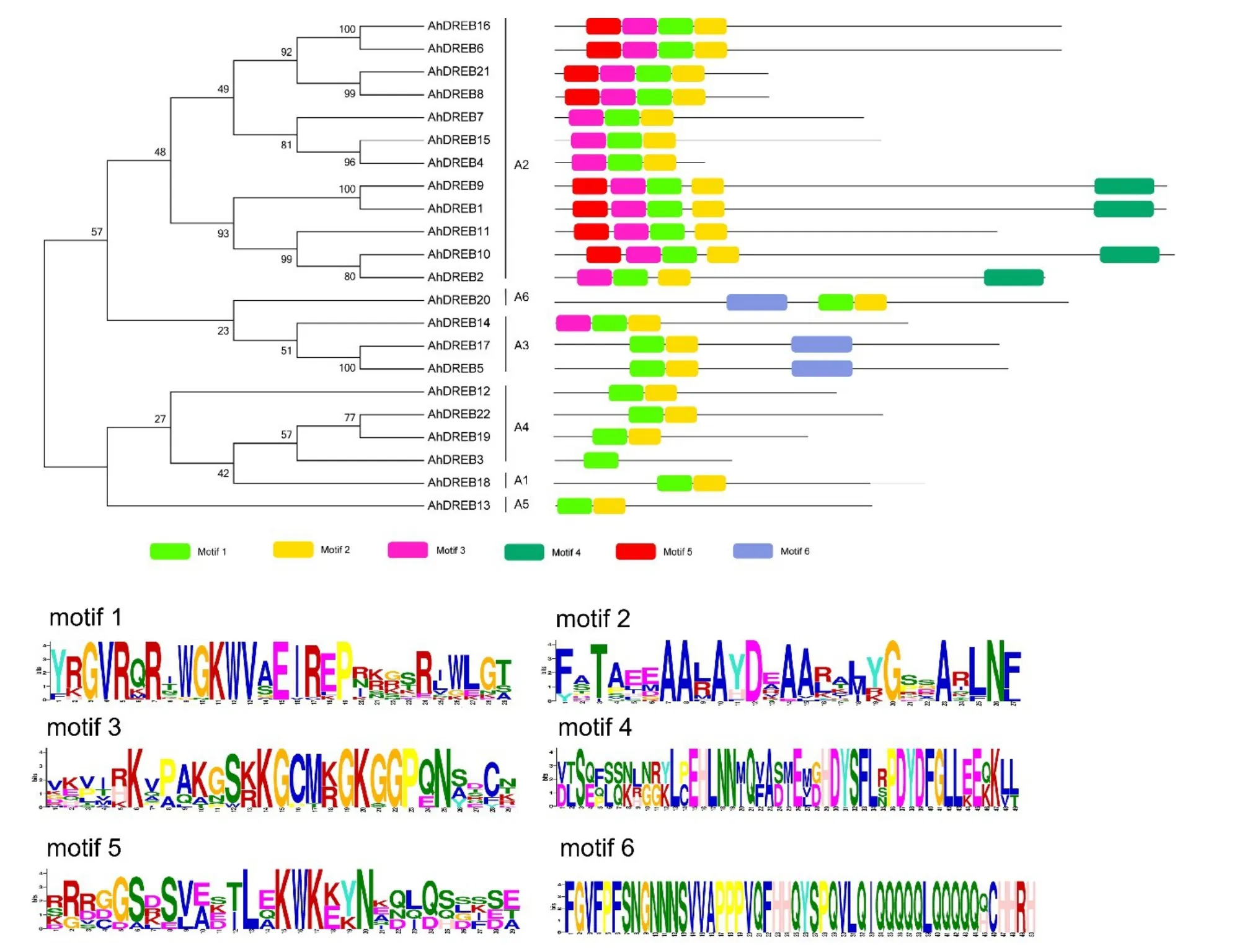
图3 花生AhDREB基因家族保守结构域Fig.3 Conserved motifs of AhDREB family members in peanut
利用已发表的22个花生组织的表达量数据对AhDREB进行分析(图4)。结果表明,大多数AhDREB基因在各个组织中的表达量均较低,部分基因在特定组织或发育时期具有较高的表达水平。花生AhDREB7、AhDREB12和AhDREB21在种子发育后期表达量较高。AhDREB8和AhDREB21作为一对同源基因具有相同的表达模式,在茎尖、果荚及种子发育等时期表达量相对较高,这表明两者在花生发育过程中具有重要作用。AhDREB6和AhDREB16作为一对同源等位基因,在果针入土后表达量升高,这暗示着两者可能参与了果针入土后的胚胎发育过程。
2.6 花生AhDREB基因在不同胁迫条件下的表达分析
为进一步分析花生AhDREB基因在不同胁迫处理条件下的表达变化,利用本实验室在干旱、高盐、高温与低温胁迫下的花生转录组数据(PRJNA354652),分析花生AhDREB家族基因在上述胁迫下的表达量。结果如图5所示,共有12个AhDREB基因在高温、低温、盐与干旱胁迫下具有不同的响应模式。其中,有4个AhDREB基因响应干旱胁迫上调或下调表达;6个AhDREB基因响应高温胁迫上调或下调表达;4个AhDREB基因响应盐胁迫上调或下调表达,5个AhDREB基因响应低温胁迫上调或下调表达。其中AhDREB1基因在干旱和低温胁迫下均上调表达,AhDREB12基因在盐和高温胁迫下均上调表达,推测这两个基因在胁迫反应中起重要作用。
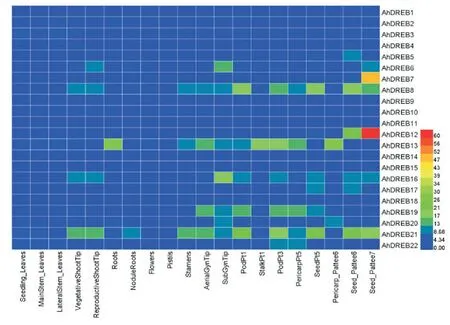
图4 花生AhDREB基因表达模式热图Fig.4 Expression pattern analysis of AhDREB in peanut
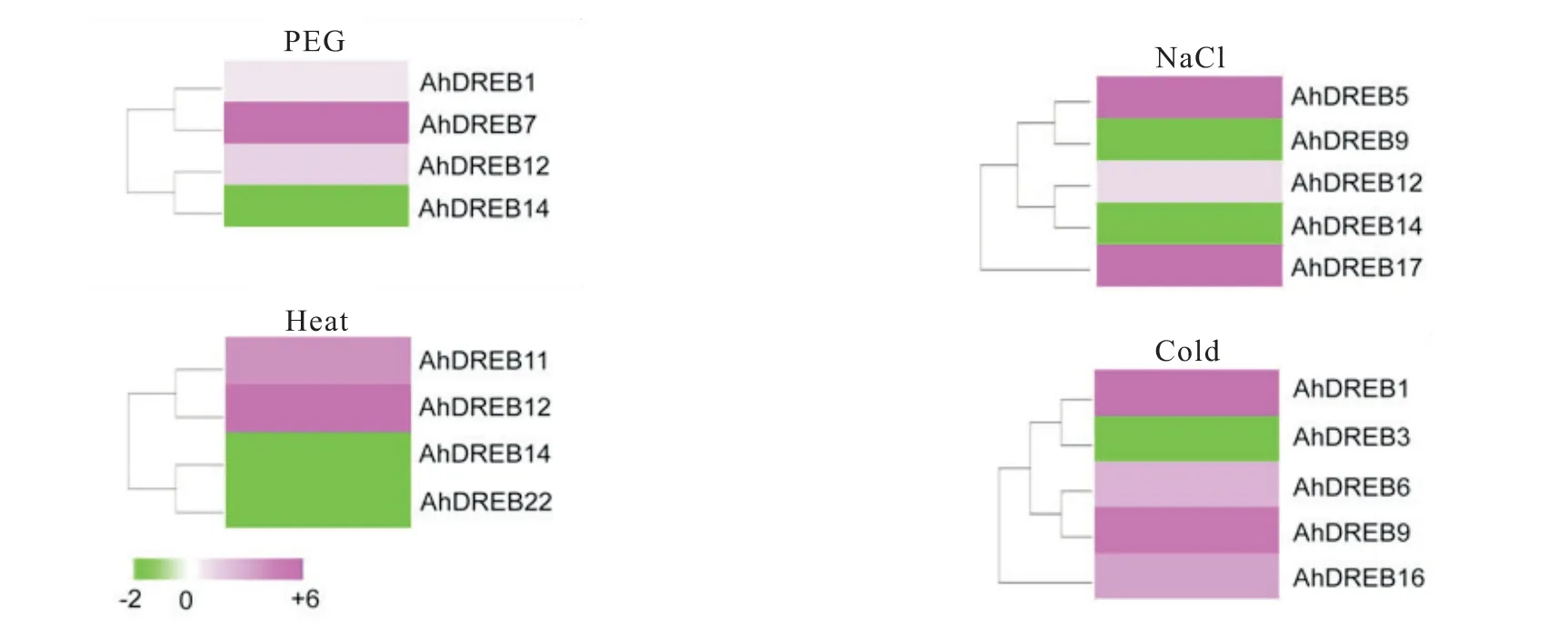
图5 花生AhDREB家族基因在干旱、盐、高温及低温胁迫下的表达分析Fig.5 Expression pattern analysis of AhDREBs under drought, salt, high temperature and low temperature stresses
2.7 花生AhDREB基因qRT-PCR分析
通过对花生AhDREB基因在不同胁迫条件下的表达分析,结果发现AhDREB1基因在干旱和低温胁迫诱导下均上调表达,AhDREB12基因在高温和盐胁迫诱导下均上调表达。为了进一步验证上述结果,利用qRT-PCR分析AhDREB1与AhDREB12基因在250mmol/L NaCl,20%PEG6000,低温(4℃)和高温(45℃)处理下的表达特性。结果如图6所示,AhDREB1基因在PEG模拟干旱胁迫条件下呈现先上升后下降的表达趋势,在低温胁迫条件下逐渐上调表达;AhDREB12受盐胁迫诱导上调表达并呈现先上升后下降而后又上升的表达趋势,而在高温胁迫条件下则剧烈上调表达。
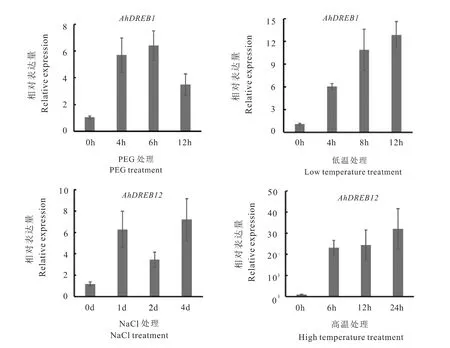
图6 qRT-PCR分析花生AhDREB基因在干旱、盐、高温及低温胁迫下的表达模式Fig.6 Expression pattern analysis of AhDREBs under drought, salt,high temperature and low temperature stresses using qRT-PCR
3 讨论与结论
花生是我国重要的粮食与油料作物,而干旱、盐与冷等非生物胁迫严重影响着花生的产量与品质[16]。因此,培育抗逆的优良花生品种,对提高花生产量具有重要的意义[6]。研究表明,转录因子调控在植物响应非生物胁迫方面起着重要的作用[17]。随着花生基因组测序的完成,越来越多的响应非生物胁迫的转录因子被鉴定出来。赵小波[18]等利用转录组测序技术分析了干旱条件下抗旱花生品种“J11”中转录因子的表达变化,确定存在236个转录因子发生了差异表达,其中60%的转录因子表达上调,这表明转录因子能够提高花生的耐旱性。赵小波[19]等分析了盐胁迫条件下花生转录因子的表达情况,共计发现33个转录因子家族,包括102个转录因子表达上调。陈娜[20]等在花生中筛选到99个与低温胁迫相关转录因子,主要包括MYB、WRKY、NAC及AP2/ERF等家族蛋白。
DREB转录因子家族能够与DRE/CRT顺式作用元件特异性的识别和结合,同时调控多个抗逆基因的表达,广泛参与抗逆生理生化过程,从而调高植物的抗逆性[21]。利用DREB转录因子来增强植物的抗逆性的手段目前备受关注。本研究利用生物信息学方法,从花生数据库中分离鉴定了22个AhDREB转录因子,聚类分析将其分为6个亚组,这与拟南芥中的分类一致[22]。蛋白质保守基序分析表明,亚组内部蛋白质保守基序分布高度相似,均含有AP2/EREBP结构域,而不同亚组之间存在明显的不同,这暗示着不同亚组间可能具有不同的功能。在不同组织的表达量分析表明,多数AhDREB基因在各个组织中表达量均较低甚至不表达,而部分基因在花生特定组织及发育时期具有较高的表达量。例如AhDREB8、AhDREB12、AhDREB13和AhDREB21在花生荚果发育时期表达较高;AhDREB13在根中具有较高的表达量。在非生物胁迫条件下,A2组受低温诱导后表达的基因数量较多;A1和A2组在干旱及热激诱导后表达的基因数量较多,而A3组在盐处理后表达的基因数量较多。其中,AhDREB1受干旱及冷条件下诱导显著上升,AhDREB12在盐及热激条件下显著上升,这暗示着这两个基因在花生响应非生物胁迫条件下具有重要的作用。
