鸭坦布苏病毒、鸭肠炎病毒和番鸭细小病毒TaqMan三重实时荧光定量PCR检测方法的建立与临床应用
2020-07-23吴双姜勇徐建生吴植谢军宋海港魏若瑶高悦朱善元
吴双 姜勇 徐建生 吴植 谢军 宋海港 魏若瑶 高悦 朱善元

摘要:本研究旨在建立一種快速、敏感和高特异性检测鸭坦布苏病毒(DTMUV)、鸭肠炎病毒(DEV)和番鸭细小病毒(MDPV)的TaqMan三重实时荧光定量PCR(q-PCR)的诊断方法并应用于临床疑似样品检测。根据DTMUV的E基因、DEV的UL2基因和MDPV的VP3基因保守区域,分别设计合成了3对特异性引物和探针,在建立单重q-PCR方法的基础上建立了三重q-PCR方法。运用三重q-PCR方法对198份来自江苏和安徽的鸭组织疑似病料进行检测,结果表明,建立的TaqMan三重q-PCR可同时检测这3种病毒,检测灵敏度至少达100个拷贝,相关系数(R2)均在0.99以上,扩增效率为90%~110%。同时,该方法对H9亚型禽流感病毒(H9N2 AIV)、鸭甲肝病毒Ⅰ型(DHAV-1)、番鸭呼肠孤病毒(MDRV)、鸭呼肠孤病毒(DRV)、新城疫病毒(NDV)、鹅细小病毒(GPV)的检测均为阴性,表明该方法具备特异性强、灵敏度高、重复性好和快速等优点。与常规PCR检测方法相比,三重q-PCR方法灵敏度大约高100倍。临床疑似样品检测结果表明DTMUV的检出率最高,3种病毒混合感染亦常见。建立的TaqMan三重q-PCR检测方法为DTMUV、DEV和MDPV的临床样品检测提供了快速、有效、特异和灵敏的工具,也为临床分子流行病学调查及定量分析奠定了基础。
关键词:鸭坦布苏病毒;鸭肠炎病毒;番鸭细小病毒;TaqMan实时荧光定量PCR
中图分类号:S834文献标识码:A文章编号:1000-4440(2020)03-0626-08
Establishment and clinical application of triple TaqMan real-time fluorescence quantitative PCR detection method for duck Tembusu virus, duck enteritis virus and Muscovy duck parvovirus
WU Shuang1,JIANG Yong1,2,XU Jian-sheng2,WU Zhi1,XIE Jun1,SONG Hai-gang1,2,WEI Ruo-yao2,GAO Yue1,ZHU Shan-yuan1
(1.Jiangsu Agri-animal Husbandry Vocational College/Jiangsu Provincial Key Laboratory of Veterinary Bio-pharmaceutical High-tech Research,Taizhou 225300, China;2.College of Veterinary Medicine, Yangzhou University, Yangzhou 225009, China)
Abstract:This study aimed to establish a triple TaqMan real-time fluorescence quantitative PCR(q-PCR) method for the rapid, sensitive and specific detection of duck Tembusu virus (DTMUV), duck enteritis virus (DEV) and Muscovy duck parvovirus (MDPV). Based on the conserved regions of DTMUV E, DEV UL2 and MDPV VP3 genes, three pairs of specific primers and probes were designed and synthesized respectively. Furthermore, a triple q-PCR method was established based on the establishment of a single q-PCR method. The triple q-PCR method was used to detect 198 suspected samples from Jiangsu and Anhui. The results showed that the established TaqMan triple q-PCR method could detect these three viruses simultaneously. The detection sensitivity was at least 100 copies, the correlation coefficient (R2) was above 0.99, and the amplification efficiency ragned from 90% to 110%. At the same time, the detection results of H9N2 avian influenza virus (H9N2 AIV), duck hepatitis A virus type I (DHAV-1), Muscovy duck reovirus (MDRV), duck reovirus (DRV), Newcastle disease virus (NDV) and goose parvovirus (GPV) were negative, it showed that the method had the advantages of high specificity, high sensitivity fastness good repeatability. The sensitivity of triple q-PCR method was approximately 100 times greater than that of conventional PCR assay. The results of clinical suspected samples indicated that the detection rate DTMUV was highest, and mixed infections of three viruses were also common. This triple TaqMan q-PCR assay provides a fast, efficient, specific and sensitive tool for the detection of DTMUV, DEV, MDPV and also lays the foundation for clinical molecular epidemiological investigation and quantitative analysis.
Key words:duck Tembusu virus;duck enteritis virus;Muscovy duck parvovirus;TaqMan real-time fluorescence quantitative PCR
中国目前拥有世界上最大的水禽养殖量,在过去几十年中规模不断扩大且发展愈发快速[1]。随着水禽养殖规模和集约化程度的发展,与之伴随的是疫病的不断增多,而水禽疫病不仅是影响水禽饲养业的头号杀手,还是水禽产业健康发展的严重桎梏。其中,病毒性疫病成为水禽养殖业成功发展的最大障碍。由鸭肠炎病毒(Duck enteritis virus,DEV)感染引起的疾病称为鸭病毒性肠炎(Duck viral enteritis,DVE)或鸭瘟(Duck plague,DP)[2],是雁鸭科水禽中分布最广泛且最具破坏性的传染性病毒病之一,相对较高的死亡率,包括家养鸭和野鸭[3]在内的广泛的寄主范围,使其对水禽养殖仍具有不可忽视的威胁。鸭坦布苏病毒(Duck tembusu virus,DTMUV)引起的鸭坦布苏病毒病是近十年出现的一种新发水禽疫病,于 2010年从中国东部沿海地区开始,逐渐蔓延至全国大部分地区[4]。多个品种的鸭鹅均可感染,尤其对具有高经济效益的种鸭、种鹅和蛋鸭的危害最为明显,引起严重的产蛋下降,给鸭养殖业造成了巨大经济损失[5]。番鸭细小病毒(Muscovy duck parvovirus,MDPV)引起的番鸭细小病毒病主要见于三周龄内的雏番鸭,根据年龄的不同,死亡率最高可达80%[6]。番鸭细小病毒病在中国番鸭养殖区域普遍存在,具有极高死亡率和发病率,一旦发生,会造成水禽养殖业的巨大经济损失。准确迅速诊断这些疫病是开展相应防控工作的基石,q-PCR技术具有特异性强、灵敏度高、简便、快速、易操作、可定量分析等优点,建立单重或多重的q-PCR检测方法并应用于临床样本的鉴别诊断,不仅可分析病毒核酸在动物体内的含量,有助于临床诊断和分子流行病学调查,还可有助于病毒分离鉴定,为上述疫病的研究和防控提供技术保障。
1材料与方法
1.1主要材料与仪器
PurePlasmid Mini Kit质粒提取试剂盒购自CWBIO公司,AxyPrep DNA Gel Extraction Kit凝胶回收试剂盒购自AXYGEN公司,Premix Ex Taq(Probe qPCR)、Premix Taq(TaKaRa Taq version 2.0 plus dye)DNA酶、MiniBEST Viral RNA/DNA Extraction Kit Ver 5.0 RNA/DNA提取试剂盒、PrimeScript RT Master Mix反转录试剂盒、EASY Dilusion(for Real time PCR)引物稀释液均购自宝生物工程(大连)有限公司。DNA marker、E.coli DH5α购自天根(北京)生化科技有限公司,克隆载体pGEM T-easy购自Promega公司, FastPrep-24 5G高速匀浆仪购自美国MP公司,Veriti PCR仪和QuantStudio 3 Real-time PCR System均购自美国应用生物系统公司(Applied biosystems)。
1.2引物设计合成和毒株
根据GenBank已公开发表的DTMUV E基因(GenBank登录号:AB110492.1),DEV UL2基因(GenBank登录号:JQ248597.1),MDPV VP3基因(GenBank登录号:AF166110.1)设计了3套引物和探针(表1),本研究中由于引物和探针的位置高度保守,因此并不涉及区分野毒株及疫苗株。引物和探针均由英潍捷基(上海)有限公司合成。
DTMUV由中国农业科学院上海兽医研究所馈赠,DRV和番鸭呼肠孤病毒(MDRV)由福建省农业科学院惠赠,H9亚型禽流感病毒(H9N2 AIV)由扬州大学兽医学院馈赠,DEV、鸭甲肝病毒I型(DHAV-I)、新城疫病毒(NDV)、MDPV、鹅细小病毒(GPV)为本实验室分离并保存。
DTMUV、DEV、MDPV分别为鸭坦布苏病毒、鸭肠炎病毒、番鸭细小病毒。
1.3核酸的提取及反转录
将-80 ℃保存的组织样品剪碎,与PBS以1∶9的比例(质量比)加入到2 ml研磨管中,利用FastPrep-24 5G高速匀浆仪将组织样品匀浆,12 000 r/min离心10 min,吸取上清液。参照TaKaRa MiniBEST Viral RNA/DNA Extraction Kit Ver 5.0提取试剂盒说明书提取病毒RNA和DNA,并依据此方法对DHAV-Ⅰ、DTMUV、MDRV、DRV、DPV、DEV、NDV、H9N2 AIV进行核酸提取。参照TaKaRa PrimeScript RT Master Mix反转录试剂盒说明书对DTMUV、DHAV-Ⅰ、MDRV、DRV、NDV、H9N2 AIV进行RNA的反转录。反转录体系如表2所示,反应条件:37 ℃ 15 min,85 ℃ 5 s,4 ℃保存。反转录所得的cDNA置于-80 ℃保存。
1.4重组质粒标准品的构建
以DTMUV的cDNA,DEV、MDPV的DNA为模板,对E基因、UL2基因、VP3基因进行常规PCR扩增,扩增产物经1.5%琼脂糖凝胶电泳,凝胶回收参照AxyPrep DNA Gel Extraction Kit试剂盒说明书进行,回收目的片段后连接至pGEM T-easy载体,再转化至E.coli DH5α。将阳性克隆菌送至上海英潍捷基贸易有限公司进行测序。质粒的提取参照康为世纪PurePlasmid Mini Kit高純度质粒小提试剂盒说明书进行,提取的质粒用微量蛋白核酸定量仪测定质粒含量,使用下式计算重组质粒的拷贝数[7]:
质粒拷贝数=(6.02×1023)×(质粒含量×10-9)质粒长度×660
为建立3种病毒的标准曲线,对每个质粒进行10倍梯度稀释,从1 μl 1×107拷贝至1×101拷贝。而对于多重荧光定量PCR标准曲线,将3种重组质粒稀释到1 μl 3×108 拷贝 ,同体积合并后得到1×108 拷贝的混合质粒,然后将合并的质粒进行10倍梯度稀释后建立多重标准曲线。
1.5单重和多重q-PCR反应条件
单重q-PCR检测DTMUV、DEV和MDPV的反应体系如下:2×Premix Ex Taq(Probe qPCR) 10.0 μl,50×ROX Reference Dye 0.4 μl,上、下游引物和探针(10 μmol/L)0.5 μl,DNA模板1.0 μl,灭菌超纯水7.1 μl。在QuantStudio 3 Real-time PCR系统的反应条件为预变性95 ℃ 30 s;95 ℃ 10 s,62 ℃ 30 s,40个循环。
多重q-PCR反应体系:10.0 μl 2×Premix Ex Taq(Probe qPCR),0.4 μl 50×ROX Reference Dye,1.0 μl DNA模板及引物、探针、灭菌超纯水组合成20.0 μl反应体系。同时对引物和探针含量不断优化以获得更好的反应结果。多重反应的反应条件与单重反应相同,无S型扩增且Ct值高于36均判定为阴性。
1.6多重q-PCR灵敏度、特异性和重复性试验
为了明确多重q-PCR的灵敏度,将上述重组质粒标准品在无核酸酶的水中进行10倍梯度稀释含量为1×107拷贝至1×101拷贝,稀释后的标准品用作q-PCR的扩增模板。
为了确定多重q-PCR的特异性,提取了鸭主要疫病病原DNA或cDNA并作为扩增模板,主要包括H9N2 AIV、DRV、GPV、NDV、MDRV、DHAV-Ⅰ,灭菌超纯水为阴性对照。
为了验证多重q-PCR的重复性,使用1×107拷贝至1×101拷贝10倍梯度稀释的标准质粒来分析组间及组内变异系数,组内重复和组间重复均为3次。
1.7临床样品采集和检测
2018年7月份至2019年8月份从江苏宿迁、睢宁、沛县以及安徽灵璧等地共采集198只死亡鸭及濒死鸭的组织样品,样品采集过程中严格遵守国家农业部于2016年修订的兽医诊断样品采集、保存与运输技术规范(NY/T 541-2016)中的要求,包括采样基本原则、采样前准备、样品采集与处理方法、样品保存与废弃物处理等。组织样品使用FastPrep-24 5G高速匀浆仪进行研磨,使用TaKaRa MiniBEST Viral RNA/DNA Extraction Kit Ver 5.0提取试剂盒提取病毒RNA和DNA,使用TaKaRa PrimeScript RT Master Mix反转录试剂盒反转录为cDNA,应用建立的多重q-PCR方法进行检测。同时使用本试验中的3对引物进行常规PCR检测,与单重q-PCR检测结果进行比较。
2结果
2.1单重q-PCR检测方法的建立
为建立多重q-PCR检测方法,首先建立并优化单重q-PCR检测方法。DTMUV用NED荧光基团标记,DEV使用FAM荧光基团标记,MDPV使用VIC荧光基团标记。使用10倍梯度稀释为1×107拷贝至1×101拷贝含量的质粒标准品构建标准曲线。结果表明,DEV的单一荧光定量PCR的灵敏度约为10拷贝(图1),DTMUV和MDPV单一荧光定量PCR灵敏度为100拷贝(图2、图3)。所有标准曲线均具有良好的相关系数及扩增效率:DTMUV(R2=0.999,E=92.6%),DEV(R2=0.999,E=95.6%),MDPV(R2=1.000,E=93.8%),这表明每种病毒的单重q-PCR检测方法是有效。
A和C表示单一q-PCR FAM荧光曲线,E=95.6%,R2=0.999,Slope=-3.431,Y-Inter=40.169;B和D表示多重q-PCR FAM熒光曲线,E=96.7%,R2=0.997,Slope=-3.403,Y-Inter=39.886。
A和C表示单一q-PCR NED荧光曲线,E=92.6%,R2=0.999,Slope=-3.512,Y-Inter=40.169;B和D表示多重q-PCR NED荧光曲线,E=90.2%,R2=0.998,Slope=-3.581,Y-Inter=43.572。
ction method and multiple fluorescence quantitative detection method for duck Tembusu virus
A和C表示单一 q-PCR VIC荧光曲线,E=93.8%,R2=1,Slope=-3.479,Y-Inter=39.567;B和D表示多重q-PCR VIC荧光曲线,E=93.4%,R2=1,Slope=-3.490,Y-Inter=41.517。
2.2多重q-PCR检测方法的建立
为建立针对多个病毒的多重q-PCR检测方法,将引物和探针的浓度在多重反应体系中进行优化,优化结果见表3。结果表明,多重q-PCR可以高效检测3种疫病的靶基因,每种病毒的检测灵敏度约为100拷贝。所有标准曲线均具有良好的相关系数及扩增效率(图4):DEV(R2=0.997,E=96.7%),DTMUV(R2=0.998,E= 90.2%),MDPV(R2=1.000,E=93.4%),这表明建立的多重q-PCR检测方法有效。
2.3多重q-PCR的灵敏度
将梯度稀释的质粒标准品(1 μl 1×107拷贝)进行q-PCR检测。结果显示,DTMUV可检测到1×101拷贝的质粒;MDPV、DEV可检测到1×102拷贝的质粒,1×101拷贝的标准质粒及阴性对照无荧光扩增。相同拷贝的标准质粒在单重和多重荧光定量的体系中Ct值有所不同,多重体系的Ct值要比单重体系的Ct值高0.2左右,这可能是由于多重荧光定量体系中不同引物和探针的相互影响造成的。常规PCR检测DTMUV、MDPV和DEV的灵敏度分别为1 μl 1×103拷贝、1×104拷贝和1×104拷贝,本试验建立多重q-PCR方法的灵敏度是常规PCR的100倍左右,因此检测已感染但无临床症状鸭同样可以得到准确结果。上述结果表明多重q-PCR方法灵敏度高。
A:DEV荧光标记 E=96.7%,R2=0.997,Slope=-3.403,Y-Inter=39.886;B:DTMUV荧光标记 E=90.2%,R2=0.998,Slope=-3.581,Y-Inter=43.572;C:MDPV荧光标记 E=93.4%,R2=1,Slope=-3.490,Y-Inter=41.517。
2.4多重q-PCR的重复性
选取10倍梯度稀释为1 μl 1×106~1×104拷贝的质粒标准品作为模板进行q-PCR。组内重复连续做3次,组间重复是在3个不同的时间分别做3次,每次3个重复。结果(表4)显示DEV的组内和组间变异系数分别为0.60%~1.40%和1.09%~3.22%;DTMUV的组内的变异系数为1.04%~2.28%,组间变异系数为1.66%~3.67%;MDPV组内和组间变异系数分别为1.02%~2.67%和1.28%~2.58%。因此,基于TaqMan探针的三重q-PCR检测方法重复性好。
2.5多重q-PCR的特异性
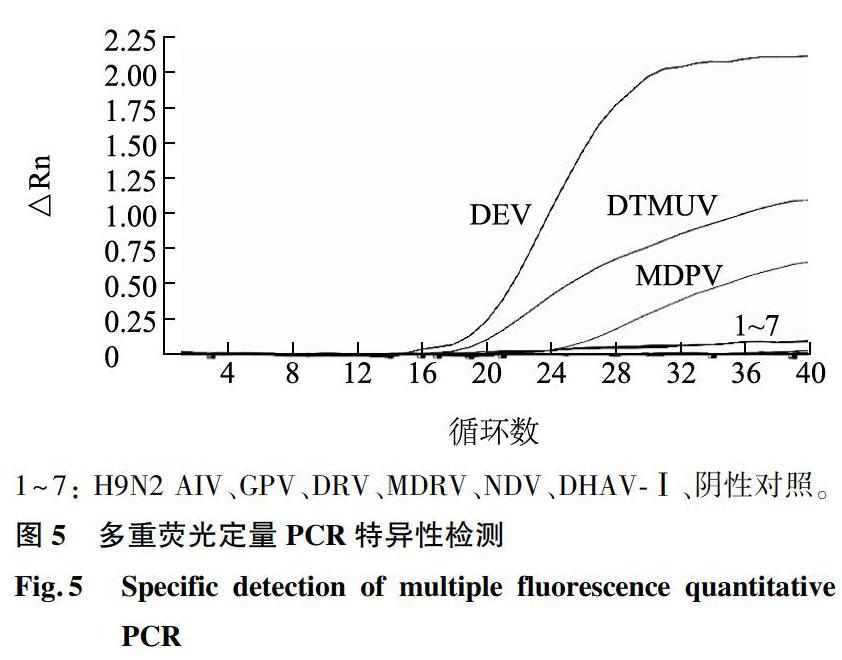
对DTMUV的cDNA,DEV和MDPV的DNA(阳性对照),无菌超纯水(阴性对照)以及H9N2 AIV、GPV、DRV、MDRV、NDV、DHAV-Ⅰ6种主要鸭病毒的DNA或cDNA进行多重q-PCR检测。结果表明,H9N2 AIV、GPV、DRV、MDRV、NDV、DHAV-Ⅰ 6种主要鸭病毒和阴性对照的检测结果均为阴性(未检测到荧光信号),而DTMUV、DEV、MDPV(图5)均可被检测到,说明建立多重q-PCR方法特异性强。
1~7: H9N2 AIV、GPV、DRV、MDRV、NDV、DHAV-Ⅰ、阴性对照。
2.6临床采集样品的检测结果
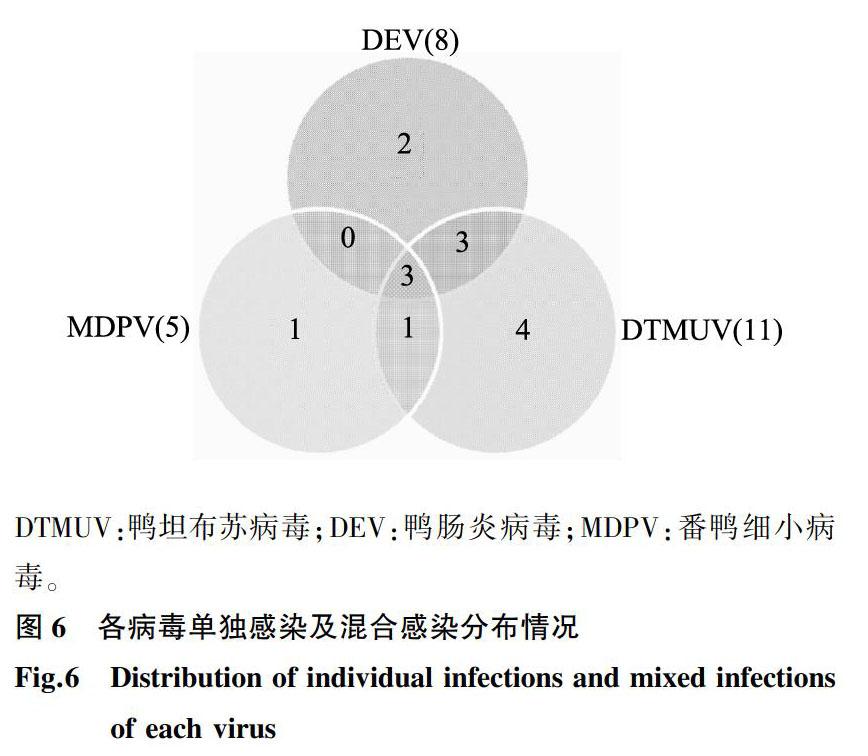
应用建立的多重q-PCR方法对临床采集的198份样品的DNA或cDNA进行检测,灵璧地区DTMUV、DEV和MDPV 3种病毒阳性率分别为8.3%(4/48),1.5%(3/48)和10.4%(5/48);沛县地区DTMUV的检出率为6.1%(5/82),其他2种病毒则没有检出;睢宁地区DTMUV和DEV的阳性率分别是2.9%(1/35)和8.6%(3/35);宿迁地区DTMUV和DEV的阳性率为1.5%(1/68)和2.9%(2/68);睢宁和宿迁地区均无MDPV检出。图6显示了在198份样品中3种病毒的单独感染、混合的情况,图中数字表示三重q-PCR核酸检出阳性的样品数量,并集部分为核酸检出阳性的混合感染数量。198份疑似组织病料同时运用常规PCR方法进行了检测,安徽地区DTMUV、DEV 和MDPV阳性检出率分别为6.25%(3/48),6.25%(3/48)和8.33%(4/48),江苏沛县DTMUV的检出率为4.87%(4/82),同样无DEV、MDPV检出。江苏睢宁和宿迁临床样品常规PCR检测结果与q-PCR检测结果一致。由此可见,q-PCR方法较常规PCR方法更加准确可靠。
DTMUV:鸭坦布苏病毒;DEV:鸭肠炎病毒;MDPV:番鸭细小病毒。
3讨论
DTMUV属于黄病毒属、黄病毒科,是一种单股正链RNA病毒,病毒基因组编码包括衣壳(C)、前膜(PrM)、后膜(M)和包膜(E)及7个在3′末端编码的非结构(NS)蛋白(即NS1,NS2A,NS2B,NS3,NS4A,NS4B和NS5)[8-11]。DEV属于疱疹病毒科马立克病毒属的DNA囊膜病毒,DEV能引起鸭一种急性、热性、败血性、高度传染性疫病,不同日龄的鸭均可感染[12-13]。DEV侵入机体后首先攻击机体的免疫器官, 导致机体细胞免疫和体液免疫受到严重的破坏,所以病毒感染机体后容易引起免疫抑制和其他病毒继发感染而加快死亡[14]。MDPV属于细小病毒科依赖病毒属的單链、线状、无囊膜 DNA 病毒[15-16],主要感染 1~3周龄雏番鸭,俗称“三周病”,依据年龄的不同,致死率高达50%~80%[17]。
随着中国水禽养殖规模日益扩大,及时准确检测和诊断水禽病毒病是疫病监测和防控的重要组成部分。目前,水禽病毒病的检测诊断主要依靠临床症状、病理变化、血清学、常规PCR检测等方法[18-21],主要适应于检测单一感染,然而水禽病毒病常常表现为混合感染,常规检测难以准确判定。常规PCR方法仅用于病原定性,无法定量,并且伴随着交叉感染的风险(导致假阳性)和提取物质量差(导致假阴性)[22]等问题。
基于TaqMan探针的多重q-PCR是一种快速、高特异性、高灵敏度和高重现性的检测方法,是针对水禽养殖中单一病毒感染或多病毒混合感染最为快速且有效的检测方法。研究结果表明二重q-PCR检测方法已成功运用到水禽病毒性疫病检测中,张艳芳等[23]建立了DPV及DTMUV TaqMan二重荧光定量RT-PCR检测方法,2种病毒的检测灵敏度均可达100个拷贝;曾婷婷等[24]建立了DTMUV与产蛋下降综合征病毒二重TaqMan实时荧光定量RT-PCR检测方法,检测灵敏度为100个拷贝。本研究中建立的TaqMan三重荧光定量PCR检测方法,对DEV的检测灵敏度为10个拷贝,对DTMUV及MDPV的检测灵敏度为100个拷贝,比常规PCR灵敏度高100倍左右。该方法中建立的3个标准曲线具有良好的相关性和扩增效率,相关系数都在0.997以上,扩增效率为90%~110%,从1×107~1×102拷贝的质粒均呈良好的线性关系。从样品研磨处理开始,大概3~4 h可以得到检测结果。这相比于血清学检测方法速度快、准确性高、操作简便、敏感性高、重复性好、特异性强,因此非常适合多病毒共感染的诊断、定量分析及流行病学监测,为临床上DEV、DTMUV、MDPV的快速诊断及分子流行病学调查提供了有效手段。
参考文献:
[1]GUO Y F, CHENG A C, WANG M S. Development of TaqMan MGB fluorescent real-time PCR assay for the detection of anatid herpesvirus 1[J]. Virology Journal, 2009, 6(1):71.
[2]SANDHU T S, SHAWKY S A. Duck virus enteritis (Duck plague) [M]. Iowa State Press: Diseases of Poultry 11th edition,2003: 354-363.
[3]MONTGOMERY R D, STEIN G J R, NOVILLA M N, et al. An outbreak of duck virus enteritis (duck plague) in a captive flock of mixed waterfowl[J]. Avian Dis, 1981, 25: 207-213.
[4]LIU P, LU H, LI S, et al. Duck egg drop syndrome virus:an emerging Tembusu-related flavivirus in China[J]. Sci China Life Sci, 2013, 56(8): 701-710.
[5]赵冬敏,黄欣梅,刘宇卓,等. 新型黄病毒在种鹅中垂直传播的研究[J]. 南方农业学报, 2012, 43(1): 99-102.
[6]WANG J, LING J, WANG Z, et al. Molecular characterization of a novel Muscovy duck parvovirus isolate: evidence of recombination between classical MDPV and goose parvovirus strains[J]. BMC Vet Res, 2017, 13: 327.
[7]HUANG Y L, PANG V F, PAN C H, et al. Development of a reverse transcription multiplex real-time PCR for the detection and genotyping of classical swine fever virus[J]. J Virol Methods, 2009,160(1/2):111-118.
[8]ZHANG W, CHEN S, SURESH M, et al. An updated review of avian-origin Tembusu virus: a newly emerging avian Flavivirus[J]. Journal of General Virology, 2017, 98:2413-2420.
[9]GUZMAN M G, HALSTEAD S B, ARTSOB H, et al. Dengue: a continuing global threat[J]. Nat Rev Microbiol, 2010, 8: 7-16.
[10]BECKER N, JST H, ZIEGLER U, et al. Epizootic emergence of Usutu virus in wild and captive birds in Germany[J]. PLoS One, 2012, 7(32): 604.
[11]BALTIMORE D. Expression of animal virus genomes[J]. Bacteriol Rev,1971, 35: 235-241.
[12]程安春. 鴨瘟[M]. 北京: 中国农业出版社, 2015.
[13]LI Y, HUANG B, MA X, et al. Molecular characterization of the genome of duck enteritis virus [J]. Virology, 2009, 391(2):151-161.
[14]刘忠伟,杨颖,江楠,等. 鸭瘟强毒人工感染雏鸭的显微和超微病理学变化[J]. 江苏农业科学, 2017, 45 (16):140-147.
[15]刘家森,姜骞,司昌德,等. 番鸭细小病毒与鹅细小病毒PCR鉴别诊断方法的建立[J]. 中国兽医科学, 2007, 37(6):469-472.
[16]WANG J, LING J, WANG Z, et al. Molecular characterization of a novel Muscovy duck parvovirus isolate: evidence of recombination between classical MDPV and goose parvovirus strains[J]. BMC Vet Res, 2017, 13: 327-329.
[17]WAN C, CHEN H, FU Q, et al. Genomic characterization of goose parvovirus and Muscovy duck parvovirus coinfection in Fujian[J]. China Kafkas Univ Vet Fak Derg, 2015, 21(8): 929-934.
[18]CHENG A, HAN X, ZHU D, et al. Application of indirect immuno-fluorescent staining method for detection and antigen location of duck enteritis virus in paraff in sections[J]. Chin J Vet Sci, 2008, 28: 871-875.
[19]刘玉伟,辛长勋,王硕,等.山东省鸭类感染猪圆环病毒3型的初步调查[J].山东农业科学,2018,50(5):126-128.
[20]王永娟,董亚青,郭方超,等.鸭源H9N2亚型禽流感病毒RT-PCR检测方法的建立[J].江苏农业科学,2018,46(1):105-106,115.
[21]张艳雯,何永权,吴云月,等. 广西鸡源H9N2亚型禽流感病毒分离鉴定及遗传进化分析[J].南方农业学报,2018,49(4):780-786.
[22]HANSEN W R, BROWN S E, NASHOLD S W, et al. Identification of duck plague virus by polymerase chain reaction[J]. Avian Dis, 1999, 43(1):106-115.
[23]张艳芳,谢芝勋,谢丽基,等. 鸭坦布苏病毒和鸭瘟病毒二重荧光定量RT-PCR方法的建立[J]. 中国畜牧兽医,2014,41(3):77-82.
[24]曾婷婷,谢芝勋,谢丽基,等. 应用二重实时荧光定量RT-PCR鉴别坦布苏病毒与产蛋下降综合征病毒[J]. 中国家禽, 2015, 37(1):17-21.
(责任编辑:陈海霞)
