一种双通道荧光扫描同步探测系统的设计
2020-07-23祁建城李玲君杜耀华
陈 盟,祁建城,李玲君,杜耀华,程 智,李 抄
(军事科学院系统工程研究院卫勤保障技术研究所,天津300161)
0 引言
微生物是自然界的重要组成部分,主要包括细菌、真菌、病毒及原生生物等,其中细菌种类繁多、新陈代谢活跃且生长繁殖迅速,是微生物的主要组成类群。随着经济的高速发展,细菌对人类生活的重要影响愈来愈凸显。一方面,致病性细菌,如致病性大肠杆菌、志贺氏菌、金黄色葡萄球菌等能引发人、动物或植物的多种疾病,它们常通过空气、食品、水、土壤等非生物媒介及生物媒介传播,能在短时间对环境、水质、生产产品等造成污染,是环境卫生监控、食品生产制造、医药工业、实验研究等领域卫生控制工作的一大难题[1-4];另一方面,多种细菌,如乳酸菌、酵母菌、甲烷菌、大肠杆菌等被广泛应用于疾病治疗、生产制造、污水净化及生物科技研究等领域,取得了不容忽视的成果[5-7]。因此,对细菌活细胞和死细胞的快速区分检测在细菌生物学研究、消毒灭菌评价、工业制造、食品药品生产等科学领域具有重要意义。
目前,常见的活/死菌区分检测方法主要包括基于具有DNA 亲和性的叠氮类染料的聚合酶链式反应(polymerase chain reaction,PCR)检测技术、以信使RNA(mRNA)分子为检测靶标的逆转录聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)检测技术以及基于双色荧光区分染色的荧光检测技术[8]。
传统的基于DNA 为检测靶标的PCR 扩增检测技术无法区分活/死菌DNA,在实验中会对细菌的DNA 进行无差别扩增,易导致检测结果的假阳性率增加。叠氮溴化乙锭(ethidium monoazide bromide,EMA)和叠氮溴化丙锭(propidium monoazide,PMA)是一种具有高亲和力的DNA 结合染料,与核酸共价结合后能发出强荧光信号。同时,EMA 和PMA 不具有细胞膜透性,只能选择性渗透活/死菌菌群内的死细胞,与死菌的核酸结合从而抑制其DNA 扩增,活菌DNA 则可正常参与扩增[9]。研究表明该方法在活/死菌区分检测中能有效降低检测假阳性率,检测结果准确可靠[10]。
随着PCR 检测技术的不断发展,以细菌mRNA分子为模板进行逆转录和PCR 扩增的RT-PCR 技术、逆转录环介导等温扩增(reverse transcription-loopmediated isothermal amplification,RT-LAMP)技术也可对活菌进行选择性检测[11-12]。核酸扩增检测技术成熟度高,可在几小时内得出检测结果,但是该技术也存在一些缺点,如样本核酸制备复杂、对操作人员专业能力要求较高、检测成本高等。
活/死菌荧光染色技术是一种利用荧光染料光谱特性和细胞膜透性的不同来实现活菌和死菌细胞区分标记的技术手段,其灵敏度高、操作简便,广泛应用于各个领域的科学研究及辅助诊断等工作。荧光染色标记技术与荧光显微镜、流式细胞仪和固相激光扫描仪等荧光检测仪器联合使用,可用于检测识别及定量分析活/死菌。荧光显微镜及流式细胞仪是常见的微生物检测设备,具有检测准确、快速的优点,但是检出限高,在微量细菌样本的检测中存在一定的局限性。基于固相细胞计数法的激光扫描系统可实现对单个微生物细胞的快速检测,如法国梅里埃公司研制的ChemScan 激光扫描检测系统可在3 min内扫描整个滤膜,检测结果准确性高、耗时短[13]。然而,该仪器只配备了单一的氩离子激光光源,因此荧光染料和探针的选择相当有限,其荧光特性需满足激发波长约488 nm 且发射光在500~530 nm 范围的要求,同时在对双色荧光标记样本进行检测时,该仪器不能充分检测样本的荧光信号[14]。
常见的荧光检测设备对双色荧光标记样本的检测通常需要切换激光激发光源及荧光探测通道,耗时至少是单一检测的2 倍,且2 次检测的区域会产生一定偏差,易造成检测结果的误差。目前,关于双激光源同步扫描检测系统的相关报道较少见。因此,基于活/死菌细胞快速检测分析的需求,本文提出了一种双通道荧光扫描同步探测系统。本系统以双色荧光标记样本为检测对象,通过2 路激光光束同时扫描样本以及双通道荧光信号同步探测,从而完成对样本的自动扫描检测,有效缩短了检测时间,可快速实现对活/死菌的准确识别以及定量分析。
1 设计思路
SYTO9 和碘化丙啶(propidium iodide,PI)是一组常见的核酸染料,与细胞内DNA 结合后其荧光效率会增加几十至几百倍,在适宜波段激光的激发下会产生相对于背景明亮的绿色荧光或红色荧光。由于SYTO9 和PI 的光谱特性和穿透细胞膜的能力不同,且两者之间光谱分离度高,所以二者混合使用可以达到显著区分标记样本中死细胞和活细胞的目的。实际应用中,将SYTO9 和PI 以适当比例混合对样本进行染色,由于SYTO9 分子量小,可进入活/死细胞与其DNA 结合,而PI 则只能进入细胞膜破损的死细胞且PI 对DNA 的亲和力要高于SYTO9,因此在合适激光激发下活细胞发出绿色荧光,而死细胞发出红色荧光。该方法广泛应用于各种样本中的死/活细胞定量检测,效果良好[15-16]。
本研究基于SYTO9 与PI 的激发/发射特性,选取合适的激发光源,并完成系统光路设计。检测系统允许2 束激光同时对检测区域进行扫描,染色细胞经激发发出荧光信号,荧光探测通道同时采集绿色/红色荧光信号,通过数据采集卡将其转化为数字信号上传至计算机,通过分析处理数据实现对活/死菌的定量计数。
2 系统设计
2.1 光路设计
双通道荧光扫描同步探测系统结构如图1 所示。本系统主要由2 个不同波长的激光器、扩束镜、二维振镜、扫描透镜、比例分光镜、聚焦镜、分色镜、滤光片、光电倍增管(photomultiplier tube,PMT)以及共焦微孔组成。其中,扩束镜用于扩展激光束的直径,初步设计将激光束扩大3 倍(可调节);共焦微孔的作用主要为消除来自激发光源和扫描背景的杂散光[17]。
在系统光路设计中,根据荧光染料特性,荧光激发光源选取一个主波长476 nm(蓝光)的半导体激光器(MBL-III-476,长春新产业光电技术)和一个主波长532 nm(绿光)的半导体激光器(MGL-DS-532,长春新产业光电技术),满足双光源设计需求;此外,为避免532 nm 激发光对SYTO9 发出的绿色荧光信号产生影响,将2 个激发光源在空间上设置为互相错位,从而实现2 个激光源同时对检测区域进行扫描。同时,采用双振镜扫描检测方式同时对检测区域进行X-Y二维扫描检测[18]。在扫描振镜与被测样品之间设置一个扫描透镜,以达到扫描光束聚焦和激发荧光信号高效收集的目的。
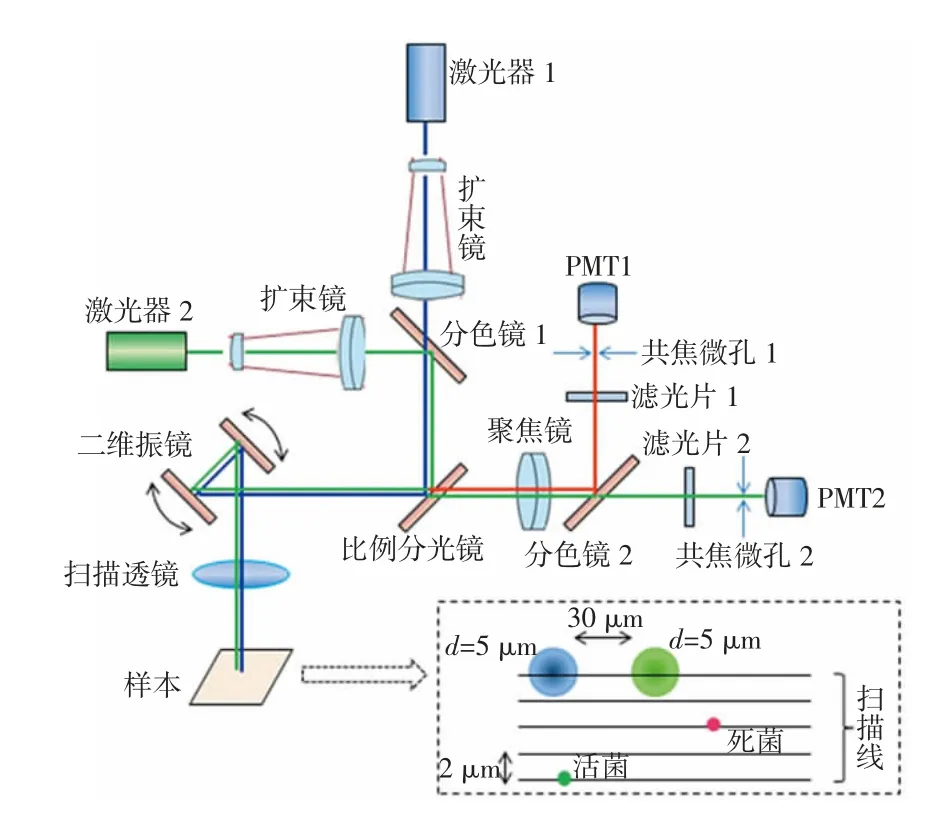
图1 双通道荧光扫描同步探测系统结构示意图
扫描检测过程中,2 个激光束经过扩束整形后获得高质量激光束,然后经分色镜和比例分光镜作用,光束与光轴成45°入射到二维振镜,激光光束经二维振镜反射后由扫描透镜(LSM03-VIS,Thorlabs)聚焦到检测平面,在扫描检测平面上形成2 个直径约5 μm 的高斯光斑。活/死菌染色样本在激光照射下发出绿色/红色荧光,激发荧光通过扫描透镜成为平行光束,而后经二维振镜反射,通过高透射率(80%)、低反射率(20%)的比例分光镜透射,接着通过聚焦镜将荧光光束聚焦于二向分色镜,红/绿二向分色镜将红/绿荧光分成2 条不同方向的光路。随后,经二向分色镜透射的绿色荧光通过一个中心波长530 nm、带宽30 nm 的带通滤光片,消除直接散射光,而后通过孔径10 μm 的共焦微孔,进一步消除杂光干扰,最后荧光到达PMT;经二向分色镜反射的红色荧光通过一个起始波长为570 nm 的长通滤波器和孔径10 μm 的共焦微孔,到达另一个PMT。PMT将采集到的信号放大后,通过数据采集卡将模拟信号转换为数字信号上传至计算机,便于后续进行信号处理。
系统设计中,5 μm 直径的激光光斑不仅确保了扫描系统的高空间分辨力和大景深(约0.21 mm),同时有利于消除检测样本的表面不平整对光学信号聚焦产生的影响;由于2 个光斑在X轴方向相距30 μm,使得红、绿荧光的探测存在30 μm 的空间差,但这个差值是固定的,可以通过系统标定和数据修正实现双色荧光图像的100%配准和双重荧光染色样本的双通道激光扫描及同步探测。此外,由于比例分光镜的反射率低,激发光利用率仅为20%,但随着半导体激光技术的发展,激光器的功率已经足够高,20%的光能利用率也足以激发目标荧光。同时,系统选用的红/绿二向分色镜对390~550 nm 范围内的光信号平均透射率可达90%以上,对584~800 nm 范围内的光信号平均反射率可达95%以上,可以有效分离绿色荧光信号和红色荧光信号。
2.2 扫描模式设置
本研究中选取Thorlabs 的GVS012-2D 大光束(10 mm)直径振镜系统,可通过控制驱动电动机带动2 个反射镜高速振动,从而将入射激光束反射到特定检测区域内的任意点,实现对检测平面的快速扫描。根据系统设计要求,对二维振镜的控制系统进行设置:设置2 路输出控制波形为三角波,其中一路控制信号为100 Hz、T=10 ms,另一路控制信号为0.05 Hz、T=20 s;X、Y方向振镜的电压幅值为1.0 V,扫描视场为5 mm×5 mm;激光束在X方向的扫描频率为50 Hz,并以0.5 mm/s 的速度扫描检测区域,因此激光束在X方向的扫描线长度为5 mm,扫描线在Y方向的扫描频率为0.05 Hz,其行间距为2 μm;采集卡采样速率为1×106次/s。这样的参数设置能确保对检测区域的充分扫描,使激光束对检测范围内的任一点至少可以扫描2 次(扫描示意图如图1 所示)。
2.3 软件算法设计
针对系统扫描检测控制需求编写LabVIEW 程序,用于输出二维振镜控制信号,使2 个维度的扫描振镜协同工作,同时实现对红色、绿色双通道荧光信号的高速、同步采集。LabVIEW 程序流程如图2 所示,主要包括2 路输出设置、2 路输入设置和文件保存功能。
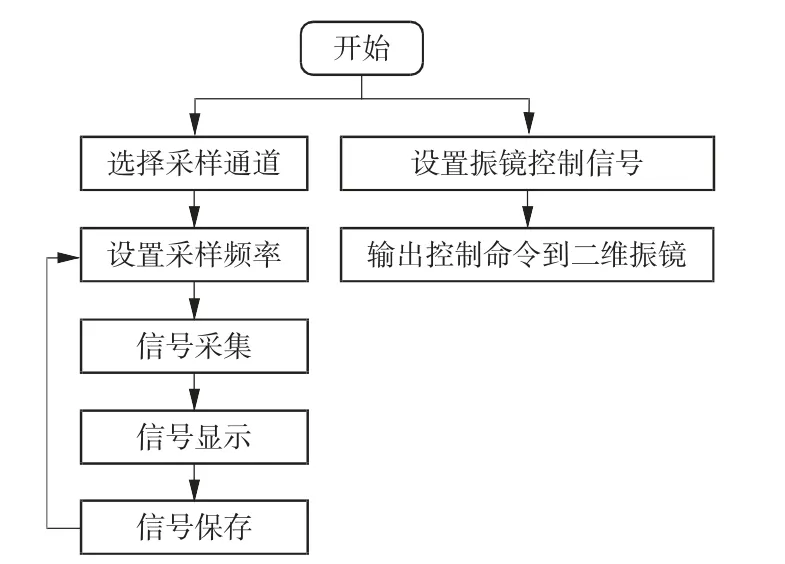
图2 LabVIEW 程序流程图
信号处理算法是基于MATLAB 编程完成的。该算法对上传至计算机的2 路荧光信号数据进行处理,提取有效信号,计算被不同荧光染料标记的细胞数量,并对扫描信号进行二维重构、融合,然后将检测结果直观显示出来,为操作者提供参考依据。在对被测细菌样本中活菌和死菌的荧光信号提取中,由于细菌形态不规则且染色细菌的荧光信号微弱,采集到的原始数据信噪比较差,所以首先需要对一维信号进行滤波处理,滤除来自背景或反射杂光的干扰信号。在此基础上,基于经典阈值分割算法能快速、有效实现图像背景与目标分离的优点,先使用拉普拉斯算子改善二值图像边缘信息,然后提出基于阈值分割算法的阈值分割结合边缘检测的目标提取算法,即使用Ostu 全局阈值分割算法结合Sobel 梯度算子实现对活/死菌荧光信号的准确提取与计数。为直观输出检测结果,通过荧光分布图像和散点图将结果直接展示出来。信号处理算法流程如图3 所示。
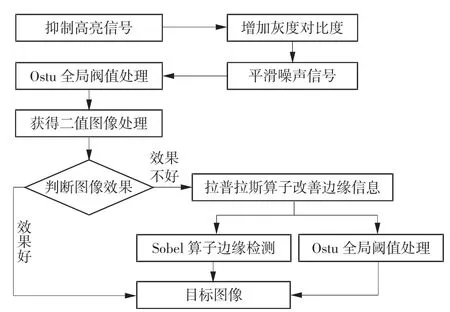
图3 信号处理算法流程图
3 性能测试
3.1 材料和方法
3.1.1 材料
4 μm 粒径绿色荧光微球(PSGF04000)、4 μm 粒径红色荧光微球(PSRF04000)[中科雷鸣(北京)科技有限公司],白色葡萄球菌(ATCC 8032),荧光染色试剂[L7012,赛默飞世尔科技(中国)有限公司,包含核酸染料SYTO9 和PI 染料],一次性细胞计数板(深圳创怀医疗科技有限公司),荧光显微镜(国家生物防护装备工程技术研究中心)。
3.1.2 方法
3.1.2.1 荧光探测性能测试
使用荧光微球对系统的双通道荧光探测性能进行初步测试:(1)用无菌纯净水对荧光微球悬液做10倍稀释,至荧光显微镜下一个视野内的荧光点清晰可见;(2)取4 μl 荧光微球样本加入细胞计数片中;(3)将样本放置于双通道荧光扫描同步探测系统中进行扫描检测。
3.1.2.2 荧光显微镜对照实验
以荧光显微镜为对照,进行细菌染色后荧光检测对照实验:(1)准备1×105cfu/ml 浓度梯度的白色葡萄球菌菌悬液;(2)取3 μl SYTO9 染料与1 ml 细菌悬液混合均匀,室温下避光孵育15 min;(3)取4 μl染色样本加入细胞计数片中,分别使用荧光显微镜和双通道荧光扫描同步探测系统进行检测;(4)对比分析检测结果。
3.1.2.3 活/死菌混合样本扫描检测
配制不同活/死菌比例的细菌悬液样本,对系统定量检测活/死菌的性能进行评价:(1)参考LIVE/DEAD®BacLightTMBacterial Viability Kits 用户手册制备活/死菌比例为1∶0、9∶1、1∶1、1∶9 及0∶1 的混合菌悬液(细菌浓度约为1×106个/ml);(2)取3 μl 混合染料(SYTO9∶PI=3∶4)与1 ml 细菌悬液混合均匀,室温下避光孵育15 min;(3)取4 μl 染色样本加入细胞计数片中,使用双通道荧光扫描同步探测系统进行检测;(4)每个样本取5 个检测区域的检测结果,计算扫描检测荧光分布图像中绿/红荧光亮点的比例,分析其与已知样本活/死菌比例的相关程度。
3.2 结果
3.2.1 荧光探测性能测试结果
荧光微球具有荧光强度高、发光性能稳定、不易淬灭的特点,实验中选择大小适宜、荧光光谱特征与SYTO9 和PI 相近的荧光微球对检测系统性能进行初步测试。绿色荧光微球的扫描检测结果如图4 所示。结果显示,绿色荧光通道能检测到较强的荧光信号,明显区分于背景信号,红色荧光探测通道基本无有效信号。红、绿荧光微球混合样本的扫描检测结果如图5 所示。结果显示,红/绿荧光探测通道均能检测到较强的荧光信号,说明双通道荧光扫描同步探测系统能有效实现红、绿荧光信号的同步扫描探测。
3.2.2 荧光显微镜对照实验检测结果
对1×105cfu/ml 浓度梯度的白色葡萄球菌菌悬液用SYTO9 染料进行染色,使用荧光显微镜及双通道荧光扫描同步探测系统进行检测,检测结果如图6 所示。可以看出,荧光显微镜与双通道荧光扫描同步探测系统获得的细菌荧光分布图像一致性高,同一参考位置细菌的数量和位置都有较高的重合度,说明本系统可靠性高。此外,对比2 种检测方法得到的荧光分布图像可知,双通道荧光扫描同步探测系统的空间分辨力不如荧光显微镜,但是其视场大、景深大,单次扫描测得的细菌数量远远多于荧光显微镜检测结果,在微生物检测计数的应用中具有一定优势。
3.2.3 活/死菌混合样本的扫描检测结果
对死菌、活菌含量不同的菌悬液样本进行双荧光染色,用双通道荧光扫描同步探测系统进行检测分析,得到的荧光分布图像如图7 所示。其中,散点图主要用于表示一个完整的扫描区域中活菌、死菌的数量关系。双通道荧光扫描同步探测系统测得的活/死菌比例分别与已知比例的相关分析结果如图8所示。结果表明,双通道荧光扫描同步探测系统测得的比例值与已知的活菌含量的相关程度高(R2=0.970 8),说明本系统能准确区分活/死菌。

图4 绿色荧光微球的扫描检测结果

图5 红、绿荧光微球混合样本的扫描检测结果
3.3 小结
本研究分别以荧光微球和荧光染色细菌作为检测对象,通过与荧光显微镜检测结果进行对照,对双通道荧光扫描同步探测系统的光路设计、系统准确性以及对活/死菌鉴别能力等方面进行了实验验证。结果表明,双通道荧光扫描同步探测系统可在10 s 内完成对5 mm×5 mm检测区域的扫描,整个样本前处理及检测处理过程可在20 min内完成,而ChemScan 激光扫描系统可在3 min 内扫描一个直径为25 mm 的滤膜,若对2 种荧光探针进行检测,理论上检测时间至少为6 min,因此双通道荧光扫描同步探测系统有效缩短了检测时间;与荧光显微镜对照,检测结果准确可靠;与常见的单一激光源的固相激光扫描系统相比,双通道荧光扫描同步探测系统配置了2 个激光源和相应的荧光探测通道,不仅增加了荧光染料及探针的选择范围,还初步满足对双色荧光同时激发和同步探测的要求,单次扫描即可获得双色荧光标记信息,能够实现对活/死菌的快速识别与计数。
4 结语
本研究立足于活/死菌快速检测的实际需求,结合双色荧光染色技术,针对检测对象的荧光特性设计双光源同步激发的荧光探测系统;采用空间错位的共焦设计方法,解决了双光源同步激发探测中互相干扰的问题;通过MATLAB 编程编写阈值分割结合边缘检测的目标提取算法,实现了对细菌荧光信号的准确提取与计数。本系统可对双色荧光信号进行同步探测分析,从而实现对活/死菌的准确识别和快速定量分析。与传统的荧光检测系统相比,双通道荧光扫描同步探测系统有效缩短了检测时间,提高了检测效率,在微生物活性检测及定量分析检测领域具有广阔的应用前景。考虑到实际应用中样本荧光染色过程易对染料造成污染,且荧光染料一般具有一定细胞渗透性,需要操作人员做好防护措施。下一步将研究设计一体化检测系统,将样本处理与扫描检测集成于检测设备中,从而减少人工操作、避免试剂污染,有效提高检测的自动化程度。

图6 SYTO9 染色细菌样本在双通道荧光扫描同步探测系统与荧光显微镜下的检测结果
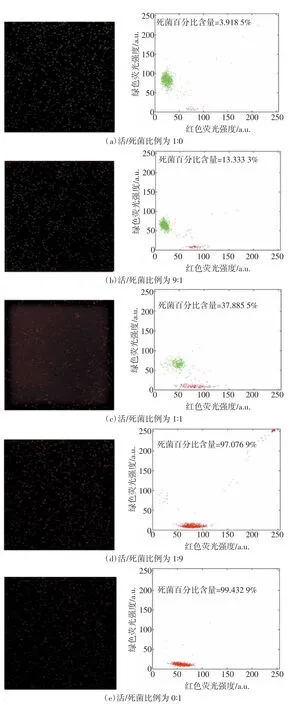
图7 不同活/死菌比例菌悬液的扫描检测结果
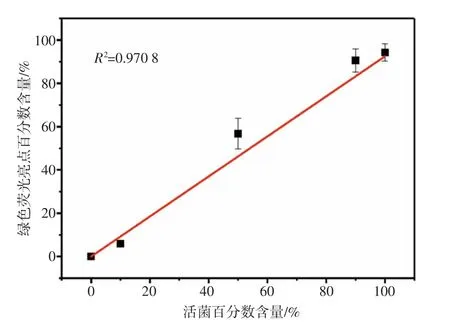
图8 双通道荧光扫描同步探测系统对不同活/死菌比例菌悬液样本的分析结果
