正常牛肉与DFD牛肉成熟过程中保水性和水分状态变化
2020-07-23孙文彬毛衍伟张一敏朱立贤梁荣蓉左惠心明丹丹牛乐宝
孙文彬,罗 欣,毛衍伟,张一敏,朱立贤,梁荣蓉,左惠心,明丹丹,牛乐宝*
(山东农业大学食品科学与工程学院,山东 泰安 271018)
肉的保水性是指肌肉受到外力作用时保持自身水和外加水分的能力。牲畜屠宰后,肌肉组织自身的纤维结构和鲜肉受到的不同冷却、包装、加工处理会对肉中水分分布产生影响,并最终影响鲜肉的保水性,低保水性会导致胴体质量降低,使生产商蒙受损失;此外,在商超出售时,肉表面渗出的汁液会降低消费者的购买欲望。因此鲜肉保水性的相关研究一直为企业和肉类科学家的关注重点。
牲畜屠宰后,肌肉内的酶受到肌糖原无氧酵解产生的乳酸的抑制作用,使肌糖原不能继续分解,pH值不再下降,此时肌肉的pH值称为极限pH值。DFD(dark, firm and dry)牛肉是由于肉牛宰前受到应激导致体内肌糖原含量降低,因此产生的乳酸不能使肌肉极限pH值下降到正常范围内的一种异质肉[1]。相比于正常牛肉,DFD牛肉极限pH值高、肉色紫黑、风味差且适宜微生物生长,货架期短[2]。虽然如此,DFD牛肉却具有良好的保水性,因此研究DFD牛肉成熟过程中水分状态的变化并阐明DFD牛肉保水性好的原因,可为改善正常肉与肉制品的保水性提供新的思路。
肉在成熟过程中,结合水、不易流动水和自由水的状态和比例会发生变化,并因此影响生鲜肉的保水性[3]。低场核磁共振(low-field nuclear magnetic resonance,LF-NMR)技术可以通过检测肉中氢质子的存在状态反映肉中不同状态水分的自由度和相对含量[4],此外核磁共振成像也可通过亮度来表征肉中氢质子密度,直观反映水分的变化。目前已有基于LF-NMR技术测定正常猪肉在成熟过程中水分状态和迁移的研究,但DFD牛肉成熟过程中的水分状态变化研究仍鲜见报道。
因此,本研究选取不同极限pH值的牛背最长肌为研究对象,分别测定成熟3、7、14 d和21 d的保水性变化,并通过LF-NMR技术探究其水分状态和迁移规律,同时测定成熟过程中肌节长度和细胞外空间的变化,以期从水分状态和肌肉组织角度解释DFD牛肉保水性较好的原因,并为提高正常牛肉制品的保水性提供理论指导和技术参考。
1 材料与方法
1.1 材料与试剂
本实验材料选取来自同一育肥场的鲁西黄牛×西门塔尔杂交牛(24 月龄)。
蔗糖、无水乙醇、二甲苯、氨水、中性树胶(均为分析纯) 国药集团化学试剂有限公司;苏木精染液套装 武汉谷歌生物科技有限公司。
1.2 仪器与设备
DM-6801A数字温度计 深圳胜利高电子科技有限公司;SenvenGo pH计 瑞士梅特勒-托利多仪器有限公司;C200真空包装机 德国Multivac公司;DK-S28电热恒温水浴锅 上海精宏实验设备有限公司;T18高速分散机 德国IKA公司;BX41生物显微镜 日本奥林巴斯公司;ToledoAB-104N分析天平 瑞士梅特勒-托利多仪器有限公司;NMI20-015V-1核磁共振成像分析仪上海纽迈电子科技有限公司;JJ-12J脱水机、JB-P5包埋机、JB-L5冻台 武汉俊杰电子有限公司;RM2016病理切片机 德国徕卡仪器有限公司;KD-P组织摊片机浙江省金华市科迪仪器设备有限公司;GFL-230烤箱天津市莱玻瑞仪器设备有限公司;Eclipse E100正置光学显微镜、DS-U3成像系统 日本尼康公司。
1.3 方法
1.3.1 原料处理与分组
在重庆某商业屠宰厂按照标准屠宰工艺屠宰后,监测宰后胴体背最长肌pH值变化,根据监测的pH值选定DFD牛肉与正常牛肉背最长肌各6 条(当牛肉极限pH值大于6.09时,品质会产生较大差异[5],因此本实验以宰后24 h时pH值在5.4~5.6范围内的牛肉确定为正常牛肉,pH值不低于6.10的牛肉确定为DFD牛肉),0~4 ℃黑暗冷库冷却成熟48 h后进行分割,取左半胴体背最长肌真空包装后在24 h内0~4 ℃低温环境运往实验室,分切为2.54 cm厚的牛排后,真空包装置于0~4 ℃黑暗冷库中继续成熟,分别在各个时间点随机取出牛排分割为小块进行后续指标测定。
1.3.2 指标测定
1.3.2.1 pH值的测定
使用SenvenGo pH计分别对宰后24 h,成熟3、7、14 d及21 d的牛背最长肌pH值进行测定,其中宰后24 h的pH值测定位置为牛背最长肌12~13肋骨间,pH计探头插入肉中深度约3 cm;成熟3、7、14、21 d则对分割好的牛排进行测定,均连续测定3 次取平均值。
1.3.2.2 汁液损失率的测定
汁液损失率参考Honikel等[6]的方法测定,分别对成熟3、7、14 d和21 d的牛排进行取样,将样品切割成5 cm×3 cm×2 cm的肉块,样品避免脂肪和筋腱,称质量(m1/g)后,用铁丝钩住肉块一端,悬挂于聚乙烯塑料袋中(样品不得与塑料袋接触),扎紧袋口后置于0~4 ℃黑暗冷库中,悬挂24 h后取出肉样,用滤纸擦干肉样表面水分后称质量(m2/g),重复3 次取平均值。汁液损失率按公式(1)计算。
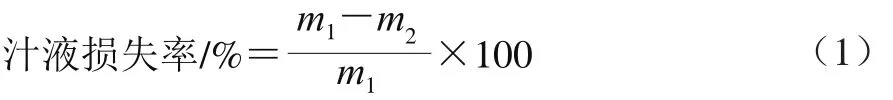
1.3.2.3 贮藏损失率的测定
贮藏损失率的测定参考Liu Yuqing等[7]的方法,在成熟3 d时,将背最长肌分割为2.54 cm厚的牛排,称质量(m3/g)并记录,真空包装后置于环境温度为0~4 ℃的冷库中避光贮藏,分别在成熟7、14 d及21 d取出牛排,用滤纸吸干肉块表面汁液,再次称质量(m4/g),重复3 次取平均值。贮藏损失率按公式(2)计算。
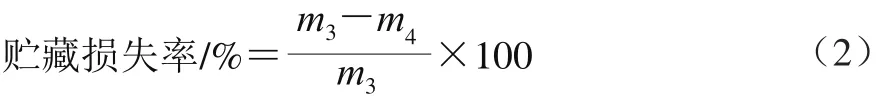
1.3.2.4 蒸煮损失率的测定
蒸煮损失率的测定参考Liu Yuqing等[7]的方法,取用成熟3、7、14 d及21 d的牛排,称质量(m5/g),然后在牛排中心处插入数字温度计,封口包装后在80 ℃水浴条件下加热至肉块中心温度至70 ℃,室温冷却2 h,将真空袋中的汁液倒掉,用滤纸吸干肉块表面汁液,称质量(m6/g),重复2 次取平均值。蒸煮损失率按公式(3)计算。

1.3.2.5 水分分布的测定
使用NMI20-015V-1核磁共振成像分析仪进行横向弛豫特性分析,测定前将仪器预热40 min。测试温度为32 ℃,测定样品前使用FID序列对仪器进行校准,所用FID参数:TD=1 024、PRG=2、TW=1 500 ms、NS=4、SW=100、RFD=0.08、RG1=20、DRG1=3。肉样制取参照王志永[8]和黄子信[9]等的方法,沿肌纤维方向分切2 cm×1 cm×1 cm的肉条,称质量后轻缓放入核磁测定专用试管底部,于32 ℃中水浴至恒温,擦干管壁后重复测定3 组平行,样品测定使用CPMG序列,具体参数为:PRG=2、TW=2 500、P2=22、TE=0.6、NECH=12 000、SW=250、RFD=0.002、RG1=20、DRG1=3、NS=8。样品核磁成像同样通过NMI20-015V-1核磁共振成像分析仪进行测定,测试温度为32 ℃,在测试样品前,使用标准油样进行校准,并对样品进行预扫描后进行正式成像。所用成像参数为:TR=500、TE=20、AVERAGES=3、FOV Read=80、FOV Phase=80,肉样成像厚度为3 mm,同一样品进行5 层成像。
1.3.2.6 肌节长度的测定
肌节长度的测定参考Li Ke等[10]的方法并稍加修改。剪取修整后牛肉样品2 g,放于25 mL烧杯中,加入4 ℃预冷的0.25 mol/L蔗糖溶液18 mL,低速(6 000 r/min)匀浆1 min,然后取悬浮液制作载玻片,在BX41生物显微镜下放大1 000 倍观察并拍照。使用Image-Pro Plus version 6.0软件测量肌节长度。每个样品取5 个平行样(载玻片),总共测量150 次。150 次测量结果的平均值即为该样品的肌节长度。
1.3.2.7 肌细胞横截面显微结构观察
在成熟3、7、14 d和21 d时延肌纤维方向取0.5 cm×0.2 cm×0.2 cm肉样,每个样品取3 个平行样,置于servicebio专用固定液固定24 h以上,修整样品后进行梯度乙醇脱水并进行石蜡包埋和切片,处理条件如下:75%(体积分数,下同)乙醇溶液4 h,85%乙醇溶液2 h,90%乙醇溶液2 h,95%乙醇溶液1 h,无水乙醇I 30 min,无水乙醇II 30 min,醇苯5~10 min,二甲苯I 5~10 min,二甲苯II 5~10 min,蜡I 1 h,蜡II 1 h,蜡III 1 h。将浸好蜡的组织于包埋机内进行包埋,之后于-20 ℃冷却,蜡凝固后将蜡块从包埋框中取出并修整蜡块。修整好的蜡块置于石蜡切片机切片,厚3 μm。切片漂浮于摊片机40 ℃温水上将组织展平,载玻片将组织捞起,60 ℃烘箱内烤片。将水烤干、蜡烤化后取出常温保存,用于后续苏木精-伊红染色处理。将处理好的石蜡切片放入二甲苯I 20 min,二甲苯II 20 min,无水乙醇I 5 min,无水乙醇II 5 min,75%乙醇溶液5 min,自来水洗后进行苏木精染色(苏木精染色3~5 min,1%盐酸溶液分化,1%氨水溶液返蓝,水洗)和伊红染色(切片依次用85%、95%的梯度乙醇溶液脱水,放入伊红染液中染色5 min),将切片依次放入无水乙醇I 5 min,无水乙醇II 5 min,无水乙醇Ⅲ 5 min,二甲苯I 5 min,二甲苯II 5 min,然后置于中性树胶封片后进行显微镜镜检。并对显微图像进行扫描保存。显微图像经过Photoshop 7.0软件处理去除细胞间杂乱组织后,通过Image-Pro Plus 6.0软件测量获得细胞外空间面积,细胞外空间面积比按式(4)计算。

1.4 数据处理与分析
数据采用SPSS Statistics 22软件进行统计分析,对不同pH值牛肉的不同指标进行单变量一般线性模型和皮尔逊相关性分析。通过SigmaPlot 10.0和Excel 2013软件作图。
2 结果与分析
2.1 不同极限pH值牛肉成熟过程中pH值变化
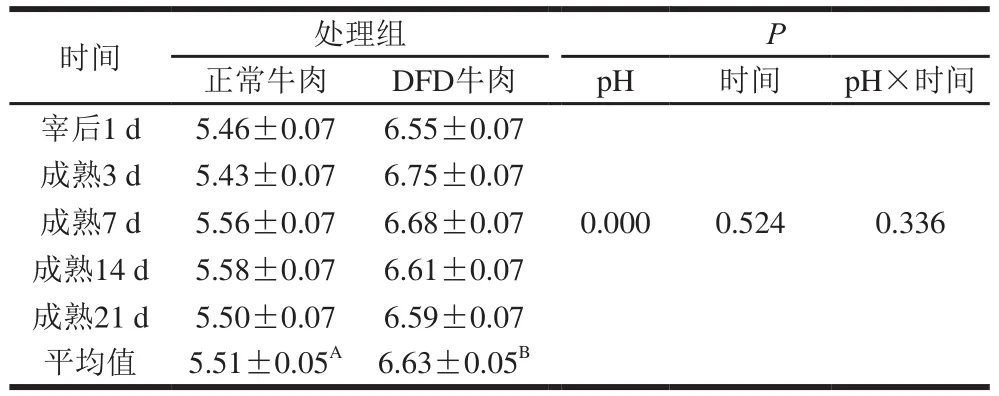
表1 宰后及成熟过程中正常和DFD牛肉pH值变化Table 1 Changes in pH in normal and DFD beef during postmortem aging
由表1可知,在宰后1 d和成熟3~21 d的过程中,正常牛肉pH值保持在5.43~5.58,而DFD牛肉pH值保持在6.55~6.75,DFD组宰后及成熟过程中平均pH值显著高于正常牛肉(P<0.05)。秦丽波[11]研究同样表明真空包装的DFD和正常牛肉在成熟20 d内,其pH值分别保持在6.60~6.67和5.48~5.52范围内,该结果与本研究类似。
2.2 不同极限pH值牛肉成熟过程中保水性变化
评价肉的保水性的指标有很多,通常选用某个指标来衡量肉的保水性,但通过不同指标评估成熟过程中牛肉的保水性,其趋势往往有差异。因此为了模拟牛肉在吊挂、成熟和烹饪过程中完整的保水性变化,本实验通过成熟过程中牛肉的汁液损失率、贮藏损失率、蒸煮损失率之和作为总水分损失来衡量。
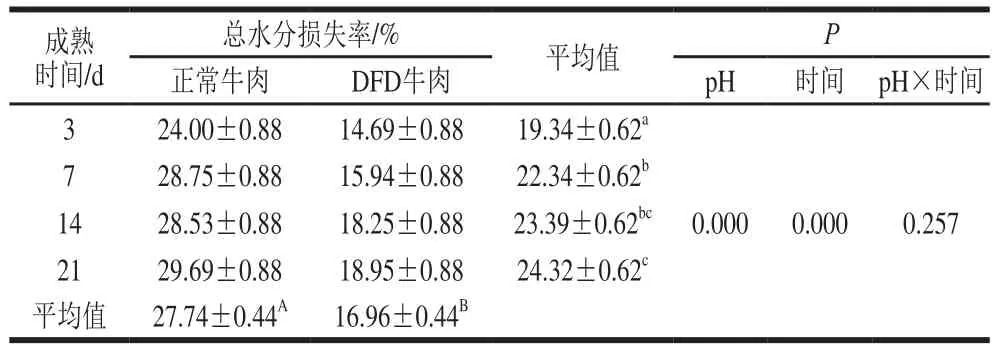
表2 成熟过程中正常和DFD牛肉总水分损失率变化Table 2 Changes in percent water loss in normal and DFD beef during postmortem aging
由表2可知,pH值与成熟时间对成熟过程中正常和DFD牛肉总水分损失率变化无交互作用,pH值和成熟时间均具有主效应。随着成熟时间的延长,正常牛肉的总水分损失率从24.00%升高到29.69%,而DFD牛肉的总水分损失率则从14.69%升高到18.95%,这意味着不同极限pH值的牛肉保水性在成熟过程中呈现持续稳定的下降。且在成熟过程中,DFD牛肉的总水分损失率平均值显著低于正常牛肉(P<0.05)。Hughes等[12]研究表明随着成熟的进行,细胞骨架蛋白的降解会减少肌原纤维收缩力的传递,使水分在肉中保留,且成熟过程中肌原纤维会发生肿胀,容纳更多的水分,因此在成熟后期保水性会有所改善[13],这与本实验的研究结果相悖,其原因可能是该学者测定保水性所使用的离心损失法、汁液损失法检测的是肉中部分水分的损失,不能充分反映保水性趋势的变化。除此之外,成熟过程中正常牛肉肌细胞的肿胀伴随着细胞破裂,使水分更容易溢出,因此牛肉保水性降低。
2.3 不同极限pH值牛肉成熟过程中横向弛豫特性变化
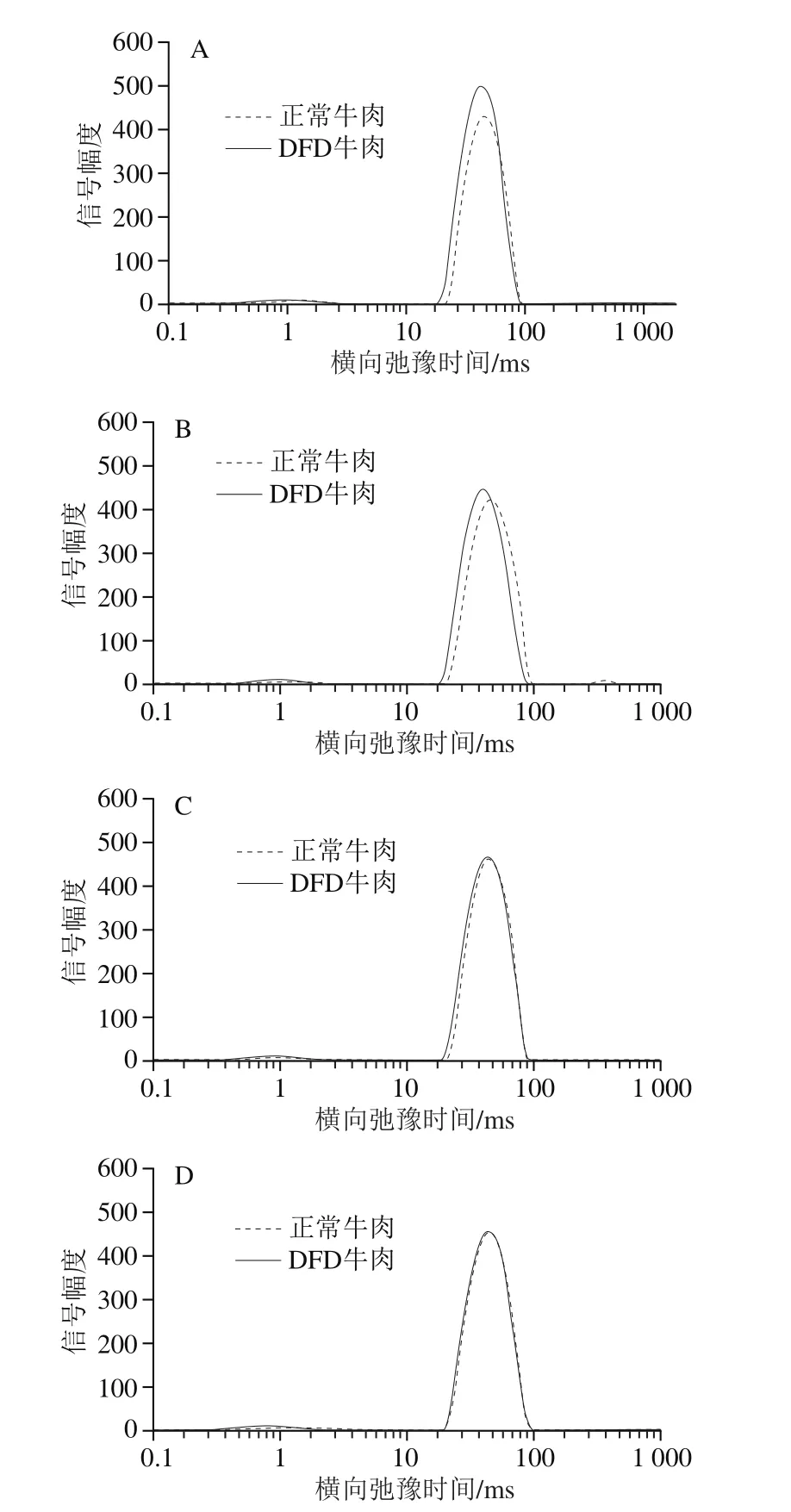
图1 成熟过程中正常与DFD牛肉横向弛豫特性变化Fig. 1 Transverse relaxation characteristics of normal and DFD beef during postmortem aging
图1展示了不同成熟时间的正常牛肉与DFD牛肉弛豫特性的变化。由表3可知,T2b代表结合水的自由度,其中pH值对T2b具有主效应,在成熟过程中不同极限pH值牛肉T2b均无显著变化,这主要是由于结合水与蛋白质紧密结合,不易受外界环境的影响[14]。但是DFD牛肉的平均T2b显著低于正常牛肉(P<0.05),Bertram等[15]在通过LF-NMR测定不同pH值肌原纤维蛋白也得到同样结果。反映不易流动水自由度的T21则受pH值和成熟时间交互作用的影响,在DFD牛肉组中,T21在成熟过程中并无显著变化,但正常牛肉的T21则随着成熟时间的延长逐渐降低,其原因可能是肉中自由度比较高的那部分不易流动水在成熟过程中逐渐转变为贮藏损失,而剩余的那部分不易流动水自由度较低。反映自由水自由度的T22受pH值主效应的影响,且随着成熟的进行逐渐延长,这说明肉中自由水在成熟过程中越来越活跃,因此更容易散失。且在本实验中,随着成熟的进行,除个别时间点外,DFD牛肉的T2b、T21、T22始终低于正常牛肉,这意味着DFD牛肉各部分水分活跃度更低,这可能是DFD牛肉保水性较好的原因。

表3 成熟过程中正常和DFD牛肉横向弛豫时间T2变化Table 3 Transverse relaxation time T2 of normal and DFD beef during postmortem aging
弛豫峰面积比P2代表着不同状态水分占总水分含量的比例,本实验中pH值和成熟时间对P2b、P21、P22均具有交互作用。其中P2b代表着结合水的相对含量,由于外力条件无法改变结合水与蛋白质分子紧密结合的状态;因此,在探究肉的保水性时,通常不考虑结合水的变化对保水性的影响。但在本研究中,DFD牛肉中的结合水不但具有较低的自由度,其相对含量也显著高于正常牛肉(P<0.05)(表4),这可能是DFD牛肉具有较好保水性却表面干燥的原因。相应地,成熟过程中DFD牛肉中不易流动水的相对含量(P21)始终略低于正常牛肉。P22则是代表自由水的相对含量,成熟过程中DFD牛肉的自由水相对含量不稳定,成熟7 d的正常牛肉中的自由水相对含量显著上升(P<0.05),随后下降;许倩等[16]在冰温条件下真空贮藏的牛肉中也发现在贮藏1~5 d内自由水相对含量上升的类似趋势,其原因可能是成熟初期肌肉完全解僵水分自由度提高,其他状态的水分转化为自由水。但是在本实验中,LF-NMR测定的自由水相对含量比文献[16]的研究结果相对较低,其原因可能是样品在从工厂到实验室的运输过程中,已经损失了部分汁液,这部分汁液损失主要来自于自由水。
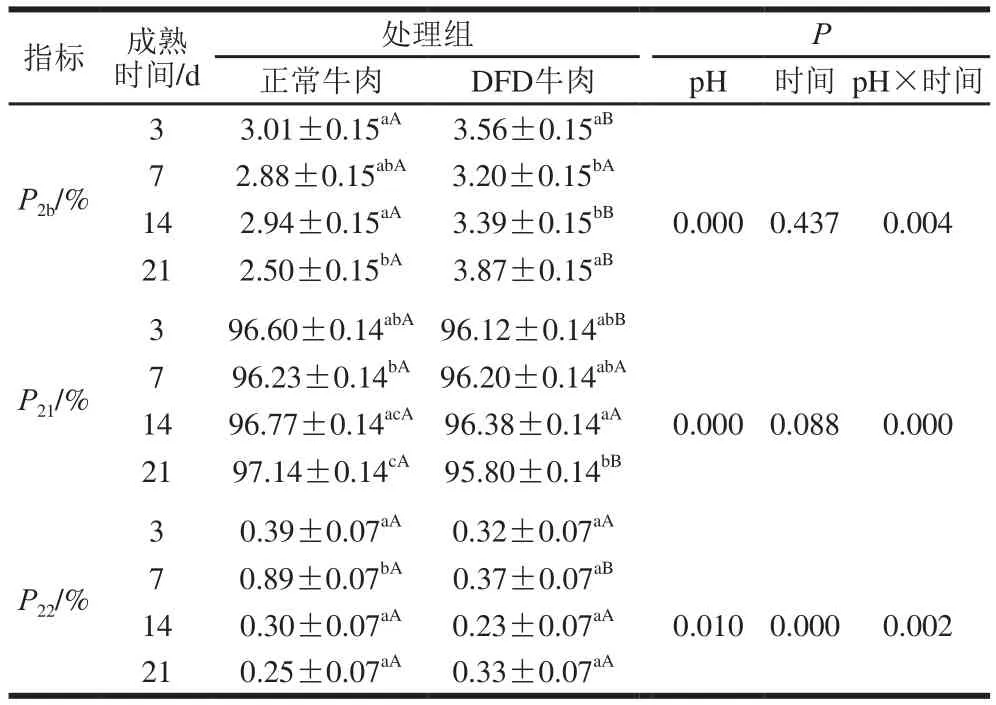
表4 成熟过程中正常和DFD牛肉弛豫峰面积比P2变化Table 4 Change in relaxation peak area ratio in normal and DFD beef during postmortem aging

图2 成熟过程中正常和DFD牛肉LF-NNR图Fig. 2 LF-NNR images of normal and DFD beef during postmortem aging
图2是通过LF-NMR成像技术获得的正常牛肉与DFD牛肉在成熟3、7、14 d和21 d所取样品的质子密度加权图像。图像亮度越高,说明肉样中氢质子密度越高,即水分含量更高[17]。相比正常牛肉,DFD牛肉的核磁成像亮度更高,说明DFD牛肉中有较高的水分含量。但在成熟过程中,不同pH值组的牛肉核磁图像亮度变化不大。甄少波等[3]研究则表明宰后24 h内随着成熟时间的延长,猪肉核磁图像的亮度逐渐提高。另外,正常牛肉从成熟7 d开始,肉中出现明显的亮带并持续到成熟21 d,已有研究表明,这些亮带主要由结缔组织、脂肪和水构成,且与汁液损失通道的形成有关[18]。
2.4 不同极限pH值牛肉成熟过程中肌节长度变化

表5 成熟过程中正常和DFD牛肉肌节长度变化Table 5 Changes in sarcomere length of normal and DFD beef during postmortem aging
肌节的收缩状态影响着肌球蛋白与肌动蛋白之间储水空间的大小,受到pH值、肌纤维长度、离子强度、渗透压以及尸僵的影响[19]。有研究认为肌节长度越短,肌肉的保水性越低。主要原因是较短肌节导致肌动球蛋白横桥增多,会增加肌纤维的横向拉力,缩小肌原纤维内的储水空间[19]。但由表5可知,本研究中牛肉肌节长度的变化受pH值主效应的影响,在成熟过程中,DFD牛肉的平均肌节长度为1.47 μm,显著短于正常牛肉的1.91 μm(P<0.05)。祝超智[20]和侯旭[21]等在不同保水性的鸡肉和牛肉中也得到了同样结果。其原因一方面是,虽然DFD牛肉肌节横向收缩,但粗细丝之间的纵向空间扩张,肌细胞中储水空间变化对保水性影响较小[22];另一方面,DFD牛肉肌节的收缩阻碍了蛋白水解酶与肌原纤维的接触,减缓了肌原纤维蛋白的降解[23],DFD牛肉较高的肌原纤维完整性有利于将水分保持在肉的组织内,提高了保水性。祝超智等[20]的研究同样表明高汁液损失的鸡肉其肌球蛋白更容易变性。且DFD牛肉与正常牛肉主要是水分自由度的差异,因而DFD牛肉相比于正常牛肉肌节较短,但保水性较好。
2.5 不同极限pH值牛肉成熟过程中细胞外空间面积比变化
细胞外空间所占肌肉横截面的比例反映肌细胞的收缩肿胀状态,并影响肉中水分的迁移变化,Bertram等[24]研究表明,随着成熟时间的延长,猪肉内肌细胞逐渐发生肿胀。本实验中,牛肉细胞外空间面积受pH值和成熟时间交互作用的影响,由图3、4可知,成熟初期的DFD牛肉与正常牛肉的细胞外空间面积比差异不显著,但在成熟14 d后,正常牛肉肌细胞发生明显的肿胀,使得细胞间隙减小;而DFD牛肉在整个成熟过程中细胞外空间无显著性差异。细胞膜的完整程度对肌肉的保水性有重要影响[14],DFD牛肉宰后pH值下降速度慢,宰后初期细胞膜更加完整[24],且较短的肌节能够降低蛋白水解的速率[13],因此DFD牛肉具有更好的保水性。另外,DFD牛肉的pH值更多地偏离肌球蛋白等电点5.1,较高的静电斥力使得纤维结构疏松,并且大量水分起到“增塑剂”的作用[12],使肌肉结构更加稳固,因而DFD牛肉的肌细胞在成熟过程中始终保持良好的形态,减少了水分的散失,这与显微照片呈现的结果一致。

图3 成熟过程中正常和DFD牛肉细胞外空间面积比变化Fig. 3 Changes in the percentage of extracellular space in normal and DFD beef during postmortem aging

图4 成熟过程中正常和DFD牛肉显微照片Fig. 4 Images of normal and DFD beef during postmortem aging
2.6 相关性分析结果
表6显示的是不同极限pH值牛肉保水性与横向弛豫特性、组织学指标之间的相关性。衡量保水性的总水分损失率与pH值呈极显著负相关(r=-0.888,P<0.01),与T2b、T21、P21呈极显著正相关(P<0.01),相关系数分别为0.402、0.531、0.568,与T2b呈极显著正相关(r=0.402,P<0.01),这说明横向弛豫特性与传统方式测定的保水性具有良好的相关性,因此有学者通过横向弛豫特性对肉品保水性进行检测或预测[25-26]。
pH值与T2b、T21呈极显著负相关(P<0.01),相关系数分别为-0.469、-0.624,这可能是较高的pH值使肉中主要蛋白质偏离等电点,增强了对水分子的束缚,降低了水分自由度,提高了肉的保水性[27]。另外,pH值与肌节长度呈极显著负相关(r=-0.699,P<0.01),通常认为肌节长度与剪切力呈负相关关系[28],但肌肉pH值与肌节长度的关系还缺乏相关研究。
肌节作为肌肉组织的最小收缩单位,其收缩状态会对保水性产生影响。本实验中肌节长度与总水分损失率呈现极显著正相关(r=0.671,P<0.01),肌节长度与P21、T21呈极显著正相关(P<0.01),说明虽然较短的肌节长度可能使DFD牛肉中不易流动水的相对含量降低,但同时也降低了其自由度,Bertram等[29]的研究同样表明肌节长度与T2有良好的相关性。依据相关性分析,较短的肌节可能会加强对肌丝内部水分的束缚,降低水分的自由度,并在烹饪过程中减少肌肉的收缩,减少水分散失。
细胞外空间面积比与总水分损失率呈现极显著负相关(r=-0.503,P<0.01),通常认为成熟后期随着肌细胞肿胀,细胞外空间缩小,生鲜肉的保水性提高。Huff-Lonergan等[27]曾针对该理论提出需要更多的研究来证实肌肉细胞肿胀是否伴随着个体肌细胞的分解,是否与特定的纤维类型有关。本实验通过显微观察发现正常牛肉肌细胞肿胀的同时确实发生了裂解。

表6 成熟过程中不同极限pH值牛肉水分变化与组织学指标相关性分析Table 6 Correlation coefficients between moisture variation and histological indexes of normal and DFD beef during postmortem aging
3 结 论
成熟过程中DFD牛肉与正常牛肉保水性均呈逐渐下降趋势,且DFD牛肉保水性显著高于正常牛肉。相比于正常牛肉,成熟过程中DFD牛肉中结合水、不易流动水和结合水自由度较低,且DFD牛肉中的结合水相对含量更高,这可能是DFD牛肉虽然保水性好但表面干燥的原因。此外,DFD牛肉肌节较短,可能因此降低了其不易流动水的相对含量,但肌节内狭窄的储水空间降低了肉中水分的自由度,并因此提高保水性。在成熟过程中,正常牛肉肌细胞逐渐发生肿胀,细胞外空间比下降但并未提高其保水性,可能是成熟过程中正常牛肉细胞破裂严重,而DFD牛肉肌细胞则仍保持良好形态,因此产生保水性差异。
