醉鱼草对鲫麻醉效果及血清生化指标的影响
2020-07-22李元王子戌李淑艳顾彤颖林森聂小宝黄宝生张长峰
李元,王子戌,李淑艳,顾彤颖,林森, 聂小宝,黄宝生,张长峰*
(1.山东省农产品贮运保鲜技术重点实验室,山东 济南 250103; 2.山东商业职业技术学院,山东 济南 250103; 3.国家农产品现代物流工程技术研究中心,山东 济南 250103; 4.武汉理工大学,湖北 武汉 430070; 5.淮阴工学院,江苏 淮安 223003)
醉鱼草BuddlejalindleyanaFortune属马钱科醉鱼草属植物,醉鱼草属植物约有100种,其分布广泛,具有生长迅速、易栽培、易种植的特点,是天然中草药[1]。中国古时就将其作为常用的中草药广泛应用,具有祛风杀虫、活血功效,可治疗跌打损伤、风寒感冒、湿疹、皮肤瘙痒、蛔虫、钩虫痛、风湿麻木等疾病。《单方验方调查资料选编》中记载,醉鱼草五钱到一两水煎服可治流行性感冒。在现代临床应用中也记载用复方醉鱼草片剂,每次1片,日服3次,3~5 d后可缓解慢性支气管炎。以上研究表明,醉鱼草具有良好的医用效果,在临床应用中也并未见对人类有损害的报道。关于醉鱼草的化学成分,一般认为主要有黄酮类、苯丙素酚苷类化合物、菇类、甾醇类等[2]。
目前,国内关于醉鱼草药理作用的研究多为抗菌消炎方面的运用及抑制肿瘤的作用[2]。《本草纲目》中对于醉鱼草曾有“渔人采花及叶以毒鱼,尽围困而死”的记载。中国植物志记载:醉鱼草全株有小毒,捣碎投入河中能使活鱼麻醉,便于捕捉,故有“醉鱼草”之称。目前,关于醉鱼草麻醉作用的科学研究尚未见报道。
活鱼在运输过程中会不可避免地受到物理刺激和损伤,因此,在活鱼运输中常使用麻醉剂,不仅能够降低鱼体新陈代谢,还可降低其对外界刺激的应急反应,减少在运输途中因碰撞、挤压等对鱼体造成的伤害[3]。目前,市面上使用最多的麻醉剂主要是MS-222、丁香酚。MS-222是目前唯一通过美国食品和药物管理局(FDA)认可使用的渔用麻醉剂,但FDA对使用MS-222麻醉剂有严格要求,在运输后需要有21 d的休药期,等待药物残留消除后才可以在市场上销售[4]。MS-222对水产品的麻醉作用见效快、安全性能高,经其处理过的水产动物和人体接触均无害,但价格较高。丁香酚是一种常见植物提取类麻醉剂,且丁香酚及其代谢产物能快速通过组织排泄出来,不会在机体内产生有害物质[5-6],在食品中可直接添加,成本低廉,但丁香酚具有较强的挥发性,药效会随着挥发过程逐渐减弱。因此,研发一种安全高效、廉价型的新型麻醉剂十分必要。Yoshida等[7]研究认为,醉鱼草对鱼有毒性。鲫Carassiusauratus是中国的一种优质淡水经济鱼类,本试验中,以鲫为试验对象,探究了醉鱼草粗提物水溶液对鲫的麻醉效果,以及醉鱼草对鲫血液生化指标的影响,以期判断其是否可作为安全的植物源麻醉剂,为活鱼运输和鱼用麻醉剂的研究提供有效参考。
1 材料与方法
1.1 材料
试验用鲫购自山东省济南市七里堡水产市场,选取体质量和体长近似的鲫共30尾,平均体质量为220 g左右,平均体长为22 cm左右,无疾病、无外伤。充氧后快速运回山东省农产品贮运保鲜技术重点试验室,试验前暂养于水产品温控蓄养实验室,从试验前一天至试验结束期间对鲫停止喂食。
醉鱼草粗提物水溶液由醉鱼草粗提物冻干粉加水混合均匀后配制而成。
1.2 方法
1.2.1 醉鱼草粗提物冻干粉制备工艺
① 预处理。称取一定量的醉鱼草,用蒸馏水清洗,沥干后,在65 ℃下烘干。
② 醉鱼草提取液的制备。将预处理过的醉鱼草放入粉碎机中,粉碎至40目左右,置入储存罐中。按醉鱼草粉与50%乙醇为1∶20的比例,将粉碎的醉鱼草加入超声循环提取机进行超声波提取。调节转速为1000 r/min,超声波频率为40 kHz,温度为30~50 ℃,提取120 min后,用300目的滤网将提取物原料残渣过滤出来。
③ 浓缩液的制备。将超声提取液沉淀12 h,用旋转蒸发仪浓缩提取液至原体积的1/5左右。
④ 冻干粉的制备。将浓缩液装入真空冷冻干燥机中,冻干12~24 h后,至冷阱冰量不再增加,终止,制得醉鱼草粗提物冻干粉。
1.2.2 麻醉和复苏阶段行为特征观察 由预试验结果可知,当醉鱼草粗提物水溶液浓度达到 2 g/L 及以上时,鲫可达到麻醉的最终状态。故此,随机选取6尾鲫放入浓度为 2 g/L的醉鱼草粗提物水溶液中,观察并记录鱼体在麻醉和复苏过程中各时期的行为特征。麻醉和复苏分期参照刘长琳等[4]研究中确定的标准, 并结合鲫自身行为特征。
1.2.3 醉鱼草粗提物水溶液对鲫的麻醉效果试验 试验在50 L水箱中进行,根据预试验结果,设置2、4、6 g/L 3个醉鱼草粗提物水溶液浓度组,每组6尾鲫,以3个浓度依次对鲫进行麻醉试验,测定麻醉时间、复苏时间及复苏后的呼吸频率,同时记录鲫的复苏率。将鲫进入麻醉阶段Ⅳ期所需的时间记为麻醉时间,进入麻醉阶段Ⅳ期的鱼放入清水中后,恢复到正常游姿的时间记为复苏时间[4]。
1.2.4 醉鱼草粗提物水溶液(6 g/L)对鲫血清生化指标的影响试验 试验在50 L水箱中进行,共使用12尾鲫。其中,3尾鲫作为对照组(麻醉前),9尾鲫放入浓度为6 g/L的醉鱼草粗提物水溶液中。失衡时(取最先失衡的鲫3尾)、复苏0 h(取最先复苏的鲫3尾)、复苏12 h(取鲫3尾)3个阶段取出鲫,采用断尾法从鲫静脉取血。将血液放入冰箱(4 ℃)静置2 h后,4 ℃下以3500 r/min离心30 min制成血清,于冰箱(-80 ℃)中保存。
采用长春汇力生物技术有限公司相应试剂盒分别测定谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)、乳酸脱氢酶(LDH-L)活性;采用南京建成生物工程研究所相应试剂盒测定过氧化氢酶(CAT)和超氧化物歧化酶(SOD)活性;采用Enzyme-linked Immunosorbent Assay Kit For Cortisol(武汉优尔生生命科学装备有限公司)测定皮质醇(COR)含量。
1.3 数据处理
采用SPSS 22.0软件对试验数据进行单因素方差分析,采用LSD法进行组间多重比较,显著性水平设为0.05。试验数据以平均值±标准差(mean±S.D.)表示。
2 结果与分析
2.1 鲫麻醉和复苏阶段的行为特征
在醉鱼草粗提物水溶液质量浓度为2 g/L时,观察鲫的麻醉和复苏行为特征。从表1可见:麻醉Ⅰ期的鲫对醉鱼草粗提物水溶液的初接触反应较为激烈,进入Ⅱ期后反应衰退;在麻醉的各个阶段,鲫的呼吸频率产生不同的变化,Ⅰ期时鲫呼吸频率加快,而Ⅱ期到Ⅳ期时鲫呼吸频率低于正常期,Ⅴ期鲫呼吸近乎停止;在复苏阶段,鲫的呼吸频率则不断增加,在复苏Ⅳ期完全恢复。

表1 鲫麻醉和复苏阶段的行为特征(醉鱼草水溶液浓度2 g/L)
2.2 醉鱼草粗提物水溶液对鲫的麻醉效果
从表2可见:醉鱼草水溶液浓度为6 g/L时鲫的平均麻醉时间是2 g/L浓度时的81%,复苏后平均呼吸频率较2 g/L浓度时下降10次/min,而平均复苏时间是2 g/L浓度时的200%;3个浓度组鲫复苏率均为100%,表明在2~6 g/L浓度范围内短时间内药浴,对鱼体相对安全。从表2还可见,随着醉鱼草水溶液浓度提高,在相近体质量与体长的鲫试验中,鲫被麻醉的时间减少,鲫复苏后平均呼吸频率越低,复苏所需时间越长。以市场应用为出发点,平均麻醉时间短更是市场需求的重点,可见,试验浓度为6 g/L时麻醉效率更高。

表2 醉鱼草水溶液对鲫的麻醉效果Tab.2 Anaesthetic effects of aqueous solution of Buddleja lindleyana on crucian carp Carassius auratus
2.3 醉鱼草粗提物水溶液对鲫血清生化指标的影响
鱼类的血清生理生化指标与机体的代谢、营养状况及疾病有着密切的关系, 当鱼体受到外界因子的影响而发生生理或病理变化时,必定会在血液指标中反映出来。
从表3可见:醉鱼草水溶液对鲫麻醉前后,鲫血液ALT、AST、LDH-L、CAT、COR、ALP、SOD含量均有显著性差异(P<0.05);ALT活力从鲫失衡至复苏后0 h持续下降且始终显著低于麻醉前(P<0.05);AST活力在药浴后则持续升高,失衡后始终显著高于麻醉前(P<0.05);LDH-L活力失衡时显著增加(P<0.05),之后持续下降且显著低于麻醉前(P<0.05);ALP、CAT活力失衡时显著增加(P<0.05),复苏后0 h下降,此时ALP、CAT活力显著低于麻醉前(未麻醉状态)(P<0.05);COR含量和SOD活力从鲫失衡时开始下降,复苏12 h后上升,复苏12 h时COR和SOD水平均接近麻醉前。
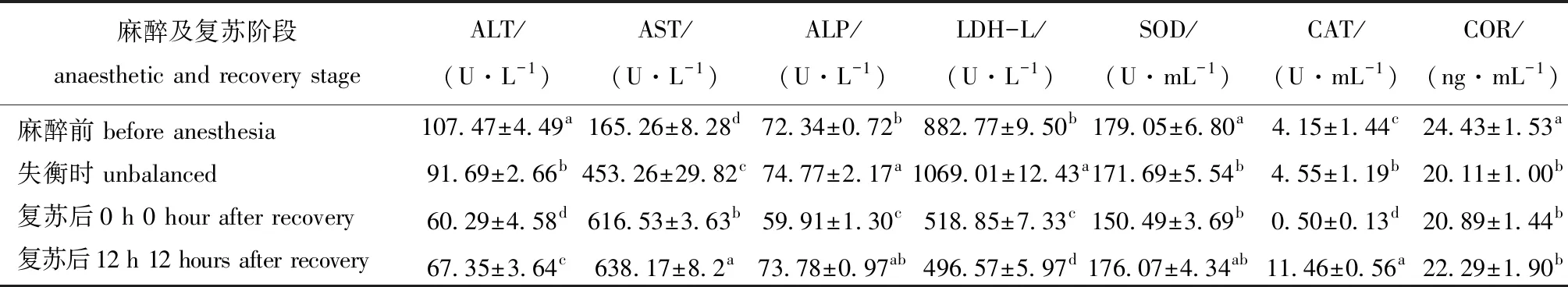
表3 醉鱼草水溶液对鲫血清生化指标的影响
2.4 醉鱼草提取物的安全性评价
根据《GB 15193.3—2014食品安全毒理学评价程序和方法》对醉鱼草提取物进行急性经口毒性试验,选取ICR小鼠20只,雌雄各半,清洁级,由浙江省试验动物中心提供。称取10.0666 g醉鱼草提取物置于烧杯中,取少量纯水将样品混匀后倒入20 mL容量瓶内,加入纯水定容至刻度线。采用最大限量法,灌胃剂量为10066.6 μg/kg, 对动物用经口灌胃法一次染毒,染毒后继续禁食1 h,观察并记录染毒过程和观察期内动物的中毒和死亡情况,观察周期14 d,观察结束后对存活动物进行解剖。试验动物在14 d内未出现中毒症状和中毒死亡,对受试动物解剖观察,其内脏未发现异常变化,且LD50>10066.6 mg/kg,根据《GB 15193.3—2014食品安全毒理学评价程序和方法》急性毒性试验标准,该样品急性经口LD50>5000 mg/kg,由此判定,该提取物属于实际无毒性。
3 讨论
3.1 醉鱼草对鲫的麻醉效果
本研究表明,醉鱼草粗提物水溶液对鲫确有麻醉作用,在麻醉效果测试中,大多数鲫随着药液浓度的增加产生麻醉作用的时间缩短,复苏时间增加。这与丁香酚对鲫的麻醉效果相似[8],但与丁香酚对罗非鱼的麻醉效果有所不同,如丁香酚对罗非鱼的麻醉则是复苏时间随着浓度的提高而缩短[9]。因此,醉鱼草粗提物水溶液对鲫麻醉效果明显。
3.2 醉鱼草对鲫血清生化指标的影响
ALT和AST是两种最重要的转氨酶,ALT是肝细胞损伤最敏感、最特异的指标,ALT升高常反映肝功能发生障碍;AST含量在心肌细胞中最多,其含量显著增加常预示心肌细胞可能受到一定程度的损伤[10]。本试验中,ALT活力未见升高;AST活力则在药浴后持续升高,失衡后始终显著高于麻醉前。由此表明,醉鱼草水溶液可能损伤了鲫的心肌细胞,导致细胞膜通透性增加,胞浆内的AST释放,故其在血清中的浓度升高。
LDH是一种分布于所有组织细胞胞浆中的糖酵解酶,是用于诊断心肌损伤的主要生化指标[11]。本试验中,麻醉后LDH-L活力先升高后又下降,复苏后12 h鲫的LDH-L活力下降明显。剧烈运动能够使细胞通透性发生改变,细胞内乳酸脱氢酶逸出进入细胞外液,引起血清乳酸脱氢酶升高,使骨骼肌无氧代谢能力降低,乳酸堆积而引起疲劳。因此,LDH-L先升高再下降的变化趋势也说明鲫经过前期应激反应后,变得更加稳定。
磷酸酶对于动物体内的解毒体系有着重要的作用[12]。ALP是动物代谢的重要调节因子和非特异性磷酸酶,在水生动物体内钙的吸收、磷酸钙的形成中起着重要的作用,是水生动物生长和生存的重要酶之一[13-14]。本试验中,复苏后0 h鲫的ALP活力显著低于麻醉前(未麻醉状态),说明醉鱼草水溶液含有抑制ALP的活性成分,在复苏后12 h ALP活力基本恢复到未麻醉时的水平,这表明醉鱼草对鲫ALP的长期影响较小。
CAT和SOD在清理生理过程中产生的过氧化物方面有较重要作用,是水生生物抗氧化酶系统的重要组成成分,可以减少细胞损伤[15]。本试验中,复苏后0 h鲫的 SOD活力显著下降,但复苏后12 h鲫的 CAT活力显著升高,且恢复到麻醉前状态。CAT、SOD酶活性的变化能在一定程度上反映机体在环境胁迫下免疫机能的变化。本研究表明,醉鱼草水溶液可能使鲫在麻醉过程中产生了免疫机能的变化,鲫CAT的显著升高也表明激发了肝细胞的氧化防御反应,细胞通过提高CAT来抵御物质带来的氧化损伤。
COR浓度一般被作为鱼压力变化的指标,COR在血清中的水平是鱼体应激的一项重要指标[16]。本试验中,麻醉后COR浓度始终低于麻醉前的水平,说明醉鱼草水溶液对鱼的压力刺激较小,且能够确保维持镇静效果。
3.3 醉鱼草的使用前景
一般认为,理想的麻醉浓度为3 min内麻醉,5 min内苏醒[17]。本研究中,浓度为2、4、6 g/L的醉鱼草粗提物水溶液对鲫进行的平均麻醉时间分别为22.2、19.7、18.0 min,麻醉后平均复苏时间分别为0.8、1.1、1.6 min,表明醉鱼草水溶液的麻醉时间尚未达到理想麻醉的标准,可能与本试验中设置的醉鱼草水溶液浓度较低有关。目前,学界对醉鱼草有效成分药用价值的研究有待完善,本研究结果有助于开发一种安全性高、价格低廉的新型鱼用麻醉剂,并为水产品现代物流技术体系提供强有力支撑,解决运输中成活率低的问题,降低运输风险与成本,保障消费者安全食用水产品。
