北方地区3种蕨类孢子组培萌发率研究
2020-07-17孙晓梅孙戌男刘雪婷于立忠
孙晓梅 ,李 恒 ,孙戌男 ,刘雪婷 ,于立忠
(1.沈阳农业大学 林学院,沈阳110161;2.中国科学院 沈阳应用生态研究所,沈阳110116;3.中国科学院 清原森林生态系统观测研究站,辽宁 抚顺113312)
蕨类植物也称羊齿植物,是介于苔藓植物和种子植物之间的一个独具特色的高等植物类群,生活史为孢子体发达的异形世代交替[1]。其枝叶青翠、姿态奇特,在应用于园林绿化、室内观赏的同时,还具有较高的食、药用价值,在空气、土壤和水体污染净化与修复方面也具有特殊生态功能[2]。目前,全世界约有12000种蕨类植物,其中我国约有2600种[3]。面对如此丰富的蕨类资源,目前的开发利用明显不到位,许多优良的种类尚未得到有效利用[4]。尤其在北方地区,将野生蕨类植物运用于园林绿化之中以及盆栽观赏并不多见,如辽宁省有记载的蕨类植物有100种左右,其中药用蕨类植物有近40种[5],而园林产业发展先进的北京地区普遍应用的蕨类植物仅有20世纪90年代开发的荚果蕨(Matteuccia struthiopteris)一种[6]。
孢子繁殖是蕨类植物自我繁衍和进化的最主要途径,也是蕨类植物进行人工大规模培育及提高繁殖系数的最主要方法[7]。但是孢子萌发、原叶体形成、受精、孢子体形成与生长等受到诸多环境因素的影响,导致自然界孢子萌发繁殖率低,成苗率极低[8]。与植物的自然繁殖方式相比,组培技术不仅能保持原有品种的优良特性,而且还可以在短时间内获得大量的再生植株[9],但蕨类植物孢子体的幼嫩部位通常包被鳞片,较难消毒,不宜作为外植体,而孢子十分适合作为外植体[29]。目前,越来越多的研究将孢子繁殖与组织培养技术相结合,在无菌环境下对蕨类孢子进行培养,实现了多种蕨类植物的高效扩繁。汪长水[10]对鸟巢蕨(Asplenium nidus)孢子进行无菌培养,移栽成活率达到90%;徐艳等[11]探究了白玉凤尾蕨(Pteris cretica)孢子的无菌培养,移栽成活率可达80%以上。本研究以北方地区3种蕨类植物掌叶铁线蕨、粗茎鳞毛蕨、溪洞碗蕨孢子为材料,通过组织培养的方法,研究不同无机盐浓度、不同种类激素和浓度、光照对孢子萌发的影响,以期探索不同蕨类植物孢子萌发的最适条件,为规模化生产及应用奠定基础。
1 材料与方法
1.1 材料
2018年8~9月,在位于辽宁省抚顺市清原满族自治县大苏河乡长沙村的中国科学院清原森林生态系统观测研究站采集掌叶铁线蕨、粗茎鳞毛蕨、溪洞碗蕨的孢子,将孢子囊初见破裂的成熟孢子叶收集于信封中,待孢子自然脱落后常温条件保存备用。
1.2 方法
1.2.1 不同浓度的赤霉素处理 将培养皿与滤纸置于高压灭菌锅中,121℃灭菌40min,将滤纸铺在培养皿底部。取少量孢子接种于滤纸上,分别加入100,300,500mg·L-1(分别定义为:较低浓度、中等浓度、较高浓度)的赤霉素溶液培养,以润湿滤纸并让孢子均匀散布于滤纸上为准,空白对照加入等量的无菌水培养,1个培养皿为1次重复,每个处理3次重复,置于培养室中进行培养。培养温度为25~27℃,光照时间14h·d-1,光照强度(1200±100)lx。于接种后3,6,9,12,15d观察,每个培养皿取两个不同位置的孢子液各一滴,混合后滴于载玻片上,在光学显微镜下随机观察5个视野,记录孢子萌发率。
1.2.2 不同浓度的无机盐、生长素、细胞分裂素处理 试验釆用L9(34)正交设计,设置MS,1/2MS,1/4MS 3种无机盐含量;0.1,0.5,1.0mg·L-13 种 NAA 生长素浓度,以及 0.1,0.5,1.0mg·L-13 种 6-BA 细胞分裂素浓度,共 9 种组合。均加入2%蔗糖、0.7%琼脂,调节pH值至5.8。装入三角瓶中高温高压灭菌20min,待培养基冷却凝固备用。将掌叶铁线蕨、粗茎鳞毛蕨孢子分别装入2mL离心管中,加入2%NaClO水溶液,放入离心机中以10000r·min-1离心20min后,用无菌水冲洗5次,加无菌水稀释到10mL离心管中,用血球计数板计数,控制溶液中的孢子密度为10000·mL-1。溪洞碗蕨孢子在上述灭菌条件未见萌发,故采用加入1%NaClO水溶液离心5min的方式灭菌,其余均与上述处理相同。用移液枪将孢子水溶液接种到三角瓶中,每瓶接种1mL,每个处理3次重复。20d后每个处理取1滴孢子液滴于载玻片上,在光学显微镜下随机观察5个视野,记录孢子萌发率。
1.2.3 光照培养与暗培养处理 将3种蕨类孢子按1.2.2的灭菌方式处理,接种到1/2MS培养基中,均加入2%蔗糖、0.7%琼脂,调节pH值至5.8。每瓶接种孢子水溶液1mL,一组直接放入培养室正常培养,光照强度为(1200±100)lx,一组放入不透光的封闭纸箱中暗培养,除光照外其他条件均相同,每处理3次重复。培养20d后用上述方法调查记录孢子萌发率。
2 结果与分析
2.1 赤霉素处理对蕨类孢子萌发率的影响
2.1.1 赤霉素处理对掌叶铁线蕨孢子萌发的影响 掌叶铁线蕨孢子在5d时开始萌发,此时无菌水和较低浓度赤霉素(100mg·L-1)处理的萌发率分别达到53.67%和62.24%,而中等浓度与较高浓度显著降低掌叶铁线蕨孢子萌发率(p<0.05);随萌发时间的增加,不同处理条件下掌叶铁线蕨孢子萌发率逐渐增加,7~10d达到最大值(90.5%),15d时,掌叶铁线蕨孢子萌发率略有下降,维持在 71.55%~83.57%(图1)。
2.1.2 赤霉素处理对粗茎鳞毛蕨孢子萌发的影响 粗茎鳞毛蕨孢子在5d时开始萌发,随时间增加,萌发率逐渐提高。不同浓度赤霉素处理显著抑制粗茎鳞毛蕨孢子萌发 (p<0.05),且随着赤霉素浓度的增加,对粗茎鳞毛蕨孢子萌发的抑制程度越强。较低浓度赤霉素处理(100mg·L-1)在5d和7d时显著抑制粗茎鳞毛蕨孢子萌发(67.07%~68.76%),而在10d和15d时,对粗茎鳞毛蕨孢子萌发率的影响依然低于对照(p>0.05);中等浓度赤霉素处理(300mg·L-1)显著降低粗茎鳞毛蕨孢子萌发率(p<0.05),其萌发率仅为10.99%~22.96%;而较高浓度赤霉素处理(500mg·L-1)则完全抑制粗茎鳞毛蕨孢子的萌发,导致其萌发率为零(图2)。
2.1.3 赤霉素处理对溪洞碗蕨孢子萌发的影响 由图3可知,溪洞碗蕨孢子在5d开始萌发,此后,随时间增加,溪洞碗蕨孢子的萌发率逐渐增加。随着赤霉素浓度的增加,溪洞碗蕨孢子萌发率显著下降(p<0.05),其中,较低浓度赤霉素处理(100mg·L-1)显著提高5d和7d时溪洞碗蕨孢子萌发率(p<0.05),但10d和15d时提高不显著(p>0.05);中等浓度赤霉素处理(300mg·L-1)对溪洞碗蕨孢子萌发率影响不显著(p>0.05);而较高浓度赤霉素处理(500mg·L-1)则显著降低了溪洞碗蕨孢子萌发率(p<0.05)。
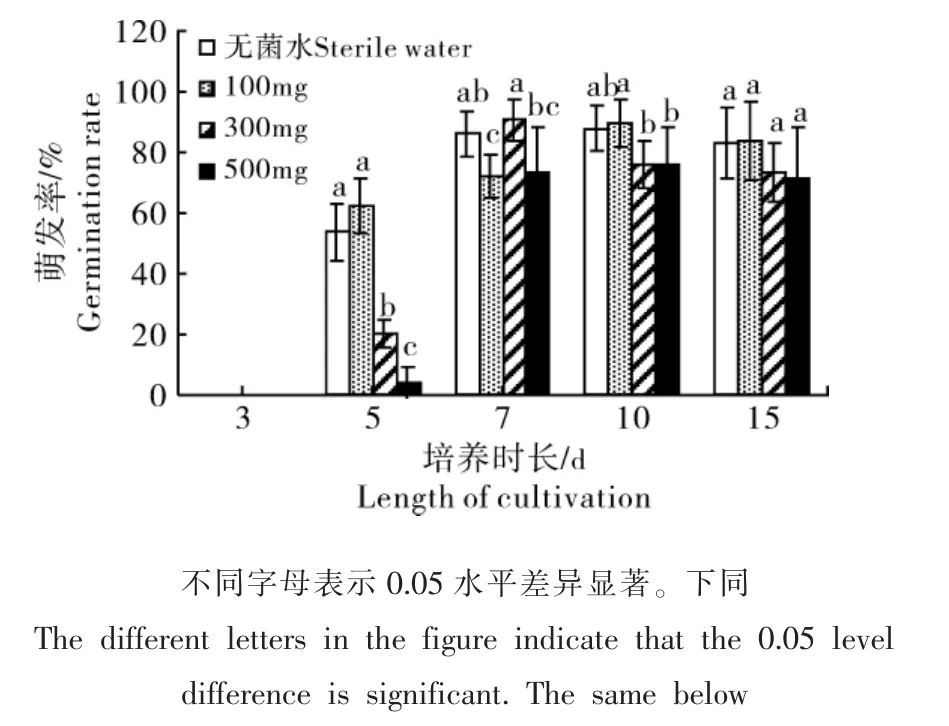
图1 不同浓度赤霉素处理下掌叶铁线蕨孢子萌发情况Figure 1 Spore germination of A.pedatum under different concentrations of gibberellin
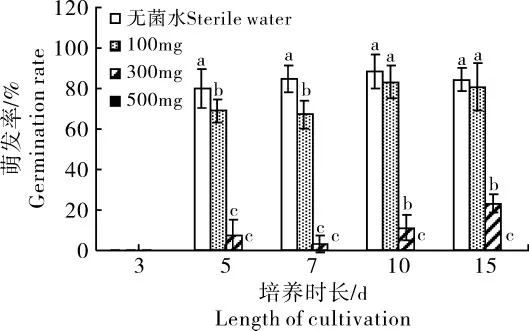
图2 不同浓度赤霉素处理下粗茎鳞毛蕨孢子萌发情况Figure 2 Spore germination of D.crassirhizoma under different concentrations of gibberellin
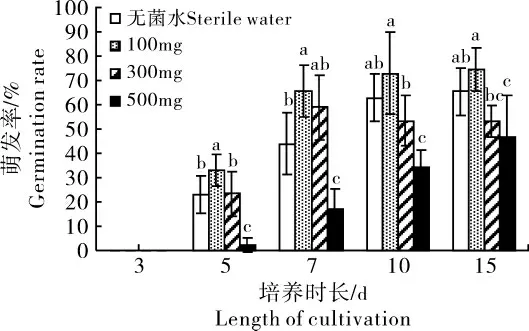
图3 不同浓度赤霉素处理下溪洞碗蕨孢子萌发情况Figure 3 Spore germination of D.wilfordii under different concentrations of gibberellin
2.2 无机盐、生长素、细胞分裂素浓度对蕨类孢子萌发率的影响
2.2.1 无机盐、生长素、细胞分裂素浓度对掌叶铁线蕨孢子萌发的影响 由表1可知,掌叶铁线蕨孢子在MS+0.1mg·L-1NAA+0.1mg·L-16-BA(A1)培养基中萌发率最高,达到 57%。 在 1/2MS+0.5mg·L-1NAA+0.1mg·L-16-BA(B2)培养基中萌发率次之,达到39%。而在以1/4MS为基础培养基的4组处理中,最高萌发率仅为29.01%,显著低于MS培养基和1/2MS培养基(p<0.05),表明随着无机盐含量的降低,掌叶铁线蕨孢子的萌发率也呈现降低的趋势,1/4MS培养基不利于掌叶铁线蕨孢子萌发培养。掌叶铁线蕨孢子最低萌发率出现在A2和B3组中,仅为9.25%和7.89%,这两组中都含有1mg·L-16-BA。表明高浓度的6-BA对掌叶铁线蕨孢子萌发起到抑制作用,不利于孢子萌发。试验表明,在采用MS培养基为基础培养基,添加较低浓度的NAA和6-BA溶液,最有利于掌叶铁线蕨孢子的萌发。
2.2.2 无机盐、生长素、细胞分裂素浓度对粗茎鳞毛蕨孢子萌发的影响 由表1可知,粗茎鳞毛蕨孢子在MS+0.1mg·L-1NAA+0.1mg·L-16-BA(A1)培养基中萌发率最高,达到69.58%,在不添加任何激素的MS培养基(A0)中次之,萌发率达69.16%,没有显著差异(p>0.05)。在MS,1/2MS,1/4MS 3种无机盐含量的培养基中,最高萌发率分别达到69.16%,59.09%,55.16%,萌发率均较高,表明培养基无机盐含量对粗茎鳞毛蕨孢子萌发率无显著影响。试验中最低萌发率出现在B3和C1组中,仅为15.78%和15.68%,这两组同样含有高浓度的6-BA,表明高浓度的6-BA对粗茎鳞毛蕨孢子萌发起到抑制作用,与掌叶铁线蕨萌发试验结果相吻合。由于不添加任何激素的A0组与萌发率最高的A1组萌发率极其接近,因此,不添加任何激素的MS培养基即为粗茎鳞毛蕨孢子萌发培养的最适培养基。
2.2.3 无机盐、生长素、细胞分裂素浓度对溪洞碗蕨孢子萌发的影响 由表1可知,溪洞碗蕨孢子在1/2MS+0.5mg·L-1NAA+0.1mg·L-16-BA(B2)培养基中萌发率最高,达到35.38%。其次是不添加任何激素的1/2MS培养基(B0)中,萌发率达到 34.35%,两组间没有显著差异(p>0.05)。 在 1/4MS+0.1mg·L-1NAA+1mg·L-16-BA(C1)培养基中萌发率最低,仅为9.89%。其余各组中,含有较高浓度的NAA以及6-BA的组合萌发情况大多不佳,溪洞碗蕨孢子萌发率介于12.39%~19.52%之间,表明较高浓度的生长素及细胞分裂素的使用不利于溪洞碗蕨孢子的萌发。由于不添加任何激素的B0组与萌发率最高的B2组萌发率极其接近,因此,不添加任何激素的1/2 MS培养基即为溪洞碗蕨孢子萌发培养的最适培养基。
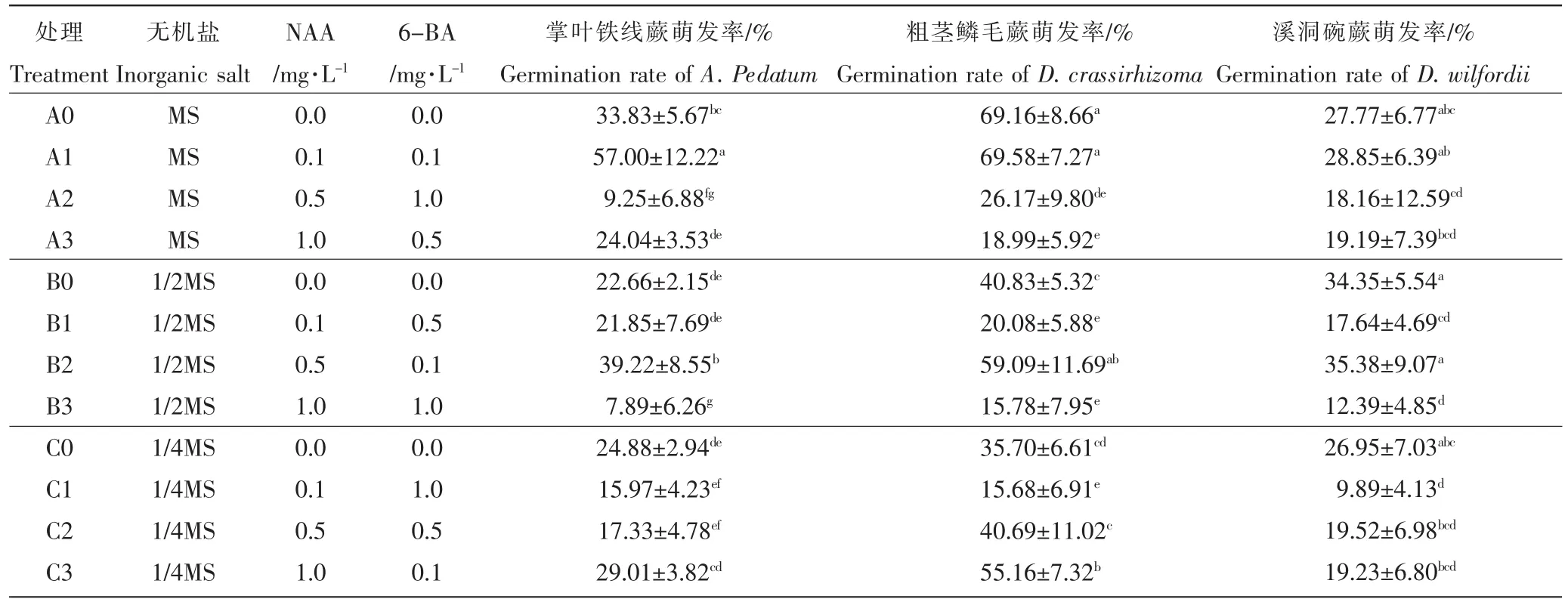
表1 不同浓度无机盐、生长素、细胞分裂素处理下3种蕨类孢子萌发率Table 1 Different concentrations of inorganic salt,auxin,and cytokinin treatment Germination rate of three fern spores
2.3 光照对蕨类孢子萌发的影响
将3种蕨类孢子分别放在培养室常规光照以及封闭纸箱暗培养20d后,在显微镜下观察萌发情况。由图4可知,常规光照培养的3种蕨类孢子均能正常萌发,而暗培养条件下的孢子只吸胀,萌发率均为零。说明光照是掌叶铁线蕨、粗茎鳞毛蕨、溪洞碗蕨孢子萌发的必要条件。
3 讨论与结论
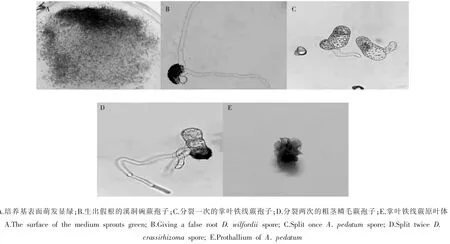
图4 3种蕨类植物孢子萌发Figure 4 Spore germination of three ferns
赤霉素可加速细胞的伸长,对细胞分裂也有促进作用[12]。在组培时加入赤霉素,有助于促进已分化的芽伸长生长。在对蕨类植物孢子组培试验中,赤霉素对孢子萌发的影响因种类不同,而有所差异。研究发现赤霉素对乌蕨(Odontosoria chinensis)孢子萌发无显著影响[13],提高当年采收的东北蕨菜(Pteridium aquilinum)孢子萌发的作用也不显著,这与本研究的结果接近。但对于蕨菜孢子,赤霉素可以促进上1年采集孢子萌发,并提高孢子萌发率[14]。赤霉素可显著促进华南毛蕨(Cyclosorus parasiticus)、乌毛蕨(Blechnum orientale)和蜈蚣蕨(Pteris vittata)的孢子萌发,而对线羽凤尾蕨(P.arisanensis)影响不显著,其原因可能是线羽凤尾蕨孢子不具休眠特性[15]。由此推测,赤霉素可以促进保存时间较长的孢子以及具有休眠特性的孢子萌发,但当年采收的未休眠孢子由于其自身活性较强,赤霉素对提高孢子萌发率的影响较小。本试验中,较低浓度赤霉素对当年采收的掌叶铁线蕨、粗茎鳞毛蕨、溪洞碗蕨孢子萌发率无显著的提高。相反,较高浓度赤霉素处理对孢子萌发产生一定的抑制作用。在植物的离体培养过程中,适宜的无机盐浓度是培养中的细胞所必需的[16]。不同蕨类植物的最适基本培养基有所不同[17]。在蕨菜孢子的萌发研究中,发现MS培养基是蕨菜孢子萌发的最佳培养基[18];在光叶蕨(C.chinensis)孢子萌发研究中,发现光叶蕨孢子在1/2MS培养基中的萌发率显著高于MS和1/4MS培养基[19]。此外,一些蕨类在低浓度的无机盐中萌发情况较好,有研究表明,高盐浓度的培养基会抑制一些蕨类孢子萌发[30]。在对金毛狗脊(Cibotium barometz)的萌发试验中,发现1/8MS为最佳萌发培养基[20];桫椤(Alsophila spinulosa)的孢子在1/5MS培养基和1/8MS培养基中萌发效果较好[21]。也有研究表明,营养液成分通常只影响配子体的发育,而对孢子萌发的影响不大[31],与本试验结果大致相符。出现以上差异的原因,可能与不同品种的植物适应生境不同有关。
本试验中掌叶铁线蕨在MS基本培养基中萌发情况最好,粗茎鳞毛蕨、溪洞碗蕨则对无机盐浓度的变化并不敏感。然而,随培养时间的延长,以1/4MS为基础培养基的各处理原叶体均长势不良、个体较小、颜色呈黄绿色;以MS和1/2MS为基础培养基的各处理原叶体长势旺盛、颜色翠绿。这与对阔鳞鳞毛蕨(D.championii)孢子无菌培养试验结果相吻合[22]。表明盐含量过低的培养基虽不会影响某些种类蕨类孢子的萌发,但在培养后期营养供应不足,不利于孢子萌发后的生长发育。
相关研究表明,组织培养时不同种类的蕨类植物孢子萌发适合的激素种类及浓度各不相同。用不添加任何激素的1/2MS培养基培养假鞭叶铁线蕨(Adiantum malesianum),孢子萌发生长良好[23]。在扇叶铁线蕨(A.flabellulatum)孢子萌发试验中,使用不添加任何激素的1/4MS培养基即可取得良好的萌发结果[24],这与粗茎鳞毛蕨、溪洞碗蕨萌发试验结果相符。同时,也有相关报道证明,采用适当的激素组合可以提高一些品种蕨类孢子的萌发率。袁艺等[25]研究了影响紫萁孢子萌发的因素,发现在培养基中添加1mg·L-16-BA+0.5mg·L-1NAA最有利于孢子萌发。郭庆勋等[26]探究了4种激素对猴腿蹄盖蕨(Athyrium multidentatum)孢子萌发的影响,发现NAA、2,4-D、BA、KT 4种激素中KT促进孢子萌发效果最好,BA和NAA次之。本试验中,掌叶铁线蕨在低浓度NAA和6-BA激素作用下同样获得更好的萌发效果。出现以上差异的原因,可能是由于不同孢子休眠特性和自身含有内源激素共同作用进而导致对外界激素生理反应的结果不同。研究表明,蕨类植物孢子需要通过光照打破休眠[27]。高大肾蕨(Nephrolepis exaltata)、粗脉蕨(Phlebodium aureum)及夏威夷树蕨(Cibotium glaucum)在有光条件下,孢子均可正常萌发,而在无光或黑暗环境中则几乎没有孢子的萌发[32]。张光飞等[28]认为光照是扇蕨(Neocheiropteris palmatopedata)孢子萌发的主要影响因子,光照条件下孢子萌发率达85%,黑暗中培养50d也不能萌发。均与本试验结果相符,表明光照是大部分蕨类植物孢子萌发的必要条件。
综上所述,在对当年采收掌叶铁线蕨、粗茎鳞毛蕨、溪洞碗蕨孢子萌发试验中,低浓度赤霉素处理、无机盐浓度的变化对于提高萌发率没有显著影响,较高浓度赤霉素处理显著降低孢子萌发率。在低浓度NAA和6-BA激素作用下,掌叶铁线蕨萌发率最高;粗茎鳞毛蕨、溪洞碗蕨则对低浓度的外源激素不敏感,高浓度外源激素会抑制3种蕨类植物孢子萌发。本试验初步探究了以上3种蕨类植物孢子的萌发特性,为实现其快速高效的人工繁殖奠定了基础。蕨类孢子萌发受到一系列外界条件的影响,不同种类所适应的生长环境也各不相同,目前的研究还远远不够。如何根据特定蕨类探究其最适生境,建立完善的快速繁殖体系,实现规模化生产以至推广应用,还有待进一步研究。
