不同时期花生茎叶中阿魏酸含量的提取及测定
2020-07-13欧可可张平平通信作者张丹丹赵晓彤
欧可可,张平平,2,通信作者,张丹丹,赵晓彤
不同时期花生茎叶中阿魏酸含量的提取及测定
欧可可1,张平平1,2,通信作者,张丹丹1,赵晓彤1
(1. 天津农学院 食品科学与生物工程学院,天津 300384;2. 天津市农副产品深加工技术工程中心,天津 300384)
建立一种不同时期花生茎叶中阿魏酸含量的高效液相色谱(HPLC)检测方法并测定其含量。以水为溶剂,在单因素试验的基础上,通过正交试验优化花生茎叶中阿魏酸提取条件并优化检测条件。结果表明:HPLC最佳检测条件为色谱柱Venusil XBP C18,流动相乙腈∶0.3%磷酸水溶液为20∶80,流速1.0 mL/min,检测波长320 nm,在3.0~50.0 μg范围内,阿魏酸浓度与峰面积呈现良好的线性关系,平均回收率为100.4%,=1.19%。此方法分析速度快、操作简便、结果的精密度与重现性好,可作为花生茎叶中阿魏酸含量的测定方法。阿魏酸最优提取条件:料液比为1∶100(g∶mL)、提取温度为95 ℃、提取时间为30 min;不同时期花生叶中阿魏酸含量均高于茎,其中初花期花生叶中阿魏酸含量是茎的2.1倍,成熟期花生叶中阿魏酸含量是茎的2.9倍。
花生茎叶;阿魏酸;提取工艺;HPLC
花生茎叶为豆科落花生属()植物落花生)的地上部分[1],我国花生种植广泛且品种丰富,在西藏、青海、宁夏以外地区均有大规模种植[2],而作为花生植株主体部分的茎叶主要用来制造动物饲料以及燃料,甚至很大一部分被直接丢弃,造成了极大浪费。研究表明,甾醇类、多酚类、有机酸类以及芳樟醇等物质[3]均为从花生茎叶中分离得到的主要化合物,具有镇静催眠[4-8]、降压[9]、抗氧化[10-11]等作用。上世纪80年代末王翘楚教授依据中医“天人相应”理论,以花生茎叶“昼开夜合”的特征,与人体“日出而作,日落而息;入夜则寐,入昼则寤”相一致,带领课题组对其进行了探索,花生枝叶的药用价值逐渐为人重视[3]。邓磊等[12-13]研究发现花生茎叶中阿魏酸能够通过干预不同脑域中与睡眠相关的4条信号通路实现对睡眠的积极调控,是改善睡眠的物质基础之一,因此对花生茎叶进行相关的研究及产品开发对失眠症患者改善睡眠具有重要的实用价值。
目前,对花生茎叶助眠的研究较多集中在将其进行简单的水提或有机溶剂提取得到提取物,随后进行动物助眠试验,而较少涉及助眠成分提取的工艺优化及提取物中的助眠成分分析。因此本研究以阿魏酸作为助眠成分检测指标,经单因素及正交试验对其提取条件进行优化,提高花生茎叶中阿魏酸的提取率,同时对阿魏酸的液相检测条件进行优化,对初花期和成熟期花生茎、叶中阿魏酸的含量差异及变化进行分析比较。为开发更高效助眠产品提供一定的理论参考依据,同时促进花生茎叶资源高值化综合利用。
1 材料与方法
1.1 材料与试剂
初花期、成熟期花生茎叶,自采于山东省济宁市泗水县张庄镇;阿魏酸标准品(纯度≥99.5%),Aladdin;乙腈(色谱纯),天津市圣信唯科技有限公司;磷酸(色谱纯),天津市光复精细化工研究所;无水乙醇(分析纯),天津市北辰方正试剂厂。
1.2 仪器与设备
热风干燥箱(DHG-9625A),上海一恒科学仪器有限公司;多功能粉碎机(400A),永康市红太阳机电有限公司;真空冷冻干燥机(LGJ-18S),北京松源华兴科技发展有限公司;旋转蒸发仪(CA-1115),上海亚荣生化仪器厂;高效液相色谱仪(Agilent1260),配紫外检测器,安捷伦科技有限公司。
1.3 试验方法
1.3.1 阿魏酸标准溶液的配制
精密称取阿魏酸标准品20.00 mg,置于50 mL棕色容量瓶中,加入70%的乙醇使其溶解,并定容至刻度,摇匀,制得0.4 mg/mL的阿魏酸标准溶液作为母液,4 ℃下避光存放备用。
1.3.2 样品制备
花生茎叶→清洗→热风干燥→粉碎→过40~60目筛→水提→过滤→旋蒸浓缩→离心→冷冻干燥→冻干粉(-20 ℃冰箱保存)。
要点如下。
(1)干燥:热风干燥至水分含量至5%;
(2)水提:料液比1∶100(g∶mL),提取温度95 ℃,提取时间30 min,提取次数2次;
(3)旋蒸:将滤液合并,经旋转蒸发仪浓缩15倍后,4 000 r/min离心10 min,取上清液。
分别准确称取0.50 g初花期、成熟期花生叶冻干粉末,置具塞锥形瓶中,准确加入70%乙醇5 mL,摇匀,过滤,取滤液,再将滤液过0.2 μm圆形滤器,即得。
分别准确称取0.50 g初花期、成熟期花生茎冻干粉末,置具塞锥形瓶中,准确加入70%乙醇4 mL,摇匀,过滤,取滤液,再将滤液过0.2 μm圆形滤器,即得。
1.3.3 液相色谱条件
色谱柱:Venusil XBP C18(4.6 mm×150 mm,5 μm);以乙腈∶0.3%磷酸水溶液=20∶80为流动相;1.0 mL/min流速,320 nm紫外检测波长,30 ℃柱温,5 μL进样量。
1.3.4 方法学考察
分别从0.4 mg/mL阿魏酸标准品母液中准确吸取75、125、250、500、1 250 μL至10 mL棕色容量瓶中,加70%乙醇定容至刻度,摇匀,制成梯度浓度分别为3、5、10、20、50 μg/mL阿魏酸标准品溶液,按1.3.3的色谱条件进样测定,以制作标准曲线。
取同一阿魏酸标准品溶液、放置不同时间的同一样品溶液,分别在1.3.3的最优色谱条件下进样6次检测分析,以此评价此方法精密度和稳定性;取在1.3.2条件下平行制备的6份样品溶液、6份已知样品阿魏酸含量的加标溶液,分别在1.3.3的最优色谱条件下进样检测分析,以此评价此方法的重复性和样品加标回收率。
1.3.5 花生叶中阿魏酸提取条件的优化
(1)单因素试验
以水作为提取溶剂,分别以粉碎度、料液比、提取温度、提取时间为因素设置单因素试验,从而考察不同提取条件对花生叶中阿魏酸含量的影响,单因素试验水平表见表1。
表1 单因素试验水平表
因素水平 粉碎度/目20~4040~6060~8080~100- 料液比/(g∶mL)1∶501∶701∶1001∶1251∶150 提取温度/℃80859095100 提取时间/min510203040
(2)正交试验
在单因素试验基础上,每种因素分别选取3个较优水平进行正交试验,设计L9(34)正交试验优化提取条件,考察粉碎度、液料比、提取温度、提取时间对花生叶中阿魏酸含量的影响,从而确定花生叶中阿魏酸的最佳提取条件,正交试验因素和水平见表2。
表2 正交试验因素水平表
水平A粉碎度B料液比C提取温度D提取时间 目g∶mL℃min 140~601∶759020 260~801∶1009530 380~1001∶12510040
2 结果与分析
2.1 方法学考察
2.1.1 阿魏酸标准曲线的绘制
以浓度(μg/mL)为横坐标(),峰面积积分值为纵坐标()进行回归分析,绘制标准曲线见图1,回归方程为=15.787+13.522,相关系数2=0.999 5,表明在3.0~50.0 μg范围内,阿魏酸峰面积值与进样量的线性关系良好。

图1 阿魏酸标准曲线图
标准品、样品的色谱图见图2和图3,标准品和样品都在5.7 min出峰且阿魏酸峰和样品中的其他组分均能达到基线分离。

图2 阿魏酸标准品色谱图

图3 样品色谱图
2.1.2 精密度分析
取同一阿魏酸标准品溶液,在1.3.3的色谱条件下,连续重复进样6次,结果见表3,阿魏酸标准品峰面积的为1.17%(=6),表明该方法有良好的精密度。
表3 精密度测定结果
组别123456平均值RSD/% 峰面积60.761.362.761.962.162.361.81.17
2.1.3 稳定性分析
取同一样品溶液,在1.3.3的色谱条件下,分别于0、2、4、6、8、10 h进样测定,结果见表4,供试品溶液中阿魏酸峰面积的为0.72% (=6),表明该试验中阿魏酸在放置10 h内稳定性良好。

表4 稳定性测定结果
2.1.4 重复性分析
取1.3.2条件下平行制备的同一样品溶液6份,按1.3.3的色谱条件进行分析检测,结果见表5,供试品溶液中阿魏酸峰面积的为1.44% (=6),表明该方法重现性优良。

表5 重复性测定结果
2.1.5 样品加标回收率分析
分别精密称取6份已知阿魏酸含量的花生叶冻干粉0.20 g,分别准确加入阿魏酸标准品溶液(0.4 mg/mL)50 μL,按1.3.3的色谱条件进行分析检测,结果见表6,平均加样回收率为100.4%,=1.19%,表明该方法的加样回收良好、结果可靠,可以用于花生茎叶中阿魏酸含量的测定。

表6 回收率测定结果
2.2 花生叶中阿魏酸提取条件的优化
2.2.1 单因素试验
由图4可知,当粉碎度在80目以上时,阿魏酸含量明显下降;当粉碎度为60~80目时,阿魏酸含量达到最高,这可能是由于颗粒较大时,与水的接触面积过小,从而使得溶出率降低[14]。由图5可知,当料液比为1∶100(g∶mL)时,阿魏酸含量达到最高;继续使溶剂用量加大,则含量趋于稳定。这可能由于在适当的溶剂用量下,阿魏酸的含量达到了溶出饱和,之后含量则基本趋于不变[15]。因此,选择的粉碎度为60~80目、料液比为1∶100(g∶mL)。

图4 粉碎度对花生叶阿魏酸含量的影响

图5 料液比对花生叶阿魏酸含量的影响
由图6可知,在80~90 ℃时,随温度升高,阿魏酸含量增加缓慢,可能由于较低水温无法破坏花生叶粉与水分子间的吸附作用,使含量处于较低水平[16];当温度为95 ℃时,含量达到最大值,继续升高温度,阿魏酸含量稍有增加,可能与阿魏酸溶于热水的性质有关。由图7可知,在20 min内时,阿魏酸含量随时间的延长增加较快;随后在浸提30 min时,含量达到最大值;30 min以后,阿魏酸含量增加较少,可能由于花生叶中阿魏酸需要一定时间才能达到溶出平衡,平衡后提取率的变化则较小[15]。因此,选择的温度为95 ℃、提取时间为30 min。

图6 提取温度对花生叶阿魏酸含量的影响
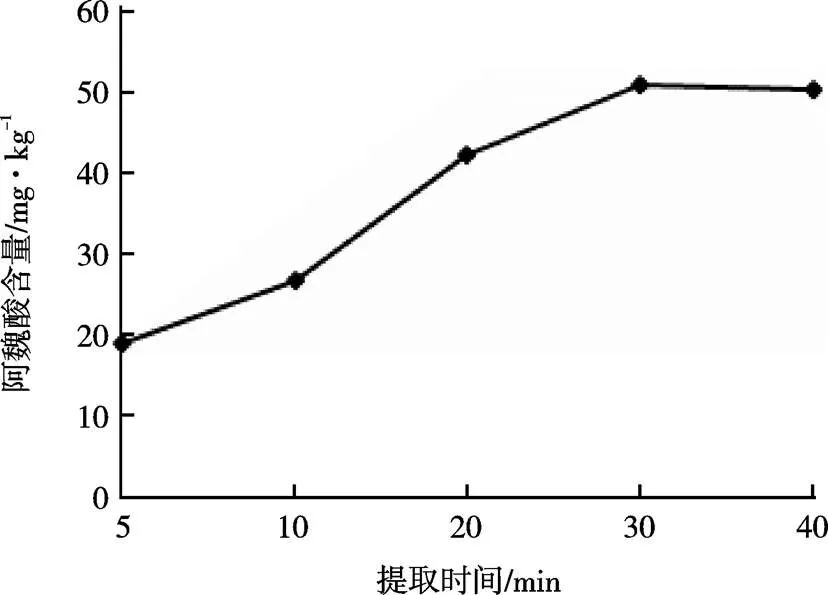
图7 提取时间对花生叶阿魏酸含量的影响
2.2.2 正交试验
由正交试验结果表7和表8可知,粉碎度、料液比、提取温度和提取时间4个因素对阿魏酸的溶出量均产生了不同程度的影响,其主次顺序为:料液比>提取温度>提取时间>粉碎度,其中料液比、提取温度和提取时间对花生叶中阿魏酸的提取有显著影响,由此可见,此三者的选择是影响阿魏酸溶出率最重要的因素。结合正交试验中较优提取条件为A1B2C2D2进行验证,测得花生叶中阿魏酸含量为50.12 mg/kg,即粉碎度40~60、料液比1∶100(g∶mL)、提取温度95 ℃、提取时间30 min为最优提取条件。

表7 正交试验结果
表8 正交试验方差分析
注:*表示差异显著,即P<0.05
2.3 不同时期花生茎、叶中阿魏酸含量的测定
分别取1.2.2条件下制备的初花期、成熟期的花生茎、叶,按1.2.3的色谱条件进行分析检测,平行测定3次,依据测得的峰面积计算阿魏酸的含量,结果见表9。
表9 不同时期花生茎、叶中阿魏酸含量 分类峰面积阿魏酸浓度阿魏酸含量 μg·mL-1mg·kg-1 初花期花生叶219.813.0746.40±0.08 初花期花生茎138.37.9022.44±0.11 成熟期花生叶246.314.7452.33±0.07 成熟期花生茎135.17.7018.05±0.10
由表9可知,成熟期花生叶中阿魏酸含量是茎的2.9倍,初花期花生叶中阿魏酸含量是茎的2.1倍,初花期和成熟期的花生叶中阿魏酸含量均高于花生茎,且初花期和成熟期花生叶中阿魏酸含量无明显差异。
由表1可以看出采用创客教育模式后:第一,学生成绩有所提高;第二,小组实践项目数明显提高,学生根据自己兴趣爱好选取项目,不再是教师按照自己意愿单一布置实践项目,实践操作范围明显提高。第三,项目成果应用显著提高,创客教育模式下的项目成果不但可以上传到创客网络平台供后期学生使用,而且最主要的是可以进行项目后期拓展延伸,挖掘潜力,提高学生学习积极性及成就感。综上所述,创客教育模式是目前高职院校教学改革一个重点发展方向,是创新型技能人才的摇篮,目前创客教育还处于理论到实践的摸索阶段,需要每位教师积极探索研究将改革之路延伸下去,完善创客教育人才培养模式。
3 结论
本试验在单因素试验的基础上,通过正交试验确定花生叶中阿魏酸的最佳提取条件:粉碎度40~60目,料液比1∶100(g∶mL),提取温度95 ℃,提取时间30 min;并建立了一种测定花生茎叶中阿魏酸含量的高效液相色谱法:色谱柱为Venusil XBP C18,流动相为乙腈∶0.3%磷酸水溶液=20∶80,流速1.0 mL/min,检测波长320 nm,柱温为30 ℃,进样量5 μL。结果表明:此优化条件下得到的不同时期花生叶中阿魏酸含量均高于茎,其中初花期花生叶中阿魏酸含量是茎的2.1倍,成熟期花生叶中阿魏酸含量是茎的2.9倍,且初花期和成熟期花生叶中阿魏酸含量无明显差异。并且所建立的花生茎叶中阿魏酸的高效液相色谱分析方法具有较好的精密度、稳定性、重现性,平均回收率为100.4%,RSD为1.19%,可作为花生茎叶中阿魏酸含量的测定方法。
参考文献:
[1] 罗争辉,蔡百祥,梁益敏,等. 花生茎叶酚性成分研究[J].广西植物,2014,34(1):139-142.
[2] 王强. 花生加工品质学[M]. 北京:中国农业出版社,2013.
[3] 冯蓓蕾,陈淼,陆逸莹,等. 花生枝叶的研究现状[J]. 吉林中医药,2016,36(2):187-190.
[4] 张晓峰,庞传宇,王翘楚,等. 花生枝叶制剂的镇静催眠作用研究[J]. 中药药理与临床,2002,18(2):23-24.
[5] 郭福新,李如奎,许红,等. 落花生枝叶制剂对缺血性中风后失眠烦躁不安的疗效观察[C]//中国中西医结合学会. 中国中西医结合学会成立20周年纪念大会论文集. 北京:《中国学术期刊》电子杂志社,2001:168.
[6] 刘劲松,李莉,陈爱民,等. 花生茎叶不同提取部位对小鼠镇静催眠作用的初步探讨[J]. 中药材,2012,35(11):1833-1836.
[7] 李欣芮,陆永攀. 红皮、黑皮花生茎叶对小鼠镇静催眠作用的对比研究[J]. 西部中医药,2016,29(1):12-14.
[8] Zu X Y,Zhang Z Y,Xiong G Q,et al. Sedative effects of Arachis hypogaea L. stem and leaf extracts on sleep‑deprived rats[J]. Experimental and Therapeutic Medicine,2013,6:601-605.
[9] 韦国锋,覃特营,何有成. 花生茎叶降压作用有效成分的[J]. 右江民族医学院学报,1991,13(2):11-13.
[10] 鉏晓艳,王玮琼,熊光权. 花生茎叶多糖提取工艺优化及抗氧化性研究[J]. 粮食与油脂,2017,30(7):99-102.
[11] 程雅芳,李全文,续颖,等. 花生茎中白藜芦醇的提取及体外抗氧化性的研究[J]. 食品工业科技,2011,32(7):144-146.
[12] Deng L,Shi A M,Liu H Z,et al. Identification of chemical ingredients of peanut stems and leaves extracts using UPLC-QTOF-MS coupled with novel informatics UNIFI platform[J]. Journal of Mass Spectrometry,2016,51(12):1157-1167.
[13] 邓磊. 花生茎叶提取物促睡眠活性物质鉴定及作用机制研究[D]. 北京:中国农业科学院,2017.
[14] 王强. 老香黄袋泡茶和老药桔袋泡茶制备工艺的研 究[D]. 乌鲁木齐:新疆农业大学,2013.
[15] 寇莹莹,仝其根. 响应面法优化桂皮胶的提取工艺[J]. 食品工业科技,2018,39(2):156-162,167.
[16] 刘姗姗. 分心木袋泡茶制备工艺研究[D]. 乌鲁木齐:新疆农业大学,2015.
Extraction and determination of ferulic acid in peanut stems and leaves at different stages
OU Ke-ke1, ZHANG Ping-ping1, 2, Corresponding Author, ZHANG Dan-dan1, ZHAO Xiao-tong1
(1. College of Food Science and Biotechnology, Tianjin Agricultural University, Tianjin300384, China; 2. Tianjin Engineering and Technology Research Center of Agricultural Products Processing, Tianjin300384, China)
Abstract: A high performance liquid chromatography(HPLC)method was established for the determination of ferulic acid in peanut stems and leaves at different stages. Based on the single factor experiments, orthogonal experiment was used to optimize extraction condition and the HPLC detection condition. The best HPLC condition was as follows: the analytical column was a Venusil XBP C18; The mobile phase consisted of acetonitrile-0.3% phosphoric acid aqueous solution(20∶80); Flow rate was 1.0 mL/min, and detection wave length was 320 nm. In the range of 3.0~50.0 μg, there is a good linear relationship between ferulic acid concentration and the peak area. The average recovery of the method was 100.4% with a RSD of 1.19%(n=6). This method has the advantages of fast analysis, simple operation, good precision and reproducibility, and is suitable for determination of ferulic acid content in peanut stems and leaves. The optimal extraction condition for ferulic acid was: ratio of material to liquid 1:100(g:mL), extraction temperature 95 ℃, extraction time 30 min. The content of ferulic acid in peanut leaves was higher than that in stems at all stages. At initial flowering stage, the content of ferulic acid in peanut leaves was 2.1 times that of stems. At the ripening stage, the ferulic acid content was 2.9 times that of the stem.
Key words: peanut stems and leaves; ferulic acid; HPLC
文章编号:1008-5394(2020)02-0061-05
DOI:10.19640/j.cnki.jtau.2020.02.014
中图分类号:O657.63;R284.1
文献标识码:A
收稿日期:2019-05-06
基金项目:天津市科技计划项目(16YFNZNC00020)
作者简介:欧可可(1991-),女,硕士在读,主要从事农副产品深加工及其利用研究。E-mail:15002276705@qq.com。
通信作者:张平平(1970-),女,教授,博士,主要从事果蔬深加工研究。E-mail:zpp613@163.com。
责任编辑:张爱婷
