濒危植物永瓣藤种子生活力测定研究
2020-07-09卢晓燕程家寿刘抗旱
潘 健, 卢晓燕, 程家寿, 房 震, 刘抗旱
(1.黄山学院生命与环境科学学院, 安徽 黄山 245041; 2.祁门县查湾森工采育场, 安徽 黄山 245609)
永瓣藤(MonimopetalumchinenseRehd)是我国特有的二级保护珍稀树种,隶属卫矛科(Celastraceae)永瓣藤属,为单型属植物,因其花瓣宿存在果实上不凋落,故名永瓣藤。模式标本采于安徽省祁门县潘坑坞,目前仅残存于安徽西南部、江西北部景德镇、湖北通山和浙江金华沙畈乡海拔200~900 m的狭窄山谷、沟边或山坡林中,且分布区域正呈逐渐缩小趋势[1-3]。由于它的分类位置孤立,因此在研究卫矛科系统演化上具有重要的意义[4]。永瓣藤在江西民间常用于治疗风湿性关节炎[5],近年来对其茎叶化学成分研究表明,永瓣藤含有大量的药用成分,具有潜在的药用价值,在医学、营养学上有具有很高的研究意义[6-11]。其叶色四季变化明显,秋冬季叶片开始转为紫红色或黄色,经冬不落,直到翌年早春新芽萌发后始渐落,具有较高的观赏价值,可开发用于垂直绿化和盆景树种。因此,永瓣藤是一类集观赏、药用、科研于一体,具有极大开发潜力的珍稀物种。但自然条件下的永瓣藤结实率低,落花落果和败育现象很普遍,种皮的极度石化或骨质化,使种子萌发困难[4],严重阻碍其保护和进一步开发的进程。目前,国内学者主要从地理分布、群落学、种群生态学、分子生物学等[1,12-16]方面对永瓣藤致濒原因进行了探讨,并取得了一定进展,但对永瓣藤种子生物学方面的基础研究仍十分欠缺。
种子生活力是种子质量的一项重要指标[16],它能衡量种子发芽的潜在能力,通常采用发芽试验方法测定[17]。在适宜的环境条件下,有生活力的种子都能够萌发[18]。由于永瓣藤种子存在休眠现象,所以常规的发芽测定方法不能很快检测种子质量状况,而四唑(2,3,5-氯化三苯基四氮唑,TTC)法是目前公认最为有效的快速测定种子生活力的方法[19-20],并且不受种子休眠的限制[21]。因此,本试验采用TTC染色法研究永瓣藤种子生活力的快速测定条件,为确定种子发芽潜力、评定种子质量及探讨永瓣藤有性生殖的濒危机制提供参考。
1 材料与方法
1.1 供试材料
永瓣藤种子于2014年10月采自安徽省祁门县牯牛降自然保护区(30°01′110″N,117°30′765″E),净种后冷藏备用。
1.2 试验方法
参照ISTAF(国际种子检验协会)种子检验规程[22],于2015年3月采用四唑(TTC)染色法测定永瓣藤种子生活力。
1.2.1正交试验设计
为确定永瓣藤种子生活力测定的最佳条件,本实验采用了3因素3水平的正交试验L9(34)设计法比较染色时间、TTC溶液浓度、TTC溶液pH值等因素对种子生活力的影响(表1)。

注:A为煮死胚染色;B为胚根处染色;C为胚染成浅红色;D为胚染成红色。
表1 正交试验因素水平

水平因素A(染色时间/h)B(TTC浓度/%) C (pH值)120.16.5230.57.0341.07.5
1.2.2种子预处理
用蒸馏水浸泡永瓣藤种子24 h,待种子充分吸收水分后,取出种胚,置于培养皿中备用。培养皿中放有湿润的滤纸,防止种胚缺水而失去生活力。每处理3次重复,每重复30个种胚,对照为煮沸失活的永瓣藤种胚。
1.2.3TTC溶液的配制
用蒸馏水分别配制pH值为6.5、7.0、7.5的磷酸缓冲液各200 mL,再用不同pH值的磷酸缓冲液溶解相应质量的红四啖唑,配制成质量分数分别为0.1%、0.5%、1.0% 的TTC溶液。
1.2.4种子生活力染色观察
将染色的种胚冲洗干净后在光学显微镜下观察并拍照,记录染色情况。判断种子生活力的标准参考ISTAF(国际种子检验协会)种子检验规程[22]:胚的主要组织染成粉红色或红色即为有活力种子,仅胚根染色或未染成颜色为无活力种子。
染色率(%)=(染色数/种子总数)×100%。
1.3 数据处理
用Excel 2010、SPSS 17.0软件进行数据分析和多重比较。
2 结果与分析
2.1 永瓣藤种子染色率极差分析
永瓣藤种胚染色主要出现4种状态(图1)。试验结果(表2)表明,处理3(2 h染色时间、1.0% TTC溶液浓度、pH=7.5)染色率最高,为94.4%,观察结果也说明该处理的染色效果最明显,而且染色均匀(图1-D)。处理1(2 h染色时间、0.1%TTC溶液浓度、pH=6.5)染色率最低,为47.8%,胚及子叶染色比较浅,呈浅红色(图1-C),还有部分胚只有胚根染色,子叶未染色(图1-B)。
表2 各处理永瓣藤种子染色结果
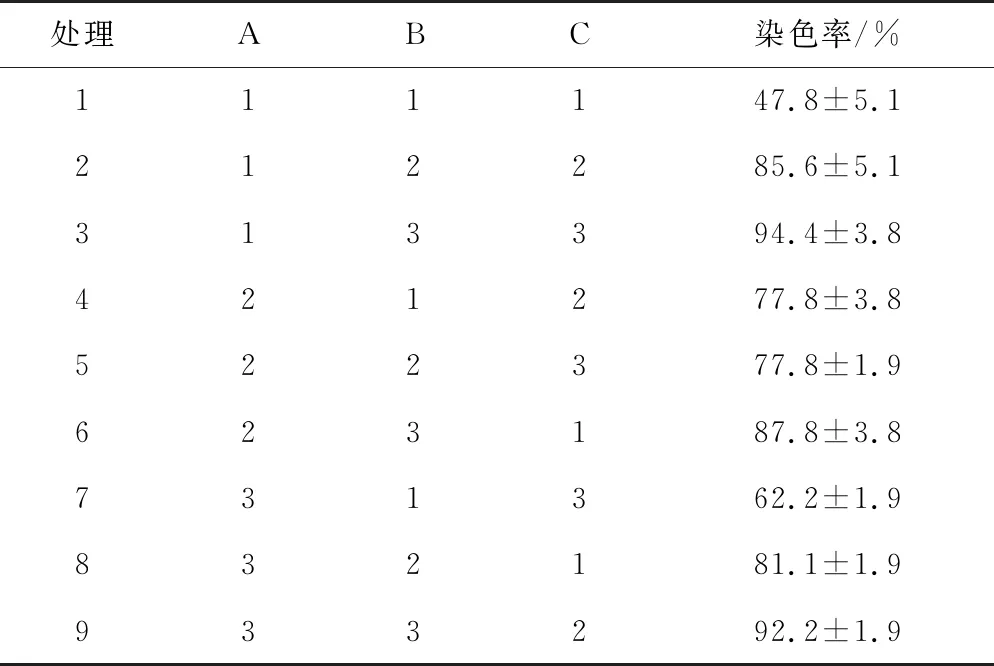
处理ABC染色率/%111147.8±5.1212285.6±5.1313394.4±3.8421277.8±3.8522377.8±1.9623187.8±3.8731362.2±1.9832181.1±1.9933292.2±1.9
极差值(R)的大小可以判断各因素影响作用的大小,R值越大,说明该因素对该指标的影响越大。由图2可知,TTC溶液浓度R值最大(28.9),其次为TTC溶液的pH值(13.0),染色时间的R值最低(5.2),因此各因素对永瓣藤胚染色率影响的主次因素为B>C>A,最佳组合为A2B3C2,即将永瓣藤胚放入pH=7.0,浓度为1.0%TTC溶液中浸泡3 h,染色效果最好。
2.2 永瓣藤种子染色率方差分析
极差分析可以简单直观的反映试验结果,但不能反映其误差大小和精度,因此,还需进行方差分析。不同试验因素和水平下的胚染色率方差分析的结果显示(表3),TTC溶液浓度和pH值对染色率有极显著影响(p<0.01),染色时间对染色率有显著影响(p<0.05),各因素对染色率影响的主次因素依次为B>C>A,这与极差结果一致。多重比较的结果(图2)表明,染色处理2 h与3 h差异显著,但与染色处理4 h差异不显著,染色处理3 h与4 h差异不显著;TTC浓度、pH值各因素各水平两两之间差异均显著,其中1.0% TTC溶液的染色率最高,为91.5%。

图2 染色率与各因素和水平的关系
表3 永瓣藤种子染色率的方差分析

方差来源偏差平方和自由度均方F显著性A0.01220.0065.0690.020*B0.38820.194162.9320.000**C0.07620.03831.8630.000**
注:“**”表示试验因素在p<0.01水平上差异极显著,“*”表示试验因素在p<0.05水平上差异显著。
3 结论与讨论
本试验中,染色率最高的为处理3,即pH=7.5、浓度为1.0%的TTC溶液避光染色2 h,此组合胚的染色效果较好,呈均匀的鲜红色或红色。极差分析表明,pH=7.0、浓度为1.0%的TTC溶液避光染色3 h为最优组合。方差分析显示,染色3 h的染色率显著高于2 h处理,pH=7.0的染色率显著高于pH=7.5处理。综上所述,永瓣藤种胚TTC染色的最佳处理组合为A2B3C2,即pH=7.0、浓度为1.0%的TTC溶液避光染色3 h。
经TTC法测定,冷藏半年永瓣藤饱满种子的生活力高达94.4%,与靛蓝染色测定其种子生活力结果相似[23],但与谢国文[24]研究结果相反,究其原因可能与种子贮藏方式有关。孙维敏等[25]用外源赤霉素处理冷藏1年的永瓣藤种子做发芽试验,其发芽率最高可达88.5%,间接证明本试验用四唑法测永瓣藤种子生活力结果的可靠性。谢国文试验中显示经TTC测定,干燥贮藏半年的种子几乎全部丧失活力,说明永瓣藤种子生活力在不适宜环境条件下会下降很快,低温冷藏有利于种子保持较长活力[26],可见温度是限制永瓣藤种子保存的重要生态因子。
种子是植物进行有性生殖的重要器官之一。大多数的植物依靠有性繁殖产生后代而使物种延续[27]。在自然界中,永瓣藤主要是依靠匍匐茎和根系萌芽产生新植株进行种群更新[1,28]。群落调查表明野外几乎难见实生苗,也从另一个角度说明永瓣藤很难依靠土壤种子库中储藏的种子,产生一定数量的幼苗,为林分的自我更新创造条件。虽然成熟永瓣藤种子具有较高生活力,内在的发芽潜力很大,但萌发率极低,可见并不是因为永瓣藤种胚活力低,而是因为永瓣藤种子具有休眠特性[23]。种子结实率低[24]、种子具休眠特性[23],极大限制了永瓣藤有性繁殖,另一方面永瓣藤种子在干燥环境下极易丧失生活力[24],很难形成持久的土壤种子库,加上环境对种子、幼苗的筛选淘汰,这些因素可能是导致其濒危的主要内在原因。
测定种子生活力是检验种子质量高低的一项可靠指标[29],本研究摸索出离体胚直接染色测定永瓣藤种子生活力,具有快速、准确,不受种子休眠限制的特点。
