莲草直胸跳甲不同发育阶段内参基因的筛选与验证
2020-07-09贾栋纪周瑜刘艳红袁晓芳张彬马瑞燕
贾栋 ,纪周瑜 ,刘艳红 ,袁晓芳 ,张彬 ,马瑞燕 *
(1.山西农业大学植物保护院,山西太谷030801;2.山西农业大学园艺学院,山西太谷030801)
基因表达分析在分子生物学研究中发挥越来越重要的作用。常用的基因表达分析技术包括Northern 印迹、实时定量 PCR(Quantitative realtime PCR,qPCR)、基因芯片、转录组测序等方法。在这些技术中,qPCR 被认为是分析特定基因表达的首选方法,由于其高度的灵敏性、准确性、特异性和快速性而被众多研究者广泛使用[1,2]。即便使用基因芯片或测序等高通量方法进行研究,往往还需要qPCR 对研究结果进一步验证。然而qPCR数据的真实可靠性常受到内参基因、模板质量、反转录与扩增效率等因素的影响,关乎研究基因的差异表达判断的准确性[3,4]。因此,为了减少试验误差,选择合适的qPCR 数据标准化方法至关重要,但也存在很多困难[4,5]。使用稳定表达的内参基因是目前最常用的qPCR 数据标准化方法之一,特别是使用2-ΔΔCt方法时,内参基因的选择尤为重要[4,6]。
理想的内参基因应该不受实验过程和条件的影响,具有高表达,并且在不同处理和组织中表现出相似的、稳定的表达水平[7]。一些传统的看家基因被认为在任何实验条件下都是稳定表达的,常被研究者用作内参基因,例如β-肌动蛋白(β-actin)、甘油醛-3-磷酸脱氢酶(GAPDH)和18S 核糖体 RNA(18S rRNA)[8,9]。然而,研究已经证明这些被广泛使用的看家基因在不同实验条件下的表达是存在差异的,用于qPCR 数据的标准化可能会导致错误的实验结果[10,11],可以认为没有任何一种内参基因适用于所有细胞、组织类型以及试验条件[12]。此外,内参基因的数量对qPCR 数据标准化也有影响[11]。因此,qPCR 试验研究前内参基因的 筛 选 评 估 是 至 关 重 要 的 。 ΔCt[13]、geNorm[4]、NormFinder[14]和 BestKeeper[15]4 种 程 序 经 常 被 用来评估确定合适的内参基因,基于网络的在线工具 RefFinder[16]集 成了以上 4 个 程序用来综 合 评估最适内参基因。
莲草直胸跳甲Agasicles hygrophilaSelman &Vogt,原产于南美洲阿根廷,是世界范围内恶性入侵杂草喜旱莲子草Alternanthera philoxeroides的专食性天敌昆虫[17,18]。莲草直胸跳甲的生态适应性与寄主专一性的分子机制一直是本课题组感兴趣的研究方向,常涉及相关基因的表达分析,前期研究发现内参基因的不稳定表达常常会导致实验结果的误判。本研究中,笔者从昆虫学的一些经典期刊论文中选取了9 个常用的候选内参基因:β-肌动蛋白(β-actin)、核糖体蛋白 L13a(RPL13a)、18S 核糖体蛋白(RPS18)、泛素(UBC)、α 延伸因子(EF-1α)、核糖体蛋白 S6(RPS6)、甘油醛-3-磷酸脱氢酶基因(GAPDH)、α-微管蛋白(α-Tubulin)与β-微管蛋白(β-Tubulin),评估了这些基因在莲草直胸跳甲不同发育阶段的表达稳定性,以确定莲草直胸跳甲不同发育阶段的最适内参基因,用莲草直胸跳甲小分子热激蛋白基因shsp20.8进一步验证内参基因的表达稳定性。本研究首次对莲草直胸跳甲不同发育阶段的内参基因进行了筛选,为后续相关基因表达分析提供参考。
1 材料和方法
1.1 试验材料
莲草直胸跳甲最初采集于华南农业大学,之后种群在标准化条件(25℃±1℃,L∶D=14∶10,RH=85%±5%)下饲养于山西农业大学养虫室达10 年以上,因此种群具有相似的遗传背景。用于饲养供试昆虫的喜旱莲子草采自浙江省玉环市,现种植于山西农业大学生物安全与生物防治研究基地温室中。
1.2 试验方法
1.2.1 昆虫样品收集
为使试验结果准确可靠,试验前对莲草直胸跳甲的卵进行了同步化,即卵块均为3 h 内所产。不同发育阶段的取样分别为:1 日龄卵,1 日龄的1、2、3 龄幼虫,2 日龄蛹和1 日龄成虫。所取样品均在标准条件下饲养,3 次重复。收集不同发育阶段样品液氮速冻后存放于-80℃冰箱备用。
1.2.2 RNA 提取 与 cDNA 合成
莲草直胸跳甲不同发育阶段的样品使用TRIzol 试 剂(Life Technologies,Carlsbad,CA,USA),参照说明书操作方法提取总RNA。Bio-Photometer Plus(Eppendorf,Hamburg,Germany)测定其浓度和纯度,并用1%琼脂糖凝胶电泳检测总RNA 的完整性。使用PrimeScript ™试剂盒(Perfect Real Time)(TaKaRa,Dalian,china)合成cDNA,用于 qPCR 分析。
1.2.3 基因选择与引物设计
莲草直胸跳甲9 个候选内参基因(β-actin、RPL13a、RPS18、UBC、EF-1α、RPS6、GAPDH、α-Tubulin、β-Tubulin)的序列均从前期已完成的三代转录组测序结果中获取,并经过序列比对分析确认。shsp20.8基因序列前期已克隆鉴定并提交至GenBank 数据库(MN685581),引物设计使用在线软件 primer3(http://primer3.ut.ee)完成,引物具体信息见表1,在进行qPCR 前先通过RT-PCR进行引物特异性验证。
1.2.4 实时定量PCR
qPCR 所使用的仪器为 ABI 7500(Applied Biosystems,Foster City,CA,USA),试 剂 为SYBR Green Realtime PCR Master Mix(Toyobo,Osaka,Japan),qPCR 反应程序为:95 ℃预变性 2 min,之后 95 ℃变性 15 s,60 ℃退火 15 s,72 ℃延伸30 s,共 40 个循环。然后通过 60 ℃至 95 ℃熔解曲线检测是否存在非特异性扩增和引物二聚体。
1.3 统计分析
使用 ΔCt、geNorm、NormFinder 和 BestKeeper4 种程序综合评估9 个内参基因的表达稳定性,通过geNorm 的配对差异值Vn/Vn+1 以确定最佳内参基因数目,阈值为0.15。以shsp20.8为靶基因对内参基因的稳定性进行验证,相对表达量数据 均 采 用 2-ΔΔCt法 分 析 处 理[19]。 试 验 数 据 通 过SPSS 21.0 软件进行单因素方差分析(one-way ANOVA),使用 Tukey’s HSD 算法,差异显著性标准为P<0.05。所有的柱状图均由SigmaPlot 12.5 绘制。
2 结果与分析
2.1 引物特异性分析
莲草直胸跳甲候选内参基因的RT-PCR 扩增结果如图1 所示,均得到预期片段的单一条带。9个内参基因qPCR 的熔解曲线均显示为单一、清晰的峰,没有其他杂峰(图2)。这表明每对引物扩增出单一的产物,没有其他非特异产物和引物二聚体。
2.2 内参基因的稳定性分析
9 个候选内参基因的稳定性由ΔCt、geNorm、NormFinder 和BestKeeper 4 种程序来评估分析,具体4 种程序的算法在其文献中均有详细描述[4,13~15]。分析结果表明 BestKeeper 分析的基因稳定性排名与其他3 种方法差异较大,RPS18、RPL13a、RPS6基因在 ΔCt、geNorm、NormFinder的稳定分析中均排名前三,而只有RPS18在Best-Keeper 计算的结果中排名前三。RefFinder 计算的综合排名为:RPS18>RPL13a>RPS6 >β-actin >α-Tubulin >UBC >β-Tubulin >GAPDH >EF-1α(表 2)。

表1 qPCR 靶基因和内参基因引物Table 1 Primer pairs used for qPCR analysis of target and reference genes
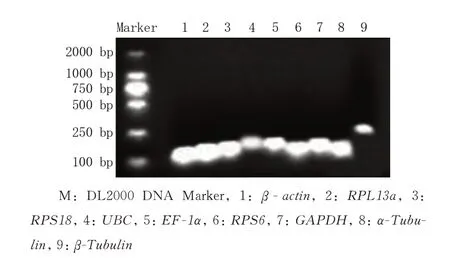
图1 莲草直胸跳甲9 个候选内参基因RT-PCR 产物检测Fig.1 Detection of RT-PCR products of 9 candidate reference genes in A.hygrophila
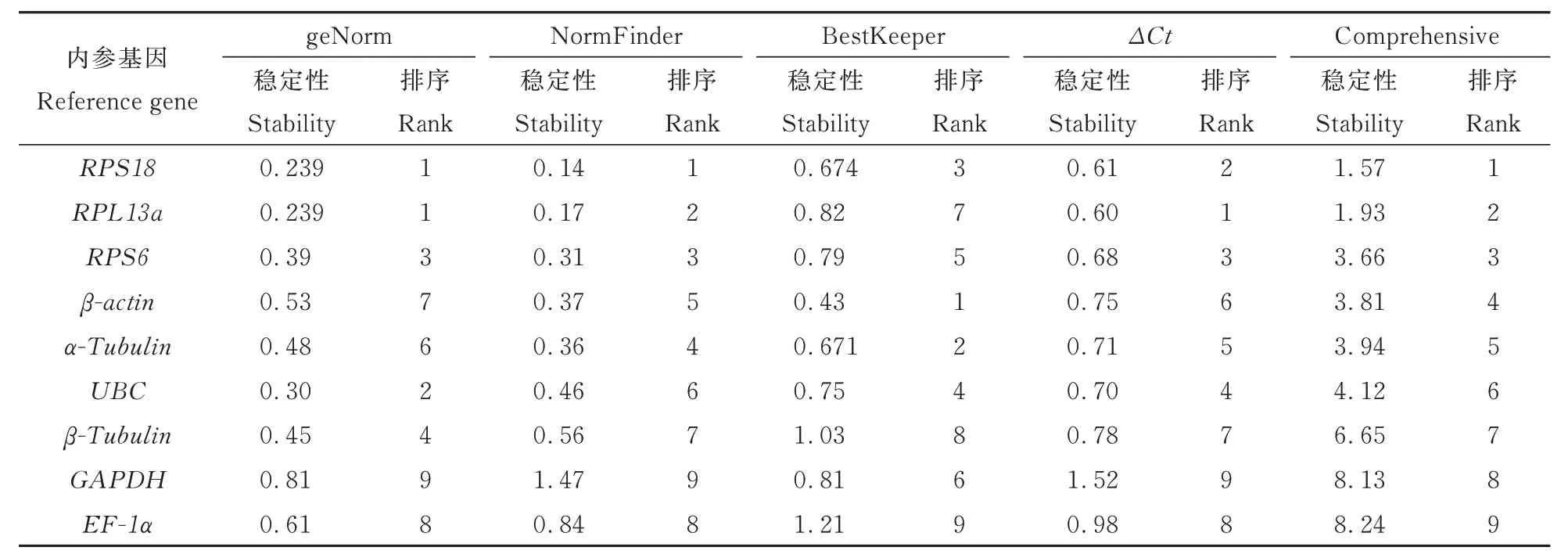
表2 莲草直胸跳甲不同发育阶段内参基因的表达稳定性Table 2 Stability of reference gene expression at different developmental stages of A.hygrophila
2.3 最佳内参基因数目的确定

图2 候选内参基因的熔解曲线Fig.2 Melt curves of candidate reference genes
在基因的表达研究中,通常需要2 个及以上内参基因标准化实验数据,以减少误差。geNorm 是确定所需内参基因数目的常用软件,该方法通过配对差异值Vn/Vn+1 确定最佳内参基因数,软件说明书推荐V 阈值为0.15,当V 值低于0.15 即没有必要增加内参基因的数量,即最佳内参基因的数量为n。本研究所有的配对差异值Vn/Vn+1 均小于0.15,因此选择需要2 个(V2/V3)内参基因共同标准化qPCR 数据,根据上述稳定性排序选择RPS18和RPL13a作为最佳内参基因组合(图3)。
2.4 内参基因的稳定性验证
为了检验所选内参基因的稳定性,使用不同内参基因评估了莲草直胸跳甲shsp20.8基因在各发育阶段的表达模式。使用最稳定的内参基因组合(RPS18和RPL13a)、最不稳定的内参基因(EF-1α)分别标准化shsp20.8表达数据。结果表明,不同发育阶段shsp20.8基因的表达量在统计学上有显著差异(P< 0.05),均在卵期和蛹期表达量最高,其它发育阶段表达较低。但是,当使用RPS18和RPL13a标准化数据时,莲草直胸跳甲shsp20.8的表达量在卵期最高(表达量是成虫期的20 倍),而使用EF-1α标准化shsp20.8的表达量在蛹期最高(表达量是成虫期的45 倍)(图4)。因此,使用上述不同内参基因分别标准化目的基因shsp20.8的表达谱数据会获得不同的试验结果。
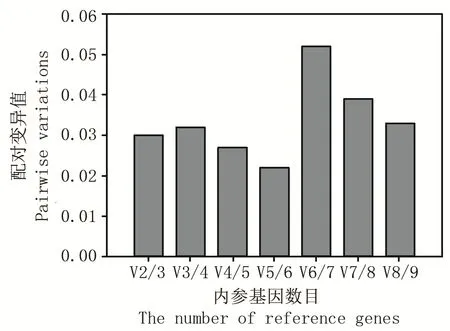
图3 莲草直胸跳甲数据标准化最佳内参基因组合Fig.3 The optimal combination of reference genes for normalization in A.hygrophila
3 讨论与结论

图4 莲草直胸跳甲不同发育阶段不同内参基因shsp20.8 的表达Fig.4 Expression levels of shsp20.8 at different developmental stages of A. hygrophila using various reference genes for normalization
qPCR 是基因表达研究中最常使用的技术,但需要使用稳定表达的内参基因进行数据标准化以减少实验误差。现在越来越多的研究表明,没有单一的通用基因在所有实验条件下都能稳定表达,用于 qPCR 数据的标准化[11,20]。但是诸多研究者未经评估验证便使用一些常用的看家基因,有文献报道,在近90%的高影响因子期刊上未经验证便使用了ACTB和GAPDH作为内参基因[10]。
本 研 究 通 过 ΔCt、geNorm、NormFinder 和BestKeeper 4 个程序综合评估分析了9 个内参基因在莲草直胸跳甲不同发育阶段的表达稳定性。分析结果显示,不同算法的分析结果存在差异,ΔCt、geNorm、NormFinder 得到了较为相似的排名,RPS18、RPL13a、RPS6三 个 基 因 均 位 列 前 三 ,GAPDH和EF-1α均 排 名最后 2 位 ,与 RefFinder计算的综合排名一致。然而,BestKeeper 稳定性排名与上述3 种算法差异较大。在东亚飞蝗内参基因的筛选中也发现BestKeeper 的分析结果不同于其它算法的类似情况[21]。
在二化螟[22]、东亚飞蝗[21]与西花蓟马[23]内参基因的评估中认为,EF-1α是不同发育阶段较为稳定的内参基因。本文研究结果表明,莲草直胸跳甲最稳定的内参基因为RPS18、RPL13a,而EF-1α为最不稳定的内参基因,该结果也直接证实在不同昆虫的发育阶段内参基因是不同的。内参基因的稳定性因昆虫组织、发育阶段、物种和各种非生物胁迫条件的不同而不同,Shakeel 等[20]在 qPCR 内参基因在昆虫基因表达的研究进展中也有较为详细论述。因此笔者建议,在qPCR 之前应验证内参基因的稳定性,并使用多个内参基因以获得准确结果。
为了进一步验证内参基因的稳定性对qPCR基因表达分析结果的影响,本文分析了shsp20.8在莲草直胸跳甲不同发育阶段的表达,发现使用最稳定和最不稳定内参基因对数据的标准化结果存在明显差异。因此,选择合适稳定的内参基因是准确评估靶基因表达的关键。综上所述,本研究确定了莲草直胸跳甲不同发育阶段的最适内参基因RPS18和RPL13a,为今后相关基因的表达研究奠定了理论基础,同时为内参基因的筛选评估提供方法参考。
