草莓炭疽病拮抗菌SKL108的分离、鉴定及拮抗活性
2020-07-06刘程程王媛花张雯婷储西平明亮
刘程程 王媛花 张雯婷 储西平 明亮


摘要:为了寻找优质高效的生物菌种资源,从森林土壤中分离出175个菌落特征相异的细菌,以草莓炭疽病病原菌为指示菌进行平板对峙试验,筛选出一株拮抗效果最强的生防菌SKL108,抑菌率高达93.22%。经16S rRNA系统进化树分析,结合细胞形态学观察和生理生化指标结果分析,将该菌株鉴定为萨拉曼卡假单胞菌(Pseudomonas helmanticensis)。利用平板对峙培养法研究该菌株的抑菌谱,结果表明,菌株SKL108对多种病原真菌的生长具有明显的抑制作用,包括常见的番茄灰葡萄孢菌、水稻立枯丝核菌、小麦禾谷镰孢菌等。这一研究结果是萨拉曼卡假单胞菌作为生防菌在农业上的首次报道,也表明该菌株具有开发成生物菌剂的潜力。
关键词:拮抗菌;草莓炭疽病;筛选;萨拉曼卡假单胞菌(Pseudomonas helmanticensis)
中图分类号: S432.1;S436.68+4 文献标志码: A 文章编号:1002-1302(2020)10-0125-05
收稿日期:2019-04-30
基金项目:江苏省自然科学基金青年基金(编号:BK20160567)。
作者简介:刘程程(1987—),女,江苏徐州人,硕士,助理研究员,主要从事生物农药的开发和应用研究。Tel:(025)84390404;E-mail:626778317@qq.com。
通信作者:明 亮,副研究员,主要从事农药剂型的开发和应用研究。Tel:(025)84390404;E-mail:johnbright1300@163.com。
在自然生态系统中,农作物面临多种病原菌的侵染威胁,近年来,农作物种类和栽培方式多样化,使得作物病害日趋严重。草莓因其口感和营养,越来越受到消费者的欢迎,但草莓病害大量发生,消费者对草莓上农药残留更加关注。近年来,随着全国范围内设施草莓的种植面积不断扩大,空间密闭形成高温高湿环境,使草莓炭疽病发生日益严重,造成草莓减产25%~30%[1]。草莓炭疽病在草莓整个生育期都能发生危害[2-3],以苗期和移栽期最为严重,它是由草莓炭疽菌(Colletotrichum fragariae)、膠孢炭疽菌(C. gloeosporioide)和尖孢炭疽菌(C. acutatum)等引起的,主要危害匍匐茎和根冠,造成根冠腐烂,最终导致植株萎蔫死亡,已严重制约了草莓产业的健康发展[4-7]。目前国内的防治措施正往生物防治方面发展,不仅因其环境友好、对人类健康安全,而且在防病的同时还能提高作物的品质和产量[8-9]。关于草莓炭疽病的生物防治,近年来国内外有少量报道,Freeman等利用4种木霉菌的提取物防治草莓、葡萄的炭疽病和灰霉病并取得了良好效果[10];张雪等的研究也证实了木霉菌剂能显著提高红颜草莓植株对炭疽病的抗病性[11];魏彩燕等鉴定出1株生防菌生防菌株MT-06对草莓炭疽病的生长抑制率达71.75%[12]。但国内的报道都尚在研究阶段,暂时还未有产品登记。因此,对草莓炭疽病有拮抗效果的拮抗生防菌亟待开发。
本研究从南京紫金山森林土壤这一相对原始的生态环境中筛选出1株对草莓炭疽病菌有强烈的拮抗效果的生防菌SKL108,经细胞形态学观察、生理生化指标结果分析以及16S rRNA系统进化树分析,鉴定为萨拉曼卡假单胞菌(Pseudomonas helmanticensis),并利用平板对峙培养法研究了SKL108的抑菌谱。这为草莓炭疽病生物防治提供了优良的菌种资源,更为假单胞菌属作为拮抗菌开发提供了理论基础。
1 材料与方法
1.1 供试植物病原菌
草莓炭疽病菌、草莓灰霉病(Botrytis cinerea)、葡萄溃疡病(Botryosphaeria rhodina)病原菌均由江苏省丘陵地区镇江农业科学研究所提供。
水稻纹枯病(Rhizoctonia solani)、水稻恶苗病(Gibberella fujikuroi)、水稻稻曲病(Ustilaginoidea oryzae)、小麦纹枯病(R. cerealis)、小麦赤霉病(Fusarium graminearum)、小麦全蚀病(Gaeumannomyces graminis)、番茄灰霉病(B. cinerea)病原菌均由江苏省农业科学院提供。
1.2 培养基及主要试剂
拮抗菌分离采用TSA培养基[13]:胰蛋白胨 15 g,大豆蛋白胨5 g,NaCl 30 g,琼脂20 g,蒸馏水 1 000 mL,pH值7.0~7.6。
拮抗菌培养采用LB培养基:胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,蒸馏水1 000 mL,pH值7.0。
草莓炭疽病病原菌培养和平板对峙试验采用PDA培养基:马铃薯200 g,葡萄糖10 g,琼脂20 g,水1 000 mL,pH值自然。
1.3 生化试剂
细菌基因组DNA提取试剂盒、16S rRNA片段扩增所用的各种酶、marker、dNTPs、buffer等试剂均为宝生物工程(大连)有限公司产品;其余试剂均为国产分析纯。
1.4 拮抗菌的分离
在南京紫金山森林的0~20 cm土层中随机选取土壤样品20份,自然晾干,称取土壤样品 10 g/份,混合均匀,称取混合土样10 g,倒入三角瓶中,用无菌水定容至100 mL,加入适量灭菌的玻璃珠,置于水平摇床(太仓华美生化仪器厂,THZ-E)160 r/min 振荡30 min混匀,制成1×10-1 g/mL土壤悬浮液,依次加无菌水稀释制成10-2~10-5 g/mL浓度梯度的系列土壤悬浮液,取各稀释液100 μL涂布于TSA固体培养基上,于30 ℃、12 h下光照培养,2 d后根据菌落特征挑选出单个菌落,划线纯化3次,纯化后的细菌菌株置于LB液体培养基中,于28 ℃、160 r/min下培养过夜后4 ℃冰箱保存。
1.5 拮抗菌的筛选
草莓炭疽病菌拮抗细菌初筛和复筛采用对峙生长法。将各细菌在LB固体培养基上活化,然后分别移入2 mL LB培养液中,28 ℃、160 r/min振荡培养12 h,获得拮抗菌液。将草莓炭疽病菌在PDA固体培养基上活化,沿菌落边缘用直径5 mm打孔器打孔,将菌饼置于空白PDA平板中央。培养皿四周呈“十”字形点接拮抗菌液(距培养皿中心 25 mm),每个处理重复3皿,设清水对照。28 ℃恒温培养,待对照平板菌落长满时测量拮抗带宽,并计算抑菌率[14]。
抑菌率=(对照菌落直径-处理菌落直径)/对照菌落直径×100%。
1.6 拮抗菌的鉴定
1.6.1 拮抗菌DNA的提取 将对峙筛选的拮抗菌在LB固体培养基上划线,28 ℃恒温培养24 h,挑取单菌落,28 ℃、160 r/min摇床培养过夜,离心培养的菌液,收集菌体,利用细菌基因组DNA提取试剂盒提取拮抗菌DNA,-20 ℃保存。
1.6.2 16S rRNA基因扩增 将提取好的拮抗细菌DNA进行PCR反应,所用引物为16S rRNA通用引物(27F,5′-AGAGTTTGATCMTGGCTCAG-3′;1492R,5′-TACGGYTACCTTGTTACGACTT-3′)。PCR反应采用25 μL体系:10×buffer浓缩反应缓冲液2.5 μL,10 mmol/L dNTP混合物2 μL,MgCl2 2.5 μL,rTaq 0.25 μL,上游引物1 μL,下游引物 1 μL,模板1 μL,无菌水补齐。PCR反应程序:95 ℃ 预变性3 min;95 ℃ 变性1 min,55 ℃退火 1 min,72 ℃延伸1 min,35个循环;72 ℃延伸 10 min。将扩增产物进行电泳检测,切胶回收后,送至南京金斯瑞生物科技有限公司测序。测序得到的碱基序列在GenBank中进行同源序列分析,并用MEGA5软件构建系统进化树。
1.6.3 拮抗菌的生理生化分析 根据16S rRNA初步鉴定的菌株种类,参考《伯杰氏系统细菌学手册》选择所需测定的生理生化项目,测定菌株的生理生化反应。
1.7 菌株SKL108抗菌谱测定
采用对峙生长法测定SKL108对9种植物病原真菌的抑制作用。将各病原菌在PDA固體培养基上活化,试验方法同“1.5”节,计算SKL108对各病原菌的抑菌率。
2 结果与分析
2.1 拮抗菌的分离和筛选
本研究从土样中共分离到175个菌落特征相异的细菌,采用平板对峙培养法测定各细菌对草莓炭疽病病原菌的抑制作用。其中有3个表现为拮抗作用(图1),将选出的3个拮抗菌株进行复筛,发现1个菌株编号为SKL108的生防菌拮抗效果显著高于另外2个菌株(P<0.05),抑菌率高达93.22%(图2)。
2.2 菌株SKL108的鉴定
菌株SKL108的细胞形态和生理生化指标结果见表1。提取分离出的拮抗菌株SKL108的基因组DNA,用通用引物进行16S rRNA的PCR扩增,电泳检测得到约1 400 bp长度的片段。将这段序列在GenBank中进行Blast分析,与已有的序列进行同源性比较,并用ClustalX软件进行多重序列比较,结果发现菌株SKL108与萨拉曼卡假单胞菌(Pseudomonas helmanticensis) OHA11(HG940537)的
亲缘关系最近,相似度达 99.3%,用MEGA5软件构建系统进化树(图3)。结合形态学特征,将菌株SKL108鉴定为萨拉曼卡假单胞菌。
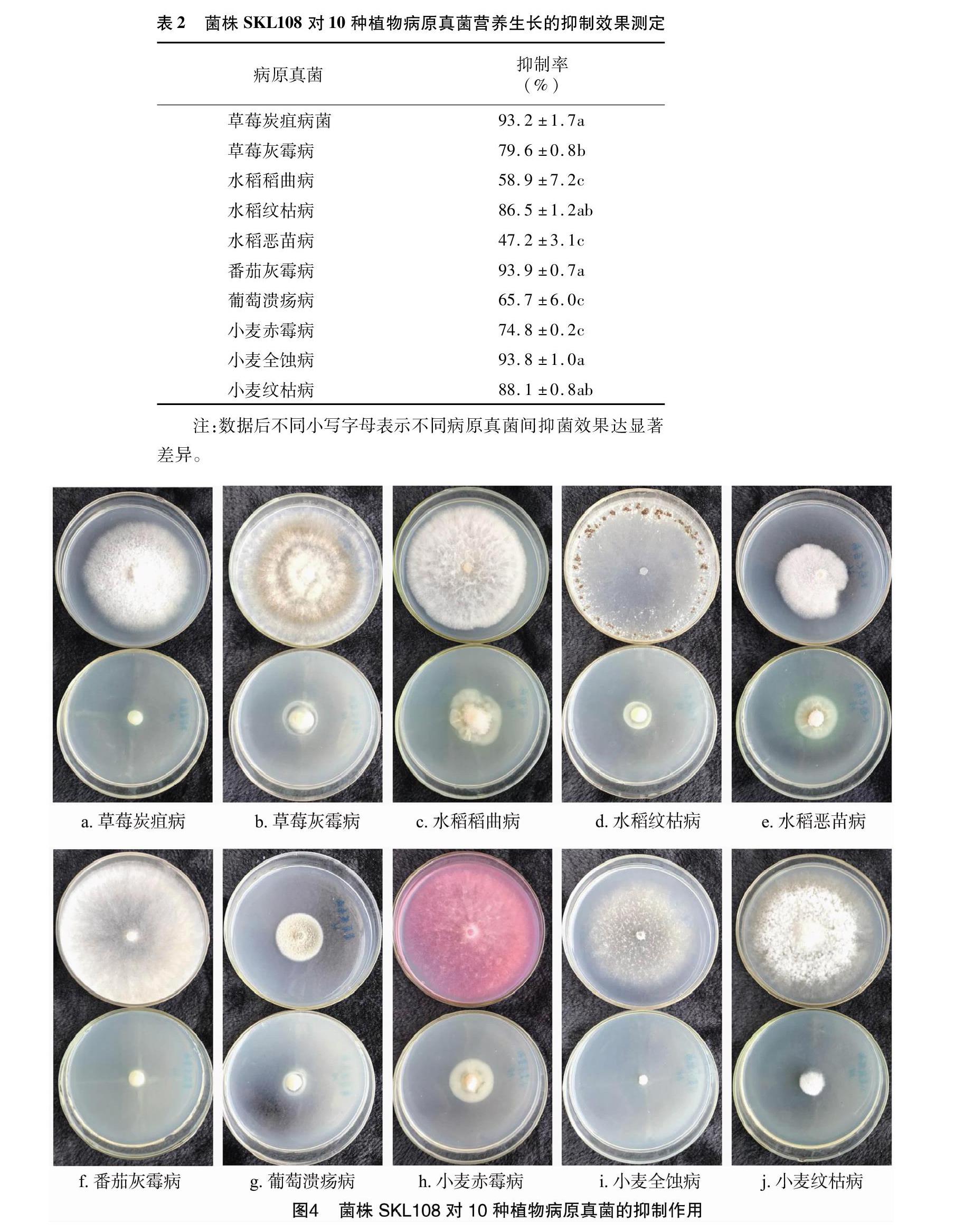
2.3 菌株SKL108对10种植物病原真菌的抑制作用
由表2和图4可见,菌株SKL108对10种供试植物病原真菌均有较强的拮抗作用,其中对水稻恶苗病菌的抑制率最低,为47.2%,对番茄灰霉病菌抑制效果最高,达93.9%,说明其对大部分的病原真菌都有较好的抑制作用,具有较广的抗菌活性。
3 讨论与结论
草莓炭疽病的防治主要遵循以预防为主、综合防治的方法。选育抗病品种防控草莓炭疽病固然是最经济有效的途径,但由于炭疽病的抗性机理复杂,导致抗性品种资源缺乏。在大部分地区,种植户还是依靠药剂进行病害防控,但化学农药会导致炭疽病菌抗药性不断增加,防治效果越来越不理想。韩国兴等曾报道,多年连续使用多菌灵和乙霉威防治草莓炭疽病,导致高抗菌株的比例达90%以上,单剂和两者的混剂都不宜再推广应用[15]。鉴于化学农药导致的抗性和残留问题在草莓产业中越来越受到重视,利用拮抗生防菌防治草莓炭疽病成为一种极具发展潜力的防治措施[16]。
假单胞菌属是土壤中分布最广的微生物类群之一,也是一种重要的植物根际促生菌(plant growth-promoting rhizobacteria,PGPR)。Haas等证实植物根际假单胞菌应用在谷物种子或土壤中可以抑制病原菌的生长[17],其作用机理主要包括根际营养竞争、分泌降解微生物的酶及抗生作用等。据
报道,假单胞菌可以产生多种抗生素如2,4-二乙酰基间苯三酚、吩嗪酸、硝吡咯菌素、根菌素、假单胞菌酸等,能大大减轻病原菌对植物的侵染[18]。目前假单胞菌在生物防治领域研究最为深入的是荧光假单胞菌(P. fluorescens),它产生的噬铁素能促进植物生长的同时抑制植物病害的发生。除噬铁素外,它还能够产生十几种抗生性次级代谢产物,在生防菌剂的开发及应用方面具有巨大的潜力[19-20]。
本研究从相对原始的森林土壤中分离筛选出1株对草莓胶孢炭疽菌有强烈抑制效果的拮抗生防菌SKL108菌株,经细胞形态观察、生理生化测定及16S rRNA系统进化树分析等,鉴定该菌株为假单胞菌属,与荧光假单胞菌有很高的亲缘关系。菌株SKL108发酵液对草莓炭疽病的抑制率高达 93.2%,且抑菌谱较广。这一研究结果为开发高效安全的生防菌剂拓宽了研究方向,也提供了优质的菌种资源。尽管室内生物测定试验中菌株SKL108抑菌作用效果明显,但还须要进行大量的实践工作才能明确抑菌作用机理和田间试验防治效果。因此,下一步的研究重点是初步筛选菌株SKL108的初生代谢产物和次生代谢产物,同时明确田间防效,以期开发出优质高效的生物菌剂。
参考文献:
[1]胡德玉,钱 春,刘雪峰. 草莓炭疽病研究进展[J]. 中国蔬菜,2014(12):9-14.
[2]Brooks A N. Anthracnose of strawberry caused by Colletotrichum fragariae[J]. Phytopathology,1931,21(7):739-744.
[3]Howard C M,Maas J L,Chandler C K,et al. Anthracnose of strawberry caused by the Colletotrichum complex in Florida[J]. Plant Disease,1992,76(10):976-981.
[4]任海英,蒋桂华,方 丽,等. 浙江省草莓炭疽病菌鑒定及生物学特性研究[J]. 浙江农业学报,2011,23(5):937-941.
[5]任小杰,梁 艳,陆金萍. 上海地区草莓炭疽病病原鉴定[J]. 植物病理学报,2008,38(3):325-328.
[6]李 娟,刘丹梅,王东来,等. 草莓炭疽病拮抗放线菌DTJ-24的筛选及鉴定[J]. 西南农业学报,2015,28(5):2086-2089.
[7]吉沐祥,杨敬辉,吴 祥, 等. 草莓炭疽病的生物防治[J]. 江苏
农业学报,2012,28(6):1498-1500.
[8]陈 哲,黄 静,赵 佳,等. 防治草莓炭疽病的芽胞杆菌组合的筛选[J]. 中国生物防治学报,2018,34(4):582-588.
[9]杨 华,纪明山,李广旭,等. 不同发酵条件对苹果轮纹病拮抗细菌生长的影响[J]. 果树学报,2007,24(6):799-802.
[10]Freeman S,Minz D,Kolesnik I,et al. Trichoderma biocontrol of Colletotrichum acutatum and Botrytis cinerea and survival in strawberry[J]. European Journal of Plant Pathology,2004,110(4):361-370.
[11]张 雪,张志宏,刘月学,等. 木霉菌剂提高“红颜”草莓炭疽病抗性的效应[J]. 西北农业学报,2010,19(8):153-156.
[12]魏彩燕,毛雪琴,柴荣耀,等. 草莓炭疽病生防菌株MT-06的鉴定及生物学特性[J]. 菌物学报,2010,29(4):481-487.
[13]王 刚,李志强. 小麦内生细菌的分离及其对小麦纹枯菌的拮抗作用[J]. 微生物学通报,2005,32(2):20-24.
[14]董汉松. 植病研究法[M]. 北京:中国农业出版社,2012.
[15]韩国兴,礼 茜,孙飞洲,等. 杭州地区草莓炭疽病病原鉴定及其对多菌灵和乙霉威的抗药性[J]. 浙江农业科学,2009(6):1169-1172.
[16]邱德文. 我国植物病害生物防治的现状及发展策略[J]. 植物保护,2010,36(4):15-18,35.
[17]Haas D,Defago G. Biological control of soil-borne pathogens by fluorescent pseudomonads[J]. Nature Reviews Microbiology,2005,3(4):307-319.
[18]张力群,张俊威. 假单胞菌产生的抗生素[J]. 中国生物防治学报,2015,31(5):750-756.
[19]张伟琼,聂 明,肖 明. 荧光假单胞菌生防机理的研究进展[J]. 生物学杂志,2007,24(3):9-11,24.
[20]Yang H J,Tan Z J,Xiao Q M,et al. Biocontrol functions of pseudomonad[J]. Chinese Journal of Eco-Agriculture,2004,12(3):158-161.
