PBAT 生物降解地膜降解特征对不同土壤水分的响应
2020-07-06高维常焦加国张仕祥
吴 思,高维常,蔡 凯,焦加国,张仕祥
(1.南京农业大学 资源与环境科学学院/江苏省有机固体废弃物资源化协同创新中心,南京 210095; 2.贵州省烟草科学研究院,贵阳 550001;3.中国烟草总公司郑州烟草研究院,郑州 450001)
0 引 言
【研究意义】在农业生产过程中,覆盖塑料地膜能起到保温保墒、促进作物根系发育的作用[1-2]。迄今为止,我国农用塑料地膜覆盖面积位居世界第一[3]。但农田机械作业会导致施入土壤的塑料地膜破损,裂解为小的碎片,大量残留在土壤耕作层中,造成土壤板结,严重阻碍土壤中水分和养分的运输[4-5],对土壤生态环境造成严重影响[6-8]。在2015 年,农用地膜残留正式被列为面源污染问题之一[9]。与聚乙烯塑料地膜相比,可生物降解地膜能在微生物的作用下分解为CO2、H2O 及其所含元素的矿化无机盐,最终参与生物代谢循环[10-11],在土壤中无残留,其应用已受到越来越多的关注。高分子聚合物聚己二酸/对苯二甲酸丁二醇酯(简称为PBAT)具有芳香族聚酯良好的机械性能以及脂肪族聚酯的生物降解性能,优异的性能使其成为最有望替代聚乙烯的新型有机物料[12-13]。【研究进展】大量研究表明,环境因子及土壤微生物活性是决定生物降解地膜降解速率的重要因素[14-15]。谭湖伟等[16]通过14C 同位素标记法得出生物降解地膜降解受降水、温度等环境因素所影响;黄格省等[17]指出在湿度较大、含无机盐量较多的情况下生物降解地膜的降解进程加快;Kijchavengkul[18]通过室内降解试验发现:生物降解地膜的降解主要是由于太阳辐射;Yakabe[19]发现当土壤含水率较低时,细菌的活性降低,延迟诱导,
当土壤含水率增加时,诱导期会随之缩短,但土壤过湿、温度过低又会使反应速度减缓。【切入点】贵州省是我国烟叶第二大省,2018 年种植面积为3.5×105hm2,产量2.02×105t,约占全国总量的13%。从2013 年开始,贵州省烟草科学研究院在烟叶生产中陆续开展了生物降解地膜的试验示范和推广应用,以逐步替代塑料地膜,但对于生物降解地膜的降解特征及环境影响因子仍不清楚。因此,研究PBAT生物降解地膜在不同土壤水分梯度下的降解规律及其安全性十分重要。【拟解决的关键问题】本研究通过室内培养试验,分析不同PBAT 生物降解地膜的降解时间和降解程度,结合扫描电镜(SEM)、傅里叶红外光谱(FTIR)分析,研究PBAT 生物降解地膜在不同土壤水分条件下的降解特征,探讨其对土壤微生物及酶活性的影响。以期为贵州省烟叶生产过程中生物降解地膜的推广应用提供理论依据。
1 材料与方法
1.1 供试材料
供试生物降解地膜由贵州省烟草科学研究院提供,分别为国产1 号(膜A)、国产2 号(膜B)、德国巴斯夫(膜C),主要成分均为PBAT,结构式如图1。市售普通聚乙烯地膜(膜D),地膜厚度均为0.008 mm。供试土壤为贵州烟区黄壤,基本理化性质为:pH 值7.02,有机质量15.99 g/kg,全氮量1.19 g/kg,全磷量0.77 g/kg。
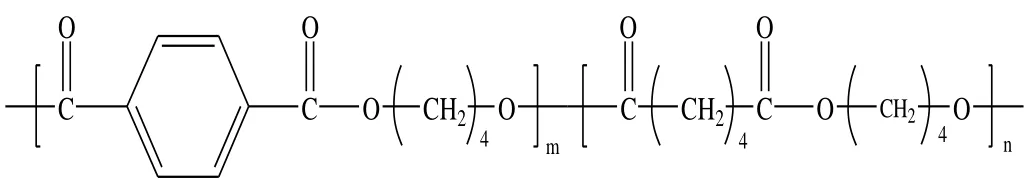
图1 PBAT 的化学结构式 Fig.1 Chemical structure of PBAT
1.2 试验方法
试验于2018 年10 月23 日—2019 年4 月23 日在南京农业大学资源与环境科学学院进行。选择上述4 种地膜,设置土壤质量含水率为15%、25%和35%的3 个水分梯度,共12 个处理,每个处理设置4 次重复。将地膜裁剪成一定大小(8 cm×8 cm)的样品,干燥48 h,逐一称量其质量并记录,然后将地膜埋在装有100 g 风干土的玻璃培养皿中(12 cm×12 cm),调整含水率后用纱布覆盖培养皿,以防止水分过快蒸发。将其放入25 ℃恒温培养箱中培养。试验开展后每隔1 d 用控制质量法补充水分。分别在培养第30、80、130、180 d 采用破坏性采样方法采集地膜和土壤样品。
地膜样品采集后于清水中漂洗,去除表面泥土后置于烧杯中,加入75%酒精,静置30 min,然后用去离子水清洗干净,自然晾干,放置于纸袋中保存。土壤样品采集后,平均分为2 份,其中一份鲜样直接装入纸袋于4 ℃冰箱保存,用于测定土壤微生物生物量碳、氮,另一份样品风干后过0.25 mm孔径的筛网,装入纸袋用于测定土壤酶活性。
1.3 测定指标及方法
1.3.1 地膜降解率
埋膜前将地膜洗净于阴凉干燥处风干,用1/10 000 天平测得原始地膜样品的质量m0;每次取样清洗风干后用1/10000 天平测得降解后质量mi,以2 次测定质量的差值计算地膜的降解率。地膜降解率=(m0-mi)/m0。
1.3.2 地膜表面结构
采用SEM 扫描电镜,将处理后的地膜试样黏附在载物台后,对地膜降解前后样品表面分别进行溅射喷金处理,放大1 000 倍、3 000 倍对各地膜表面的微观结构变化进行观察。
1.3.3 地膜化学结构
将降解前后的地膜自然晾干后,用酒精擦拭其表面,采用傅立叶变换红外光谱仪测定其红外光谱,波长范围4 000~400 cm-1。傅里叶红外谱图能反映出聚合物分子中不同基团的振动特征,羰基指数可以用来表征地膜的降解水平[20]。
1.3.4 土壤微生物生物量碳、氮
采取氯仿熏蒸-硫酸钾浸提法,重铬酸钾外加热法测定微生物生物量碳量,半微量凯氏定氮法测定微生物生物量氮量。
1.3.5 土壤酶活性
试验选择土壤脲酶、土壤过氧化氢酶、土壤多酚氧化酶活性进行测定。土壤脲酶可以水解尿素,生成氨和碳酸,因此可以利用靛酚蓝比色法[21]测定其活性;土壤过氧化氢酶活性通过测定240 nm 处吸光度变化来反映其活性高低[22];土壤多酚氧化酶以邻苯三酚为基质,通过测定430 nm 处吸光度来取定其活性[23]。
1.4 数据处理
采用Excel 2013 和SPSS 16.0 软件对数据进行统计分析,运用Duncan 检验法(P<0.05)进行方差分析和多重比较(α=0.05)。
2 结果与分析
2.1 不同土壤水分条件下地膜降解速率的动态变化
各地膜降解速率见图2。由图2 可以看出,在不同水分梯度下,不同生物降解地膜的降解速率均高于PE 地膜,以25%土壤水分下的降解最快,且不同生物降解地膜降解速率均随着培养时间的延长逐渐升高,其中以膜A 降解速率最快。在15%土壤水分下,3 种生物降解地膜具有不同程度的降解,膜A 降解最快,第180 d 时解率达76.66%,而膜B 和膜C 降解率只有25.07%、18.46%。在25%和35%土壤水分下,不同降解地膜的降解特征与15%土壤水分条件完全一致,均以膜A 降解速率最快。总的来说,以25%土壤水分下生物降解地膜降解率最高,在35%土壤水分条件下,培养180 d 后膜A、膜B、膜C 降解率分别为63.41%、6.88%、14.35%,均显著低于其他2 个水分条件。随着培养时间的增加,生物降解地膜降解率均升高,在培养180 d 时,膜A、膜B、膜C降解率在不同水分条件下到降解率在6.88%~96.65%之间,而对于PE 膜来说,不同水分条件下其降解率均无明显变化。

图2 15%、25%、35%土壤质量含水率条件下各地膜降解率动态变化 Fig.2 Dynamic changes in membrane degradation rates under 15%、25% and 35% soil moisture conditions

图3 各地膜25%土壤质量含水率条件下扫描电镜 Fig.3 Scanning electron microscopy of each film in 25% water content
以25%水分条件为例,图3 为各地膜在该水分条件下培养0、30、130 d 的扫描电镜图。由图3 可以看出,各生物降解地膜培养130 d 后分子链均产生了断裂和氧化,进而被分解为小分子物质,形成微观孔洞,均发生了降解,而PE 地膜培养前后无明显变化。在培养前,各生物降解地膜原样均匀致密,相容性好。培养30 d 后3 种生物降解地膜均开始出现不同程度的裂纹,但具体的裂解形式不同。其中膜A 降解30 d 后破损较为严重,质地开始疏松并出现蜂窝状小孔洞,降解较快;膜B 降解前有大量白色颗粒状物体,30 d 后出现大量网状龟裂,机械性能变差;膜C 在30 d 后出现微小裂纹,130 d 时表面出现大小不一的孔洞,裂纹进一步加深,碎屑物增多。PE 地膜前后电镜图片基本一致,无裂纹,证明PE 地膜在培养的180 d 内并未发现降解。15%、35%水分条件下各生物降解地膜表面结构变化与25%含水率下类似,均表现出随着降解率的升高,表面破损裂解程度越大。总体来看,25%水分条件下降解程度最大。
2.2 不同土壤水分条件下地膜化学结构的动态变化
PBAT 是由1,4-丁二醇、对苯二甲酸、己二酸合成的石油基高分子聚合物[24]。傅里叶红外谱图中的某些特征基团可以用来表征PBAT:3 425 cm 处的吸收峰是聚合物中-OH 的伸缩振动峰,2 956 cm 处属于-CH2-振动峰,1 710 cm 处的吸收峰是由酯键振动引起的,1 636 cm 处为不饱和C=C 双键的所引发的吸收峰,1 300 cm 为烷烃中C-H 键的吸收峰,1 014 cm处的峰为C-O-C 基团的吸收峰,而在720 cm 处的吸收峰代表存在4 个或者相邻近的亚甲基[25]。
图4 为各生物降解地膜在500~3 400 cm-1之间的傅里叶红外谱。各生物降解地膜主要成分均为PBAT,因此以图4(a)为例,位于1 750~1 675 cm 处的峰为羰基吸收峰(C=O),1 710 cm 附近为低分子量的酯,可以看出随着降解时间的延长,羰基吸收峰明显增强,可能是生物降解地膜中的酯键发生断裂由此形成大量羰基,C-H 键以及C-O-C 键减弱,说明可能在微生物的作用下引发水解作用,最后导致分子链的断裂,生物降解地膜发生降解。普通聚乙烯地膜经过180 d 培养后各基团的振动特征并未改变,这可能是因为聚乙烯分子量大,表面能低,本身性能稳定等原因所致。
生物降解地膜在降解后会形成大量羰基以及一些含氧基团,羰基指数可以用来表征其降解程度,即测定羰基谱带与不随着氧化而发生变化的谱带强度的比值,当地膜降解老化越严重时,生成的羰基也就越多,羰基指数随之变大[26]。各地膜在不同土壤质量含水率条件下的羰基指数如表1 所示。从表1可以看出,3 种生物降解地膜在降解180 d 时的羰基指数大小顺序为膜A>膜B>膜C,这与它们的降解速率快慢一致;对比不同土壤水分下的羰基指数,可以看出25%水分条件下的各地膜羰基指数最大,在此条件下各生物降解地膜降解速率最快,降解程度最深;而普通PE 膜在降解前后均没有羰基产生。
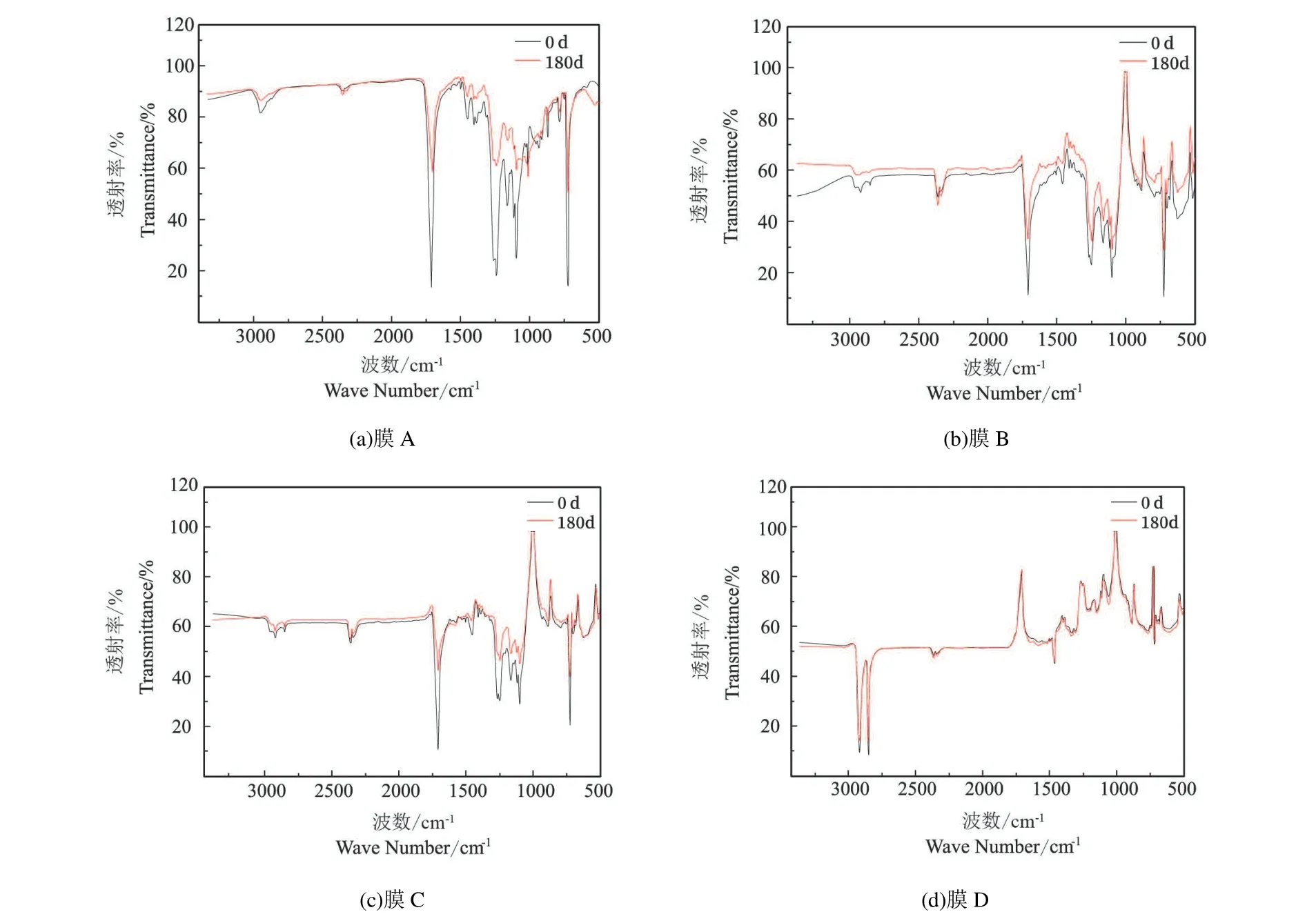
图4 各地膜培养0、180 d 后傅里叶红外谱图Fig. 4 FTIR spectrum of the films for 0 d and 180 d

表1 培养180 d 后土壤不同质量含水率条件下各地膜的羰基指数动态变化 Table 1 Dynamic change of carbonyl index of different mulch film under different water contents at 180 d
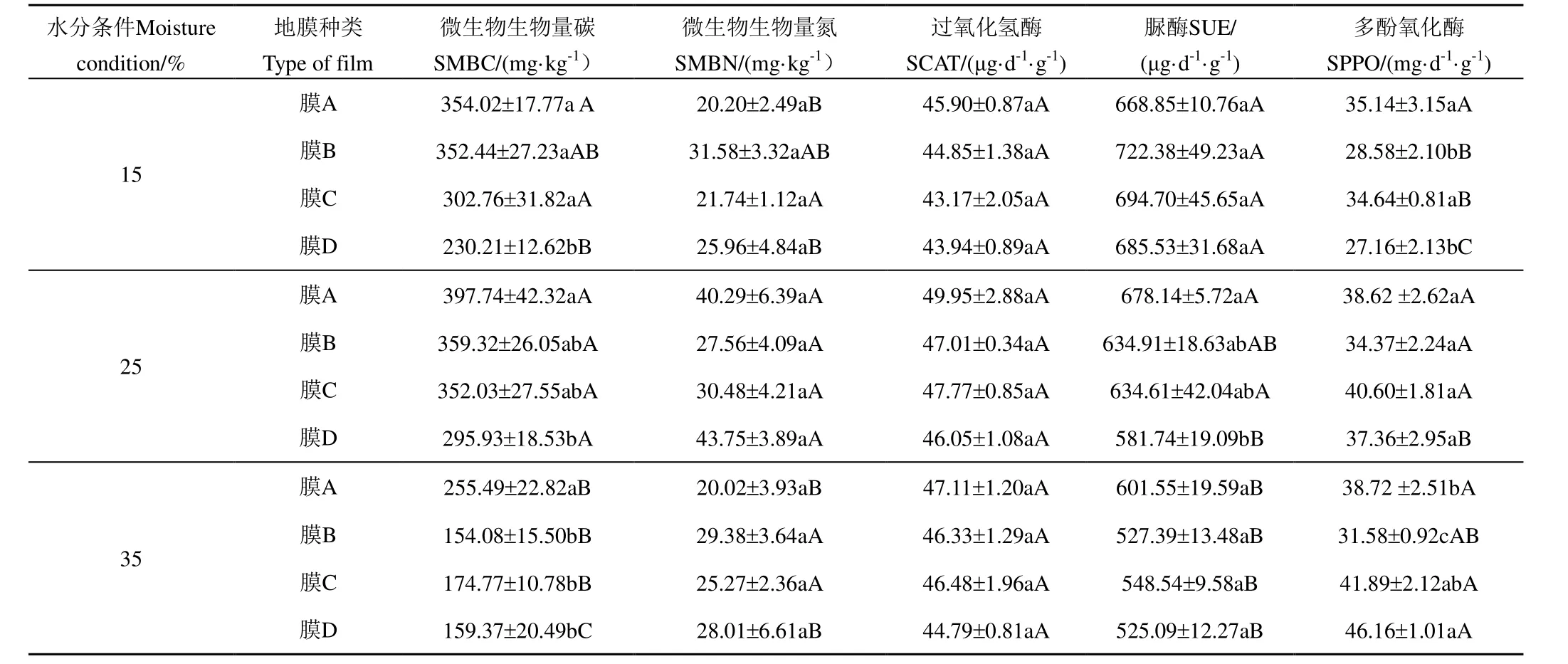
表2 培养180 d 时各地膜在不同质量含水率条件下的土壤微生物活性变化 Table 2 Changes of soil microbial activity in different mulch film under different water conditions at 180 d
2.3 不同土壤水分条件下土壤微生物生物量碳、氮及酶活性变化
培养180 d 时各地膜在不同质量含水率条件下的土壤微生物活性变化如表2 所示,由表2 可知,180 d 培养结束后,不同生物降解地膜的土壤微生物活性变化大致呈现出25%>15%>35%的趋势,这与各生物降解地膜在不同土壤质量含水率梯度下的降解情况一致。在15%水分条件下,3 种生物降解地膜处理下的土壤微生物生物量碳、多酚氧化酶活性显著高于PE 地膜处理,但土壤微生物生物量氮、过氧化氢酶、脲酶活性均无显著差异;在25%质量含水率条件下,膜A 培养180 d 后的土壤微生物生物量碳、脲酶活性显著高于PE 地膜,其余指标无显著差异;35%质量含水率条件下,PE 地膜培养180 d后土壤多酚氧化酶活性显著高于膜A、膜B。从不同含水率来看,15%和25%质量含水率条件下土壤微生物及酶活性无显著差异,但与35%质量含水率条件呈显著差异。
3 讨 论
本研究表明,在不同土壤质量含水率条件下,培养180 d 后3 种PBAT 生物降解地膜能够发生降解,表面结构和化学结构均发生了变化,其中膜A 降解程度最深,而PE 地膜培养180 d 内未见降解。PBAT 生物降解地膜以石油基为主要原料,但降解特性取决于物料本身的特殊结构,而并非其来源[26]。土壤中各种微生物及相应的生物酶类构成了生物降解地膜所处的生物学环境,且存在着共生作用,即特定的微生物执行降解环节中的某一个步骤,而其他微生物以其产物为生。研究证明,通过13C 同位素标记法证明了PBAT 生物降解地膜能够被微生物分解蚕食,且随着微生物的呼吸作用转化为CO2[27],这些微生物分解始于地膜表面[28],可以利用聚合物分子中的C 作为能源。在质量含水率作用下,高分子聚合物分子链发生断裂,表面积逐渐增大并出现裂纹,分子量随之降低,生成短链分子,在土壤酶的作用下进一步分解为寡聚片段,从而被吞噬细胞吞噬[29]。生物降解地膜的立体结构影响了微生物分解的速度,三维结构受材料与配方的影响,结构越松散越有易于微生物侵蚀[30],因此本试验各生物降解地膜在同土壤质量含水率条件下降解速率表现为膜A>膜B>膜C。
在不同土壤质量含水率条件下,以25%含水率条件的地膜降解速率最高。此前,田凤飞[31]对于海藻多糖干地膜的研究发现,在温度为25 ℃、土壤水分为25%时地膜降解最快;赵爱琴[14]也得出类似结果,淀粉基质膜在25%的含水率下降解速率最快;龙世方等[32]通过模型拟合发现麻纤维地膜在25%土壤含水率下降解最快,217 d 达到全降解。这可能是由于土壤含水率较低时,微生物的活性降低,而当土壤含水率增加时,诱导期会随之缩短,但土壤过湿又会使反应速度减缓[19]。降解生物降解地膜的特征菌群是属于子囊菌门的真菌菌株[32-33],在本试验中,由于35%含水率条件下土壤湿度太大导致土壤含氧量降低,使得真菌活性受到抑制,进而影响了生物降解地膜的降解[19,34]。
诸多研究表明[35-37],微生物在有机高分子物料的降解过程中起着重要作用,无菌土壤中培养的生物降解地膜在试验期间不能发生降解。本试验表明,在同一质量含水率条件下,各地膜土壤微生物、酶活性的变化趋势大致为膜A>膜B>膜C>膜D,与各生物降解地膜降解速率变化趋势一致,这说明微生物在地膜降解过程中起着重要作用;15%、25%质量含水率条件下土壤微生物及酶活性无显著差异,但均显著高于35%质量含水率条件,说明含水率条件所引起的土壤微生物活性差异可能是造成生物降解地膜速率差异的主要原因。
4 结 论
以PBAT 为主要成分的生物降解地膜在施入土壤后能够发生降解,生物降解地膜在培养180 d 后出现了大量微观孔洞,羰基指数也随着降解时间的增加而逐渐升高,但降解速率快慢与土壤含水率以及地膜组成有关。在25%土壤含水率条件下,各类型生物降解地膜降解速率最快,显著优于15%、35%的土壤含水率条件。
