松花粉对人肝癌SK-Hep-1细胞的凋亡和自噬作用研究
2020-07-04李北林邓益斌罗艳红
李北林 邓益斌 罗艳红

[摘要] 目的 觀察松花粉对人肝癌SK-Hep-1细胞凋亡和自噬的影响,探讨松花粉抗肿瘤作用及机制,为松花粉的临床应用提供实验依据。 方法 体外培养SK-Hep-1细胞,随机分为4组,分别为对照组、松花粉小剂量组(30 mg/mL)、松花粉中剂量组(45 mg/mL)、松花粉大剂量组(60 mg/mL)。CCK-8法检测不同浓度松花粉干预不同时间(12、24、48、72 h)后的SK-Hep-1细胞抑制率;松花粉处理48 h后,相差显微镜和Hoechst33258荧光染色观察细胞形态学;流式细胞术观察细胞凋亡率;RT-PCR检测自噬相关mRNA表达水平。 结果 CCK-8法检测显示,松花粉能显著抑制SK-Hep-1细胞增殖,并具有时间和剂量依赖性;相差显微镜显示松花粉可以抑制细胞的增殖;Hoechst33258荧光染色显示,与对照组比较,松花粉小、中、大剂量组细胞形态发生明显的凋亡样改变;Annexin V-FITC/PI双染法结果显示,与对照组比较,松花粉小、中、大剂量组细胞凋亡率明显升高,差异均有统计学意义(P < 0.05或P < 0.01);RT-PCR分析显示,与对照组比较,松花粉干预48 h后,松花粉小、中、大剂量组Beclin-1、LC3-Ⅱ表达明显上调,而P62表达下调,差异均有统计学意义(P < 0.05或P < 0.01)。 结论 松花粉能有效抑制人肝癌SK-Hep-1细胞增殖,促进其凋亡,并诱导其发生自噬,松花粉可能通过诱导自噬促进肝癌细胞凋亡。
[关键词] 松花粉;SK-Hep-1细胞;凋亡;自噬
[中图分类号] R285 [文献标识码] A [文章编号] 1673-7210(2020)05(a)-0013-05
Study on the effect of apoptosis and autophagy of pine pollen on human hepatocellular carcinoma SK-Hep-1 cells
LI Beilin DENG Yibin LUO Yanhong
Youjiang Medical University for Nationalities, Guangxi Zhuang Autonomous Region, Baise 533000, China
[Abstract] Objective To observe the effect of pine pollen on apoptosis and autophagy of human hepatocellular carcinoma SK-Hep-1 cells, and to explore the anti-tumor effect and mechanism of pine pollen, so as to provide experimental basis for the clinical application of pine pollen. Methods SK-Hep-1 cells were cultured in vitro and randomly divided into 4 groups: the control group, the pine pollen low-dose group (30 mg/mL), the pine pollen medium-dose group (45 mg/mL), and the pine pollen high-dose group (60 mg/mL). The inhibition rate of SK-Hep-1 cells was determined by CCK-8 method after pine pollen intervention at different concentrations at different time (12, 24, 48 and 72 h). After pollen treatment for 48 h, cell morphology was observed by phase contrast microscopy and Hoechst33258 fluorescence staining. The apoptosis rate was observed by flow cytometry and mRNA expression levels of autophagy were detected by RT-PCR. Results CCK-8 assay showed that pine pollen could significantly inhibit SK-Hep-1 cell proliferation in time and dose dependence. Phase contrast microscopy showed that pine pollen could inhibit cell proliferation. Hoechst33258 fluorescence staining showed that, compared with the control group, the pine pollen low-dose, medium-dose and high-dose groups showed obvious apoptotic changes in cell morphology. Annexin V-FITC/PI double staining results showed that the apoptosis rates in the pine pollen low-dose, medium-dose and high-dose groups were significantly increased compared with the control group, with statistically significant differences (P < 0.05 or P < 0.01). RT-PCR analysis showed that, compared with the control group, intervention of pine pollen intervention after 48 h, the expression of Beclin-1, LC3-Ⅱwas up-regulated obviously in the pine pollen low-dose, medium-dose and high-dose groups, but P62 expression was down-regulated, with statistically significant differences (P < 0.05 or P < 0.01). Conclusion Pine pollen can effectively inhibit the proliferation of human hepatocellular carcinoma SK-Hep-1 cells, promote their apoptosis, and induce their autophagy. Pine pollen may promote apoptosis of hepatocellular carcinoma cells by inducing autophagy.
[Key words] Pine pollen; SK-Hep-1 cells; Apoptosis; Autophagy
肝癌是临床上最常见的恶性肿瘤之一,肝癌死亡率占全世界癌症死亡的第3位,其中占男性癌症死亡率的第2位[1]。中国是全球肝癌发病率最高的国家之一,其死亡人数占世界肝癌死亡人数的50%[2]。肝癌发病率与年龄和性别有关,随年龄增长而升高,男性发病率为女性的3倍[3]。肝癌具有恶性程度高、易复发、易转移等特点[4],因此,肝癌的防治已成为医药界亟待解决的问题。
松花粉(pine pollen),为松科植物马尾松和油松等的花粉。其味甘、性温,具有止血、祛风益气、收湿等功效[5]。通过H22荷瘤小鼠实验,证明松花粉主要通过逆转荷瘤小鼠的胆汁酸合成降低以及其他的氨基酸代谢障碍发挥体内的抗肿瘤作用[6]。因此,本研究从体外实验探讨松花粉作用于SK-Hep-1细胞后,其增殖、凋亡和自噬的变化,为松花粉的临床应用提供更多的理论和实验依据。
1 材料与方法
1.1 细胞株
人肝癌细胞株SK-Hep-1细胞,购于广西医科大学。
1.2 藥物及试剂
松花粉(中国新时代公司,批号:1907012);DMEM高糖培养基(Gibico公司,批号:C11995500BT);胎牛血清(浙江天抗生物公司,批号:11011-8611);Hoechst33258荧光染料(索莱宝公司,货号:IH0060);CCK-8检测试剂盒(博士德生物公司,货号:AR1160);Annexin V-FITC/PI凋亡检测试剂盒及逆转录试剂盒(赛默飞公司,货号:88-8005-72);荧光定量试剂盒(Roche公司,货号:4913914001);AxyPrep总RNA小量制备试剂盒(AxyPrep公司,货号:AP-MN-MS-RNA-50G)。
1.3 仪器
CO2恒温培养箱(日本三洋公司,型号:MCO-18AIC),高速冷冻离心机(Eppendorf公司,型号:5427R);倒置相差显微镜(Leccia公司,型号:LEICADMIL);罗氏实时荧光定量PCR仪(德国Roche,型号:lightCycler96);多功能酶标仪(Berthold,型号:TriStar LB941);流式细胞仪(美国BD公司,型号:FACSVerse);生物安全柜(苏净集团安泰公司,型号:BSC-1600ⅡB2)。
1.4 药物制备
9 g松花粉溶于300 mL双蒸水中,小火煮开15 min,浓缩至100 mL,过滤取上清液,药物浓度为90 mg/mL。
1.5 细胞培养与分组
SK-Hep-1细胞置于37℃、5%CO2培养箱中培养。培养基为含10%胎牛血清的DMEM及含1%青霉素与链霉素双抗。取对数生长期的细胞为研究样本,实验均重复3次。实验分为4组:对照组、松花粉小剂量组(30 mg/mL)、松花粉中剂量组(45 mg/mL)、松花粉大剂量组(60 mg/mL)。
1.6 CCK-8法检测松花粉对SK-Hep-1细胞增殖能力的作用
SK-Hep-1细胞接种于96孔板中,每孔5×104个细胞。分别设置空白对照组、正常对照组,以不同浓度松花粉处理细胞12、24、48和72 h,每个组设5个复孔。按试剂说明书操作。抑制率=[(对照孔OD值-实验孔OD值)/(对照孔OD值-空白孔OD值)]×100%吸光度。
1.7 相差显微镜观察SK-Hep-1细胞的形态学变化
以“1.5”分组方法处理细胞,药物干预48 h后,相差显微镜下观察细胞的形态学变化。
1.8 Hoechst33258检测细胞凋亡的形态学变化
细胞接种于12孔板中,每孔1×105个细胞。药物作用48 h后吸出培养基,磷酸缓冲盐溶液(PBS)清洗2次。用4%的甲醛室温固定15 min,取出PBS清洗3次。Hoechst33258试剂常温避光染色30 min后,PBS清洗3次。直接在荧光显微镜下观察并拍照。
1.9 Annexin V-FITC/PI双染结合流式细胞术检测松花粉对SK-Hep-1细胞凋亡的影响
以“1.5”分组方法处理细胞,药物干预48 h后,消化并收集细胞,1000 r/min,半径5 cm,离心3 min。用1×Binding Buffer缓冲液将各组的细胞密度调至5×106/mL,培养48 h,按试剂说明书操作。
1.10 RT-PCR检测自噬相关基因Beclin-1、LC3-Ⅱ、P62的mRNA表达水平
以“1.5”分组方法处理细胞,药物干预48 h后,去除培养基。①细胞总RNA的提取:采用AxyPrep总RNA小量制备法提取总RNA,再使用逆转录试剂盒将总RNA的1 μg mRNA反转录成cDNA。反应条件:42℃ 60 min,70℃10 min。②qPCR:PCR反应体系为50 μL,反应条件:95℃预变性10 min,95℃15 s,58℃ 10 s和72℃ 10 s,完成45个循环。qPCR使用罗氏LightCycler96实时荧光定量PCR系统。以GAPDH作为内参,数据采用2-ΔΔCt表示mRNA的相对定量,ΔCt=Ct靶基因-Ct内参基因,ΔΔCt=ΔCt实验组-ΔCt对照组。引物详细序列见表1。
1.11 统计学方法
采用SPSS 23.0对所得数据进行统计学分析,计量资料采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果
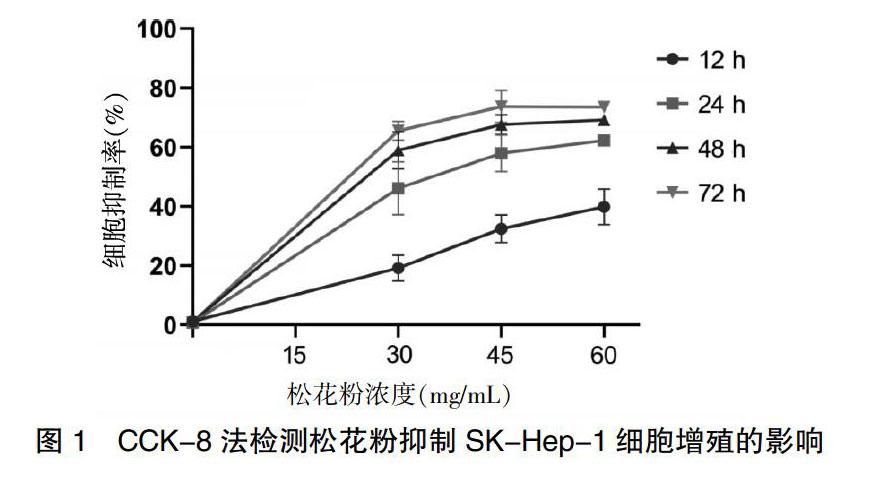
2.1 松花粉对SK-Hep-1细胞增殖的影响
使用不同浓度的松花粉处理SK-Hep-1细胞后,细胞受到明显的抑制。随着松花粉浓度和作用时间的延长,抑制率逐渐增高。各浓度及作用时间对SK-Hep-1细胞的影响见图1。由于松花粉作用48 h时,抑制率基本达到平台期,故后续的实验均采用48 h。
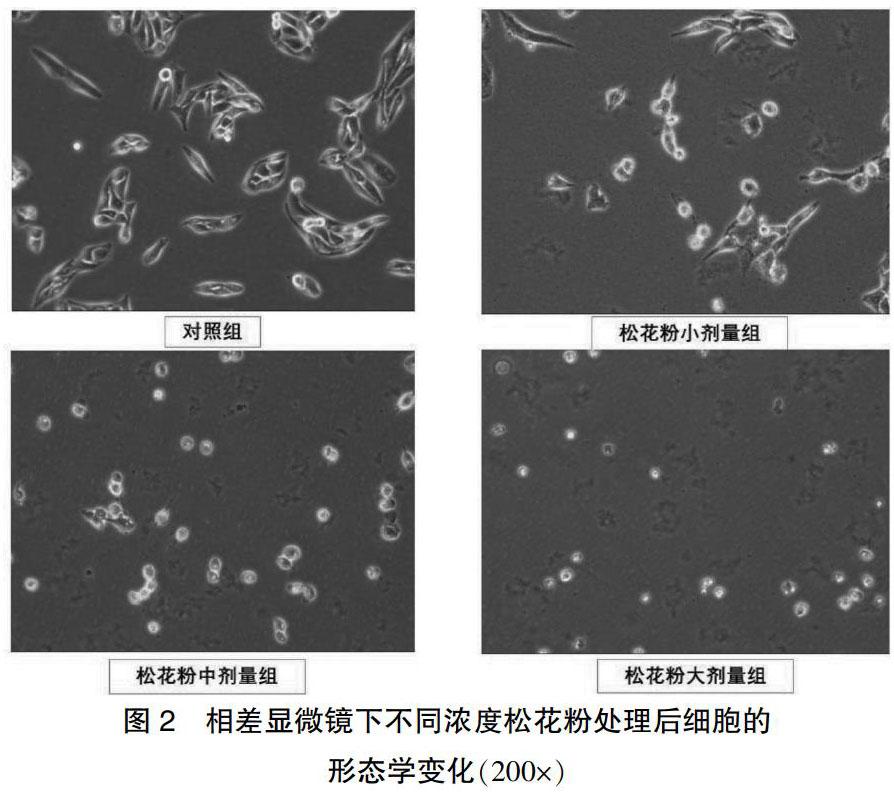
2.2 松花粉抑制SK-Hep-1细胞的形态学变化
与对照组比较,松花粉小、中、大剂量组细胞数目逐渐减少,细胞间隙增大,排列紊乱,细胞形态固缩变圆,随着松花粉浓度的增大,部分细胞基本失去原有的形态,呈漂浮状。见图2。
2.3 Hoechst33258染色法观察细胞形态学改变
对照组SK-Hep-1细胞胞膜完整,轮廓分明,核呈圆形,着色比较均匀。随着松花粉浓度的增大,可见细胞核出现凋亡的特征性改变:核固缩,核碎裂,形成大小不一的块状。细胞核的改变见图3。
2.4 松花粉对SK-Hep-1细胞凋亡的影响
与对照组比较,不同浓度的松花粉干预SK-Hep-1细胞后,细胞凋亡率随着松花粉浓度的增大而增大,差异均有统计学意义(P < 0.05或P < 0.01)。见图4、表2。
2.5 松花粉诱导肝癌SK-Hep-1细胞自噬相关mRNA表达水平的改变
与对照组比较,松花粉干预48 h后,松花粉小、中、大剂量组Beclin-1、LC3-Ⅱ表达明显上调,而P62表达下调,差异均有统计学意义(P < 0.05或P < 0.01)。见图5。
3 讨论
肝癌的治疗方法主要有放化疗、生物免疫治疗、分子靶向药物治疗和手术切除等,此类治疗措施对中晚期远处转移的病灶治疗效果不佳,其主要用于治疗早期小肝癌等[7-8]。同时,放化疗药物毒副作用大,价格昂贵,对患者造成极大的精神和经济负担。有学者研究发现,许多中药通过抑制肝癌细胞增殖、诱导细胞凋亡、抑制侵袭和迁移等作用,达到杀灭肝癌细胞的目的[9]。中草药相比于西药,毒副作用小,通过中草药可以达到延缓衰老、抗疲劳、保健等目的[10]。
松花粉,富含多糖、维生素、矿物质等多种营养成分和近百种生物活性成分[11]。近年研究发现松花粉具有增强免疫力、改善胃肠道功能、保护肝脏、调节血脂和抑制前列腺增生等作用[12]。通过实验,松花粉在大鼠模型中不会引起明显的毒性[13]。同时,松花粉具有明显的增效减毒作用[14-15]。
本课题组前期以松花粉处理人肝癌细胞HepG2细胞株,阐明了松花粉具有对抗肝癌细胞的持续生长、抑制血管生成和细胞迁移的作用。本研究通过CCK-8实验和相差显微镜观察,发现松花粉对细胞的增殖具有显著的抑制作用。
细胞凋亡是由基因控制的自主有序的死亡,是细胞的一种基本生物学现象。促进肿瘤细胞凋亡,对肿瘤治疗有着重要的意义[16-17]。本研究结果提示,松花粉可以促进SK-Hep-1细胞凋亡,其凋亡率与松花粉呈明显的量效关系。荧光显微镜下可见细胞核出现凋亡的特征性改变:核固缩,核碎裂。
细胞自噬是真核生物中进化保守的对细胞内物质进行周转的重要过程[18]。自噬过程中一些损坏的蛋白或细胞器被双层膜结构的自噬小泡包裹后,送入溶酶体或囊泡中进行降解并得以循环利用[19]。泛素结合蛋白P62与蛋白质的泛素化密切相关,P62是反映自噬活性的标记蛋白之一,其含量间接反映自噬小体清除水平[20]。LC3-Ⅱ和Beclin-1在哺乳动物细胞自噬过程中起着促进作用[21]。本实验通过对自噬相关mRNA表达水平的研究,松花粉作用48 h后,与对照组比较,自噬相关基因Beclin-1、LC3-Ⅱ表達明显上调,而P62表达下调,差异均有统计学意义(P < 0.05或P < 0.01)。这表明,SK-Hep-1细胞经松花粉处理后发生了自噬。
综上所述,松花粉对肝癌SK-Hep-1细胞具有明显的抑制增殖并诱导凋亡和自噬的作用,它可能通过诱导自噬促进肝癌细胞凋亡。松花粉有望成为治疗肝癌的新药物,为临床上肝癌的治疗方案提供新的思路和途径。
[参考文献]
[1] Bray F,Ferlay J,Soerjomataram I,et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries [J]. CA Cancer J Clin,2018,68(6):394-424.
[2] Ferlay J,Soerjomataram I,Dikshit R,et al. Cancer incidence and mortality worldwide: sources,methods and major patterns in GLOBOCAN 2012 [J]. Int J Cancer,2015, 136(5):E359-E386.
[3] 柏兆方,王春宇,王伽伯,等.马兜铃酸与肝癌相关性的研究及思考[J].世界科学技术-中医药现代化,2019,21(7):1275-1279.
[4] 潘秋予,田小兵,吴鹏,等.2015年南充市死因监测地区居民恶性肿瘤死亡及减寿分析[J].中华肿瘤防治杂志,2019,26(23):1743-1749.
[5] 黑育荣,彭修娟,杨新杰.松花粉的有效成分及药理活性研究进展[J].农产品加工,2019(17):95-96,99.
[6] 邵明惠.松花粉多糖酯化前后对H22荷瘤小鼠抗肿瘤及免疫调节的研究[D].济南:山东师范大学,2019.
[7] Zuo CH,Xia M,Liu JS,et al. Transcatheter arterial chemoembolization combined with interferon-alpha is safe and effective for patients with hepatocellular carcinoma after curative resection [J]. Asian Pac J Cancer Prev,2015,16(1):245-251.
[8] Kwon J,Chun KS,Song IS,et al. Long-term outcome of intraoperative radiofrequency ablation for hepatocellular carcinoma and its efficacy as a primary treatment [J]. Ann Hepatobiliary Pancreat Surg,2020,24(1):24-32.
[9] 贺珊,廖长秀.中药治疗肝癌机制的研究进展[J].中成药,2017,39(1):155-160.
[10] 李翔.马兜铃酸及其衍生物在尿路上皮肿瘤及肝癌的发生中扮演重要角色[J].现代泌尿外科杂志,2017,22(11):871-873.
[11] 陈一凡,席榕,唐爽,等.基于古今文献分析的松花粉食疗应用探究与展望[J].亚太传统医药,2018,14(6):122-125.
[12] 戴承恩,何小平,郑芬芬,等.松花粉主要活性成分及保健作用的研究进展[J].食品研究与开发,2019,40(8):212-219.
[13] Zhou C,Yin S,Yu Z,et al. Preliminary Characterization,Antioxidant and Hepatoprotective Activities of Polysaccharides from Taishan Pinus massoniana Pollen [J]. Molecules,2018,23(2).pii:E281.
[14] 巩萍,孙铜,戴晓莉,等.松花粉对环磷酰胺增效减毒作用研究[J].中国比较医学杂志,2017,27(5):60-63.
[15] 赵学友,巩萍,孙铜,等.松花粉辅助紫杉醇联合铂类化疗的增效减毒作用[J].中国比较医学杂志,2017,27(10):47-50.
[16] 刘晟男,钱甜甜,郎慧玲,等.抑制JNK通路对染料木黄酮诱导肝癌MHCC97-L细胞凋亡及caspase-3和caspase-9活性的影响[J].中国医药导报,2019,16(36):19-23.
[17] 陈鹏,焦方舟.炎性小體与肝脏疾病关系的研究进展[J].疑难病杂志,2018,17(11):1286-1290.
[18] Vescovo T,Pagni B,Piacentini M,et al. Regulation of Autophagy in Cells Infected With Oncogenic Human Viruses and Its Impact on Cancer Development [J]. Front Cell Dev Biol,2020,8:47.
[19] Huang L,Hu C,Cao H,et al. MicroRNA-29c Increases the Chemosensitivity of Pancreatic Cancer Cells by Inhibiting USP22 Mediated Autophagy [J]. Cell Physiol Biochem,2018,47(2):747-758.
[20] Rahman MA,Hwang H,Nah SY,et al. Gintonin stimulates autophagic flux in primary cortical astrocytes [J]. J Ginseng Res,2020,44(1):67-78.
[21] Liu S,Li X. Autophagy inhibition enhances sensitivity of endometrial carcinoma cells to paclitaxel [J]. Int J Oncol,2015,46(6):2399-2408.
(收稿日期:2019-08-20 本文编辑:顾家毓)
