大白菜杂交新组合ZF006未成熟杂交种纯度分子标记快速鉴定
2020-07-04刘栓桃张志刚王立华王荣花李巧云赵智中
刘栓桃 张志刚 王立华 王荣花 李巧云 赵智中


摘要:为在大白菜种子收获前提早鉴定杂交种纯度,使新组合顺利进行品种登记、新品种种子提早上市销售,本研究以新组合ZF006及其雙亲为试材,对ZF006杂交种试配阶段双亲二级侧枝上近、中及远端3个部位的未成熟种子进行了离体诱导和单棵幼苗DNA提取。同时,采用20对均匀分布于大白菜基因组的InDel标记对双亲进行多态性引物的筛选,共筛选到8对双亲间有多态性的引物,选择其中4对共显性且条带清晰的InDel引物用于杂交种纯度鉴定。结果表明:双亲二级侧枝上不同部位的未成熟杂交种离体诱导萌发率有较大差异,近端和中端的种子离体诱导萌发率较高,远端的种子离体诱导萌发率较低;亲本P1的二级侧枝近、中及远端未成熟种子的杂交率分别是87.96%、97.45%和94.44%,而亲本P2的则明显低于P1对应部位的种子,分别是71.53%、90.37%和90.00%,总体上, P1收获的种子杂交率为92.49%,而亲本P2的为80.52%,双亲混收的杂交率则为86.54%。综上结果,单收和混收杂交种的纯度均未达到98%的国家标准,提示新组合ZF006双亲有必要在自交不亲和性方面继续加以改进。而本研究构建的未成熟大白菜杂交种纯度快速鉴定技术,对大白菜种业企业降低成本、加速资金周转以及提高经营效益具有重要的实践指导意义。
关键词:大白菜;杂交组合;未成熟种子;纯度;分子标记;快速鉴定
中图分类号:S634.103.7 文献标识号:A 文章编号:1001-4942(2020)01-0031-06
Abstract The experiment was aimed to identify hybrid seed purity rapidly before harvest for registration of new cross combinations in time and earlier sale of new seeds. A new Chinese cabbage cross combination ZF006 and its parental lines P1 and P2 were used as materials. The in vitro seedlings were induced from parent immature seeds from near, medium and far parts of the secondary branches, and the DNA was extracted from single seedling at seed trial production stage. At the same time, 20 pairs of InDel primers were used for screening polymorphic primers between P1 and P2, and eight pairs of polymorphic primers were selected. Four of them with co-dominant property were chosen for the detection of seed purity. The results showed that the in vitro induction rate of immature seeds from different parts of the secondary side branches was different obviously, and that was 87.96%, 97.45% and 94.44% of P1 line from near-medium-far parts, while that of P2 line was 71.53%, 90.37% and 90.00% respectively. In general, the hybridized rate of seeds from P1 and P2 were 92.49% and 80.52%,respectively. If the seeds from P1 and P2 were mixed, the total hybridized rate was 86.54%. All the results implied that the hybridized rate of the hybrid seeds harvested from single parent line or mixed lines did not come up to the national standard, which was 98%. It suggested that the self-incompatibility of the parental lines should be improved. Besides, the constructed method in this study for rapid identification of immature seed purity of Chinese cabbage would have guiding significance to saving cost of Chinese cabbage seed enterprises, promoting the turnover of funds and increasing economic benefits.
Keywords Chinese cabbage; Cross combination; Immature seeds; Purity;Molecular marker; Rapid identification
大白菜是常异交作物,自交衰退严重,因而生产实践中主要使用杂交种。山东省是大白菜杂交种主要制种基地之一,由于小气候等原因导致的双亲花期不遇、父母本田间移栽模式和比例等因素的差异,使得不同制种基地收获的种子质量存在差别,主要体现为父母本自交结实导致的自交株和异源花粉串入导致的假杂交种,因此,必须对杂交种的纯度和真实性进行鉴定才能包装销售。
常规的大白菜杂交种纯度鉴定是在种子收获后进行,即当年收获的种子无论合格与否先入库保存,待秋季通过田间种植法再进行表型鉴定。而不同产地的种子入库时必须分别存放,且不能进行精加工,这必然增加了企业库存管理成本。此外,为了得到准确的鉴定结果并降低售后可能存在的风险,田间鉴定必须持续一个完整的大白菜生长季节,一般鉴定完成时已经错过当年的销售旺季,只能选择将种子入库待来年销售,而库存种子又占压大量资金,增加企业的经营成本。因此,有必要研究大白菜杂交种入库前的纯度快速鉴定技术,以最大限度降低企业经营成本,提高资金收益比。
采用分子标记法鉴定种子纯度快速、准确,不受环境限制,已经发展成为一种比较成熟的技术,如SSR标记[1-3]、SRAP标记[4]、InDel标记[5]、EST-SSR标记[6]等已经分别被用于不同品种大白菜杂交种的纯度鉴定。上述研究中,有些研究者仅用1~2对适宜特定杂交种纯度鉴定的引物开展鉴定工作[1, 3, 4],很难鉴定种子的真实性。相比较而言,薛银鸽[5]、杨晓云等[2]采用的InDel或SSR引物组合的形式不仅可以鉴定更多的杂交种或亲本材料,也能用于杂交种真实性的鉴定,尤其是InDel引物,是典型的共显性标记,往往仅能鉴定出两个多态性位点[5,7],用于杂交种纯度鉴定的优势比较明显。
本试验在前期研究的基础上,选择20对InDel标记,对大白菜新组合ZF006双亲P1和P2开展多态性鉴定,拟筛选适宜种子纯度鉴定的特异引物,同时以制种棚中双亲单株的二级侧枝不同部位未成熟种子为试材,通过成熟胚培养诱导单株幼苗提早发育、DNA快速提取等手段,对种子纯度进行分子标记鉴定,以期建立快捷高效的大白菜杂交种纯度鉴定技术,为提高大白菜经营效益提供技术保障,也为其它大白菜杂交种提早鉴定提供方法参考。
1 材料與方法
1.1 试验材料
供试材料为大白菜新组合ZF006及其双亲P1和P2。试验于2019年1—5月在山东省农业科学院蔬菜花卉研究所核心试验基地进行。
1.2 试验方法
1月2日将双亲种子置于28℃恒温培养箱催芽24 h,次日将露出胚根的种子点播于冬暖大棚的育苗钵(10 cm)中。基质由田土和草炭按1∶ 1混匀而成。播后先覆盖1 cm蛭石后覆盖地膜,自然光照,幼苗自然通过春化。于3月上旬定植于制种纱网棚内,双亲按1∶ 1比例间隔种植,常规管理。随时观察并调查双亲始花期性状,以50%植株开始开花定位某材料的始花期,待双亲都进入始花期后开始放入熊蜂进行辅助授粉。
1.2.1 取样方法 双亲取样:从制种棚随机选择P1和P2各10个单株,分别取其幼嫩叶片约100 mg,锡箔纸包裹后置液氮中冷冻处理3 min以上,再于-80℃保存备用。杂交种取样:5月底临近种子收获期,分别随机选择P1 和P2各5株,将植株的二级侧枝按照总长度平均分为三截,即如图1所示的1、2、3,分别对应二级侧枝的近、中和远端,每段各取种荚50个备用。
1.2.2 未成熟种子处理 未成熟种子需要进行幼胚培养,待其发育为具有一定组织的幼苗后再进行DNA提取。具体操作步骤:室内流水冲洗种荚30 min,后用0.1%升汞溶液在超净工作台上对种荚表面消毒10 min,无菌水洗3次,拨出幼嫩种子置于固体MS基础培养基上,并于25℃、16 h光照8 h黑暗条件下培养。每个部位幼嫩种子接种300~400粒。随时观察,待下胚轴伸长、子叶完全展开时统计发芽率后待用。
1.2.3 DNA的提取 取保存的P1和P2叶片以及在培养基上发育至子叶完全展开的单株幼苗,分别置于2 mL的研磨管内,采用下列步骤进行DNA提取:加3粒直径4 mm的陶瓷珠于研磨管中,再加200 μL TPS (100 mmol/L Tris-HCl、1 mol/L KCl和10 mmol/L EDTA,pH=8.0) 提取液,于自动研磨仪 (法国, Precellys24) 上5 000 r/min振荡10 s,65℃恒温箱保温30~60 min,待冷却至室温后,12 000 r/min 离心10 min;将上清液直接转移至新的离心管中,加入等体积异丙醇使DNA沉淀,12 000 r/min 离心10 min,弃上清;DNA 沉淀室温干燥10 min后,用20 μL 10 mmol/L的Tris-HCl (pH=8.0) 溶解。采用NanoDrop(美国,Thermo Fisher)超微量分光光度计测定DNA浓度,分别将P1、P2各10个单株的DNA模板等量混匀,-20℃保存备用。
1.2.4 PCR反应 杂交种纯度鉴定的引物从前期研究[7,8]中筛选,每条染色体上选择2对,共计选择20对引物(表1),委托上海生工生物技术有限公司合成。PCR反应参照张志刚等[8]的方法进行。反应体系(20 μL):2×Taq PCR Mastermix 10 μL,10 μmol/L正、反向引物各1 μL,DNA 模板1 μL,灭菌水7 μL。PCR 反应条件:94℃预变性5 min;94℃变性30 s、59℃退火30 s、72℃延伸10 s,循环35 次。PCR 扩增在BioRad T 100梯度PCR仪上进行,扩增产物用6%非变性聚丙烯酰胺凝胶电泳、银染显色,数码相机拍照。杂交种纯度=所有中选引物都是杂合带型的种子数目/所有待检种子数目×100%。
1.3 数据处理与分析
采用Microsoft Excel 2010软件进行数据统计。
2 结果与分析
2.1 双亲开花期调查结果
双亲花期相差时间较少: P1于4月5日前后进入始花期, P2则延迟5 d左右,于4月10日前后进入始花期。二者盛花期基本介于4月15日至5月15日之间。
2.2 不同部位幼嫩种子离体诱导结果
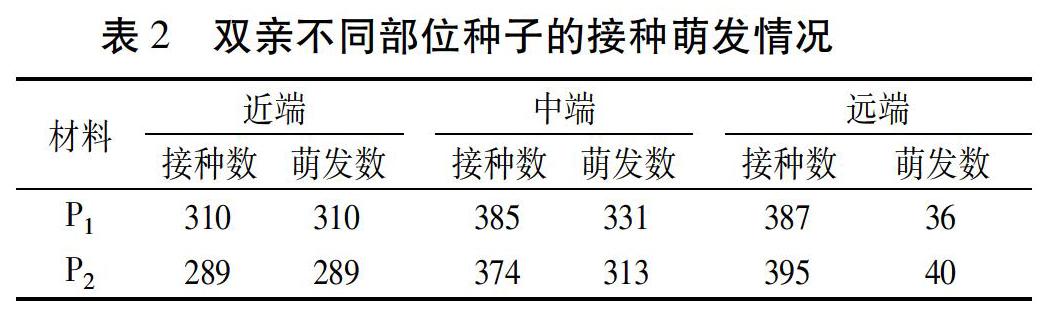
大白菜花序属无限生长型,不同部位的花开放时间不一致,导致侧枝上不同部位种荚中种子的成熟度也不一致。近端靠近主花茎,开花相对较早,种子发育时间长,临近收获期种子比较饱满、接近成熟。P1和P2的近端分别接种310、289粒种子,经过1周培养均能百分之百萌发,双亲间没有差异。远端离主花茎较远,开花最晚,授粉后种子发育时间短,荚内种子成熟度较差,基本为未成熟状态。P1和P2的远端分别接种387、395粒种子,历经3周培养,仅分别有36、40粒种子萌发成幼苗,且幼苗长势弱,总计萌发率仅有10%左右。中端开花时间居于上述两者之间,荚内种子发育时间相对较长,但由于近端到远端的花陆续开放和受粉,靠近主花茎(近端)的种荚种子发育相对较好、远离主花茎(远端)的发育相对较差。P1和P2的中端分别接种385和374粒种子,历经2周时间大部分未成熟种子陆续萌发,最终分别有331、313粒萌发,萌发率在85%左右。对于中端和远端不能萌发的种子,即使再延长诱导培养时间也不能促使其萌发。双亲二级侧枝上各部位种子萌发情况详见表2。
2.3 双亲间多态性引物筛选
采用20对引物对双亲进行PCR扩增和PAGE检测,共筛选出12对可扩增双亲多态性条带的引物,分别为ZF002、ZF003、ZF006、ZF007、ZF008、ZF009、ZF010、ZF013、ZF015、ZF016、ZF019和ZF020。图2是部分引物在双亲间的筛选结果,可知,ZF007在双亲中扩增得到的条带数较多,不适用于杂交种纯度鉴定;ZF003、ZF008等8对引物可扩增出单一条带,适用于杂交种纯度鉴定。本研究选择其中4对引物:ZF003、ZF008、ZF015和ZF016进行杂交种纯度鉴定。
2.4 双亲不同部位种子杂交率的分子标记检测
以P1、P2为对照,采用4对引物分别对3个部位的种子进行分子标记检测(真杂交种判定标准:同一样本4对引物均能扩增出相应条带),部分结果见图3。本研究中,小纱网棚隔离较好,所有檢测样本中未出现串粉现象。亲本P1的近、中和远端检测到的杂交率分别是87.96%、97.45%和94.44%,亲本P2相应部位的种子杂交率分别是71.53%、90.37%和90.00%(表3)。总体上亲本P1收获的种子杂交率达92.49%,亲本P2收获的种子杂交率仅有80.52%,双亲混收的杂交率只有86.54%。
3 讨论与结论
种子纯度鉴定是指对一批种子中个体间在特性方面典型一致性程度的检验和鉴定。种子纯度是表征种子质量的最重要指标之一,也是种子销售前必须进行的检验环节。大白菜通常采用自交不亲和系制种,杂交种纯度取决于双亲自交不亲和指数的高低、制种田隔离状况、近缘物种在制种基地周围的分布状况以及自身花粉与另一亲本花粉同时落在柱头上的萌发机制的差异。新的杂交组合在各项农艺性状都基本达到预定育种目标之后、有望成为品种前,一般会进行小规模制种,主要是为了初步了解潜在的种子产量,进一步掌握双亲花期,更重要的是掌握新组合的杂交率亦即种子的纯度,因为这是关系到一个新组合能否成为品种的重要指标之一。
大白菜不同部位花开放时,温度和光照条件的差异可能会影响其自交不亲和性,因而本研究对新组合ZF006的双亲P1和P2上不同部位收获的种子分别进行鉴定,发现不仅不同亲本相同部位种子的杂交率存在显著差异,即使同一亲本不同开花时间对种子杂交率也有很大影响。前者主要是不同材料的自交亲和性存在差异的缘故,而同一材料不同部位种子杂交率的差异可能与不同部位花器官开放时的环境因素有关。大白菜从始花期到末花期,历经仲春到初夏,温度逐渐升高、日照逐渐延长。近端开花时间较早、环境温度较低、日照时间较短;远端开花较晚、环境温度较高、日照时间较长;相比较而言,中端正是盛花期,环境温度比较适宜。这些因素都可能影响自身花粉和异缘花粉在柱头上的发育,导致种子杂交率差异。刘晓东等[9]曾报道大白菜不同部位亲和指数由下而上递增的现象,本试验结果也表明两亲本收获的种子杂交率有明显差异,推测这种变化都同环境因素有关,并且不同材料自交亲和性对自然温度和光照的响应不同。本研究得出,新组合ZF006的双亲P1和P2的种子总体杂交率仅有92.49%和80.52%,均未达到国家标准要求的98%的纯度值。因此,新组合ZF006不能作为一个品种登记,下一步需要进一步改造双亲的自交不亲和特性。
本研究建立了一种未成熟种子杂交率的分子标记快速鉴定技术,该项技术对大白菜种子经营企业有重要的借鉴意义。传统的杂交种纯度鉴定常采用田间种植法,它通过田间种植过程中观察大白菜叶球生长发育不同阶段的形态学特征对杂交种进行鉴定,并且必须在种子收获以后进行。而要得到相对准确的鉴定结果,还需要采用单粒点播育苗后移栽的方法,最大缺点是周期长、费时费力,且鉴定结果严重滞后,容易受环境和主观因素的影响。采用分子标记鉴定未成熟大白菜杂交种纯度,在之前的研究中未见报道,其中比较重要的环节就是得到单粒未成熟种子的DNA。玉米、大豆、水稻等大粒种子有单粒种子DNA提取方法可供参考[10-12],但具体到体积比较小的大白菜种子,实用性并不强。虽然目前有各种商业化的微量组织DNA提取试剂盒或策略可供采纳,但操作一般都比较复杂、成本也比较高,不适宜在企业推广。考虑到简化操作、降低成本的实践需求,本研究采用牺牲适当时间换取成本的策略,直接将未成熟种子进行离体培养、诱导幼苗萌发,使其发育成具有一定细胞数目和组织重量的幼苗,再将整株幼苗用于DNA提取,常规方法就能得到满足试验需要的DNA。该方法操作简单、成本低廉、易于推广普及。因此在大规模田间制种过程中,以未成熟杂交种为试材通过离体诱导幼苗萌发,再采用分子标记方法快速鉴定杂交种纯度,不仅节省田间鉴定所需的土地租赁、人工管理等费用,还可防止不合格种子在晾晒过程中与合格种子掺杂,同时避免不同基地采收种子在仓库中保存一年所挤占的资金和管理过程的各项成本,更为重要的是鉴定合格的种子晾晒后可以直接进行包衣等精加工,可以赶在当季提早上市销售,这显著加速了资金周转率并提高企业的经营效益。
参 考 文 献:
[1] 管志坤, 罗双霞, 李艳霞, 等. 利用SSR标记鉴定油绿3号大白菜品种纯度[J]. 种子, 2011, 30(9):34-35, 39.
[2] 杨晓云, 田术美, 张清霞, 等. 青研系列大白菜杂交种及亲本指纹图谱构建和杂种纯度鉴定[J]. 分子植物育种, 2013, 11(1):107-112.
[3] 马效鹏, 刘梦龙, 张鲁刚.大白菜新品种“秋白80”纯度的SSR鉴定[J]. 西北農业学报, 2013, 22(10):131-134.
[4] 严慧玲, 闫树成, 杨慧民, 等. 利用SRAP分子标记技术鉴定大白菜种子纯度[J]. 热带农业科学, 2011, 31(6):50-52, 60.
[5] 薛银鸽, 原玉香, 张晓伟, 等. 利用InDel标记鉴定大白菜杂交种豫新四号种子纯度[J]. 农业生物技术学报, 2014, 22(4):449-456.
[6] 赵新, 王永, 兰青阔, 等. 基于复合EST-SSR标记的大白菜种子纯度鉴定及SNP位点获取[J]. 中国蔬菜, 2013 (14):31-38.
[7] 刘栓桃, 张志刚, 司立英, 等. 基于InDels标记的大白菜育种材料的亲缘关系鉴定[J]. 植物遗传资源学报, 2018, 19(4):657-667.
[8] 张志刚, 赵智中, 李巧云, 等. 大白菜InDels标记开发及其在剩余杂合体鉴定中的应用[J].农业生物技术学报, 2016, 24(4):510-518.
[9] 刘晓东, 牟金贵, 刘学岷, 等. 大白菜花期自交亲和指数测定及不同部位亲和性的变化[J].河北农业科学, 2004,8(4):34-36.
[10] 田苗苗, 周延清, 牛敬媛, 等. 单粒干燥大豆种子基因组DNA提取的有效方法[J].生物学通报, 2005, 40(10):38-39.
[11] 郑淑波, 刘宏伟, 王敏, 等. 适用于分子育种的玉米种子无损基因型鉴定技术优化[J]. 分子植物育种, 2015, 13(12):2865-2870.
[12] 李炫丽, 王世才, 许双全. 水稻单粒种子DNA提取及SSR-PCR反应体系的正交设计优化[J].中国种业, 2011 (8):46-49.
