基于离子液体的双水相体系的分离机理及应用
2020-07-03田宏哲徐成浩许春琦付浩亮
田宏哲, 徐成浩,许春琦,付浩亮
(沈阳农业大学 植物保护学院,辽宁 沈阳 110161)
1956年Albertsson最先建立双水相体系(ABS)萃取生物大分子[1],随后该体系受到了广泛关注。早期的双水相体系由两种聚合物,或聚合物与无机盐组成,其原理是两种聚合物,或聚合物与盐之间在一定浓度上由于排斥作用互不兼容从而形成两相体系。与传统的使用有机溶剂的液-液萃取法相比,该体系具有非常突出的优势:萃取时间短,能量消耗低,易于规模化且生物兼容性好,因此,被广泛应用于生物大分子的回收及纯化,然而共存的两相间有限的极性区间成为限制该体系应用的瓶颈。2003年Rogers等[2]首次以咪唑类离子液体和K3PO4构建双水相体系,很好地解决了上述问题,随后应用离子液体(IL)建立双水相体系引起了研究者的深入探索[3-6]。
现有研究表明,离子液体与无机盐[7-8]、聚合物[9-12]或表面活性剂[13-15]等皆可形成双水相体系。离子液体是由不同的阴阳离子经过反应所形成的在室温或近于室温时呈液体状态的有机盐[16],其重要优势是可通过改变组成离子液体的阴阳离子的化学结构调节其理化特性,从而形成结构可控的离子液体。按组成离子液体的阳离子化学结构不同,可分为咪唑类、季膦类、季铵类、吡啶类及胆碱类等离子液体。与传统的有机溶剂相比,离子液体具有不可燃性,电导率高,热稳定性及化学稳定性高,不易挥发等优势,因而作为环境友好的绿色溶剂在样品萃取中具有极大的潜力[17]。
1 基于离子液体的双水相体系的相分离机理
1.1 离子液体-盐的双水相体系的相分离机理
咪唑类离子液体与盐组成的双水相体系的相分离机理已经十分明确:两相分离趋势与盐离子形成水合络合物的能力是一致的,而盐离子的水合能力越强越容易将离子液体排斥从而形成第二相,即“盐析”效应[18-19]。最近研究表明,采用胆碱类离子液体与K3PO4构建的双水相体系[20],其相分离机理也遵循“盐析”效应。
Sintra等[21]采用胆碱离子液体分别与磷酸盐缓冲溶液(pH 7.0)、柠檬酸盐缓冲溶液(pH 5.0、6.0、7.0、8.0)或碳酸钾溶液(pH 13.0)构建双水相体系,进一步证实中性或碱性盐溶液能够与两种离子液体形成双水相体系,而酸性盐溶液无法与离子液体构建双水相体系。Lv等[22]采用[C2mim]BF4(离子液体的阴阳离子结构见表1)分别与Na2HPO4和NaH2PO4水溶液建立双水相体系,发现Na2HPO4比NaH2PO4具有更强的“盐析”能力,该研究也证实碱性条件更易于双水相体系的形成。综上所述,采用不同结构的离子液体与盐形成双水相体系,其相分离机理主要是“盐析”效应。

表1 综述中用于离子液体双水相体系的离子Table 1 Ions used in ionic liquid-based ABS reviewed in this report
(续表1)
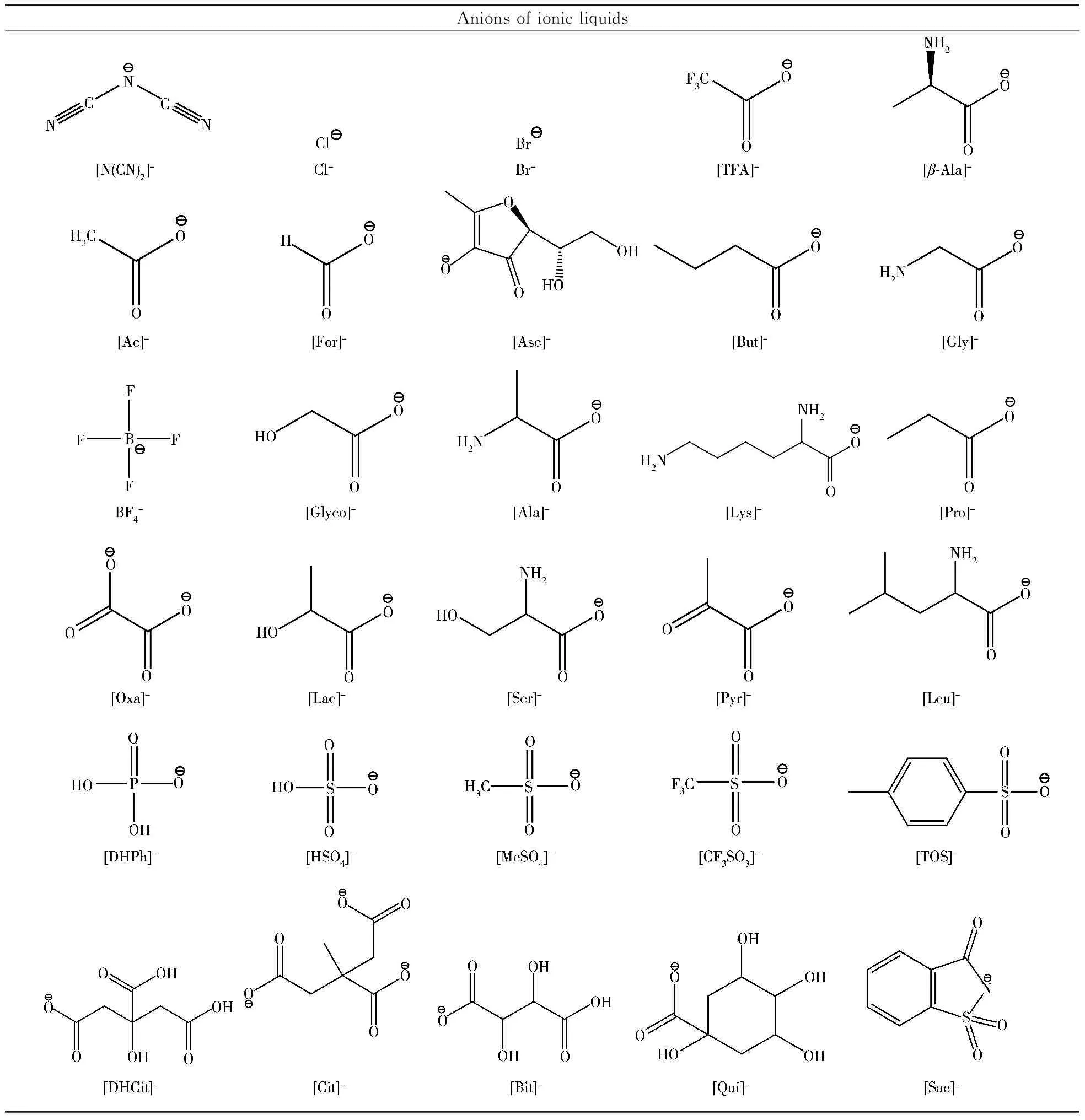
Anions of ionic liquids
1.2 离子液体-聚合物的双水相体系的相分离机理
与离子液体-盐的双水相体系相比,离子液体-聚合物的双水相体系的机理更为复杂。Li等[23]分别采用9种胆碱离子液体([Ch][For]、[Ch][Ac]、[Ch][Pro]、[Ch][But]、[Ch][Glyco]、[Ch][Lac]、[Ch][Cit]、[Ch][Oxa]及苯甲酸胆碱)与聚丙二醇(PPG 400,分子量400)构建双水相体系,发现该类双水相体系的分离机理也是“盐析”作用,即离子液体与聚合物分子竞争与水分子的水合作用,而胆碱离子液体与水分子具有更强的水合作用,因而使聚合物在水中的溶解度降低,从而形成另一相。由于上述离子液体的阳离子相同,所以不同离子液体形成双水相体系的能力由其阴离子决定,阴离子的水合能力越强,该离子液体越容易与PPG 400形成双水相体系。而Liu等[24]采用4种胆碱离子液体([Ch][Glyco]、[Ch][Pro]、[Ch][Lac]、[Ch]Cl)分别与PPG 400、PPG 1000、环氧乙烷/环氧丙烷共聚物(EOPO)建立双水相体系,其研究结果也表明亲水性越强的阴离子水合容量越大,因而其所形成的离子液体具有更强的“盐析”能力。Mondal等[25]和Quental等[26]分别采用不同的胆碱离子液体与PPG 400构建双水相体系,同样证实其相分离机理是“盐析”效应。
然而,2013年Pereira等[27]采用5种胆碱离子液体([Ch]Cl、[Ch][Bic]、[Ch][DHcit]、[Ch]Ac、[Ch][DHph])分别与聚乙二醇(PEG 400、PEG 600及PEG 1000)构建双水相体系,发现其相分离机理不遵循“盐析”效应,而是由聚合物、离子液体与水分子之间相互作用的平衡关系所决定。Freire等[28]也深入探讨了咪唑类离子液体与PEG形成双水相体系的分离机理,发现该类离子液体与PEG形成的两相体系的分离机理尚不明确,因为离子液体或聚合物与水分子都能形成独立的溶剂化作用,该作用由水与离子液体之间,或水与聚合物之间的氢键作用所形成,而该溶剂化作用决定了体系的相分离机理。
Mourão等[29]采用胆碱离子液体分别与PEG 600及PEG 4000建立双水相体系,PEG 600比所选择的胆碱离子液体更易与水分子相互作用,因此,在考察其相分离机理时除了考虑PEG 600-水分子、离子液体-水分子间的相互作用,离子液体-PEG 600之间的相互作用也不容忽视。在该体系中离子液体-PEG 600之间的相互作用强于PEG 600-水分子或离子液体-水分子间的相互作用,因此,该体系的相分离机理主要由PEG 600-离子液体之间的相互作用所决定。
亲水离子在PEG水溶液中的溶剂化是非常复杂的,其溶剂化过程取决于所有可能的相互作用(PEG-水、PEG-离子液体、水-离子液体)之间的平衡,因此,此类离子液体与PEG形成的双水相体系的分离机理比离子液体-盐体系的“盐析”机理更为复杂,还需要进一步验证。
2 基于离子液体的双水相体系的应用
作为环境友好的绿色溶剂,离子液体由于可以提供生物兼容性好的萃取环境已被广泛应用于生物样品的分离纯化[30]。考虑到离子液体所具有的优点,基于离子液体的双水相体系被认为是最有可能替代传统液-液萃取法的样品制备方法,具有很好的发展前景。而且,最近许多文献报道的新型胆碱离子液体在生物大分子分离纯化中更有优势,该类离子液体所提供的萃取环境可以维持蛋白质和酶的化学结构、生物活性和光学活性[23]。因此,基于胆碱离子液体的双水相体系已开始受到广泛关注。
2.1 生物样品的萃取分离
2.1.1 离子液体-无机盐的双水相体系的应用离子液体-盐的双水相体系由于两相粘度较小,易于操作,已广泛应用于生物样品的分离纯化(见表2)。Neves等[31]选择8种咪唑离子液体:[C1mim]Cl、[C2mim]Cl、[C4mim]Cl、[C6mim]Cl、[C7H7mim]Cl、[amim]Cl、[C1im]Cl及[C2OHmim]Cl,分别与K3PO4构建双水相体系。采用不同体系对L-色氨酸进行萃取,发现待测分子与离子液体之间主要存在疏水及氢键作用,其在不同体系中的分配系数为:[amim]Cl>[C7H7mim]Cl>[C2OHmim]Cl>[C2mim]Cl>[C4mim]Cl>[C1im]Cl。待测组分在不同双水相体系中的分配系数(K)在14.2~124之间,表明该类双水相体系可以高效地萃取分离待测组分。
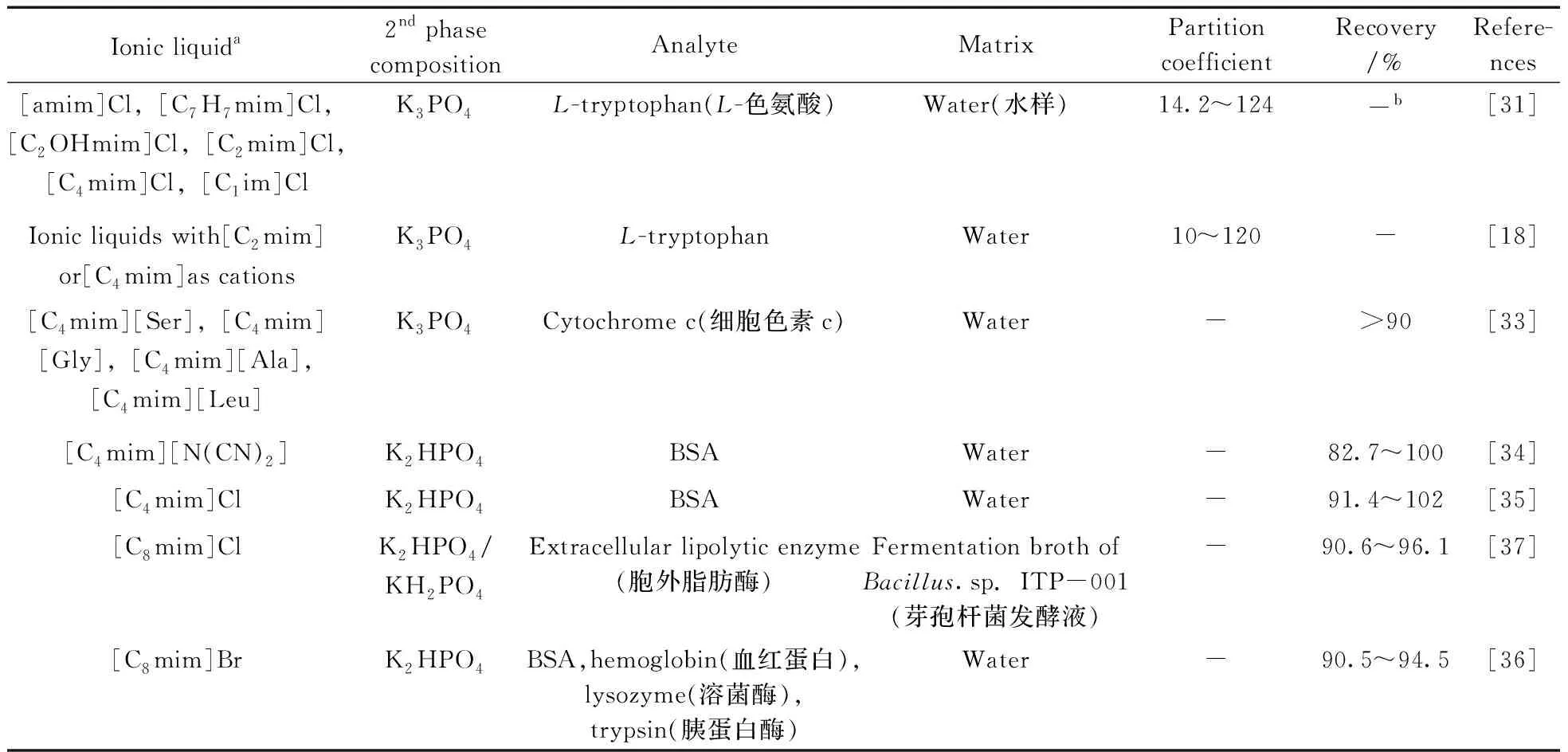
表2 基于离子液体的双水相体系在生物样品萃取分离中的应用Table 2 The application of aqueous biphasic systems based on ionic liquids on the extraction of biological samples
(续表2)

Ionic liquida2nd phase compositionAnalyteMatrixPartition coefficientRecovery/%Refere-nces[Cnmim]BF4(n=2,3,4,6)[Cnmim]Br(n=3,4,6)NPTABL-tryptophan,methylene blue(亚甲基蓝)Water-50~70[42] [P4441][MeSO4]L-tryptophanWater9.0-[32][Pi(444)1][TOS],[P4441][MeSO4],[P4444]BrK3PO4Rhodamine 6G(罗丹明6G)0.018~8.0-[P4444]Brβ-carotene(β-胡萝卜素)61.0-[P4441][MeSO4]Caffeine(咖啡因)4.75-[N11[2(N11)0]]ClPPG 400Cytochrome c,azocasein(偶氮酪蛋白)Water->95[39][Ch][Lac],[Ch][DHPh],[Ch][Bit],[Ch][DHCit],[Ch][But],[Ch][Pro],[Ch][Gly],[Ch][Ac]PPG 400BSABovine serum(牛血浆)-92~100[26][Ch][Lys]PPG 400BSAWater11.1-[38][Ch][Gly]BSA,trypsin3~9(BSA);2~11(trypsin)[Ch][Ser]BSA9.15[Ch][β-Ala]BSA5.88[Ch][Cit],[Ch][Oxa],[Ch][But],[Ch][Glyco],[Ch][Pro],[Ch][Lac],[Ch][Ac],[Ch][For]PPG 400Lysozyme,papain(木瓜蛋白酶),trypsin,BSAWater3.2~51.886.4~99.9[23][Ch]ClTergitol NP-10Pectinases(果胶酶)Fermented broth of Asper-gillus flavipes FP-500(黄柄曲霉发酵液)->90[41][Ch][DHPh]PEG400RubiscoMicroalgal biomass(微藻)2.6~3.672.1~79.6[40][Ch][Pyr]PPG400IgGRabbit serum(小鼠血浆)-58.9[25][Ch][Asc]85.4[Ch][Qui]51.5[Ch][Glyco]45.1
a.ionic liquids can be found in Table 1,b.designates a value not reported in the reference
Ventura等[18]也采用11种咪唑类离子液体(阳离子分别为[C2mim]+和[C4mim]+)与K3PO4构建双水相体系,并采用L-色氨酸评价了不同体系的萃取能力。L-色氨酸易于富集离子液体相,在不同体系中的分配系数按如下顺序排列:[C2mim]Cl>[C2mim][CF3SO3]≈[C2mim][CH3CO2]>[C2mim][EtSO4]=[C2mim][MeSO4]或[C4mim][N(CN)2]>[C4mim]Cl≈[C4mim][TFA]≈[C4mim]Br>[C4mim][CF3SO3]>[C4mim][CH3SO3]。而且离子液体的不同阴阳离子对待测组分的萃取也存在影响,与构成离子液体的阳离子影响相比(K为10~120),阴离子的影响并不显著(K为4~60)。
Louros等[32]分别采用[P4441][MeSO4]、[Pi(444)1][TOS]及[P4444]Br与K3PO4构建双水相体系,并用于水中L-色氨酸、罗丹明6G、β-胡萝卜素及咖啡因的萃取分离。3种离子液体的相分离能力如下:[P4444]Br>[Pi(444)1][TOS]>[P4441][MeSO4],由于离子液体与待测组分之间存在疏水相互作用,使得待测组分主要富集于离子液体相,其中β-胡萝卜素萃取效率最高(K为61.0),而罗丹明6G萃取效率最低(K为0.018~8.0)。
Wu等[33]分别采用[C4mim][Ser]、[C4mim][Gly]、[C4mim][Ala]及[C4mim][Leu]与K3PO4形成双水相体系,用于细胞色素c的萃取分离。该类离子液体与无机盐形成双水相体系的能力如下:[C4mim][Ser]<[C4mim][Gly]<[C4mim][Ala]<[C4mim][Leu],即构成离子液体的阴离子的疏水性显著影响其相分离能力。细胞色素c在不同体系中的萃取率皆高于90%,疏水相互作用显著影响待测组分在双水相体系中的分配效率。
Pei等[34]及Du等[35]分别采用[C4mim][N(CN)2]、[C4mim]Cl与K2HPO4构建双水相体系,萃取水中的牛血清白蛋白(BSA)。两种离子液体都能与该无机盐形成双水相体系,且对BSA具有很高的萃取效率(分别为82.7%~100%和91.4%~102%)。Lin等[36]采用4种咪唑离子液体与K2HPO4构建双水相体系,几种离子液体的相分离能力如下:[C2mim]Br<[C4mim]Br<[C6mim]Br<[C8mim]Br,因此,选择[C8mim]Br与K2HPO4形成的体系对水中的BSA、血红蛋白、溶菌酶及胰蛋白酶进行分离,4种蛋白质的萃取效率可达90.5%~94.5%。Ventura等[37]采用[C8mim]Cl与K2HPO4/KH2PO4缓冲溶液(pH 7.0)构建双水相体系,用于芽孢杆菌发酵液中胞外脂肪酶的萃取分离,该体系对胞外脂肪酶具有很高的萃取效率(90.6%~96.1%)。
现有研究表明,基于离子液体-盐的双水相体系所建立的萃取方法简单快速,环境污染小,在生物样品萃取分离方面具有显著的优势。
2.1.2 离子液体-聚合物的双水相体系的应用相比于离子液体-无机盐的双水相体系,离子液体-聚合物的体系由于其近于中性的萃取条件,在生物样品萃取分离方面的应用更为广泛。Quental等[26]分别采用8种胆碱离子液体与PPG 400构建双水相体系用于牛血浆中的BSA萃取分离,不同离子液体对BSA的萃取能力如下:[Ch][Lac]<[Ch][DHPh]<[Ch][Bit]≈[Ch][DHCit]≈[Ch][But]≈[Ch][Pro]≈[Ch][Gly]≈[Ch][Ac],BSA在不同体系中均具有很高的萃取效率(92.0%~100%)。
Song等[38]分别采用[Ch][Ser]、[Ch][Gly]、[Ch][β-Ala]和[Ch][Lys]与PPG 400构建双水相体系,用于水中BSA和胰蛋白酶的萃取分离。待测组分在不同体系中的萃取效率如下:[Ch][Lys]>[Ch][Gly]≈[Ch][Ser]≈[Ch][β-Ala]。待测蛋白质在不同体系中的分配行为受离子液体中阴离子的疏水性及体系pH值的影响,更易于富集在疏水性较弱的离子液体相,其中BSA的分配系数为3~11.1,而胰蛋白酶的分配系数为2~11。
Passos等[39]采用[N11[2(N11)0]]Cl与PPG 400建立双水相体系,用于萃取分离水中的细胞色素c和偶氮酪蛋白,2种组分的萃取回收率皆大于95.0%。Li等[23]分别采用8种胆碱离子液体与PPG 400构建双水相体系,不同离子液体形成双水相体系的能力如下:[Ch][Cit]>[Ch][Oxa]>[Ch][Glyco]>[Ch][Pro]≈[Ch][Lac]≈[Ch][Ac]>[Ch][For]>[Ch][But]。将该类双水相体系用于水中溶菌酶、木瓜蛋白酶、胰蛋白酶及BSA的萃取分离,4种待测组分的分配系数如下:溶菌酶>木瓜蛋白酶>胰蛋白酶>BSA,该类双水相体系对几种待测组分均具有较高的萃取效率,在优化条件下的萃取率可达86.4%~99.9%。
Ruiz等[40]采用[Ch][DHPh]与PEG 400构建双水相体系萃取分离微藻中的核酮糖-1,5-二磷酸羧化酶(Rubisco),Rubisco由于其疏水性主要富集于聚合物相,分配系数为2.6~3.6,而亲水的其它蛋白质富集于离子液体相。因此,采用该体系可有效地排除其它亲水性蛋白质对Rubisco萃取的干扰,待测蛋白质的萃取回收率为72.1%~79.6%。
Mondal等[25]采用4种胆碱类离子液体([Ch][Pyr]、[Ch][Asc]、[Ch][Qui]、[Ch][Glyco])与PPG 400建立双水相体系萃取分离小鼠血浆中的免疫球蛋白(IgG)。不同离子液体的相分离能力如下:[Ch][Qui]>[Ch][Glyco]>[Ch][Pyr]>[Ch][Asc],采用该4种体系萃取分离IgG,待测蛋白质的萃取率可达45.1%~85.4%。Wolf-Márquez等[41]采用[Ch]Cl与非离子表面活性剂Tergitol NP-10(壬基酚聚氧乙烯醚)构建双水相体系,用于萃取分离黄柄曲霉(Aspergillusflavipes)发酵液中的果胶酶,萃取效率可大于90.0%。
Wei等[42]分别采用[Cnmim]Br(n=3,4,6)和[Cnmim]BF4(n=2,3,4,6)与阳离子表面活性剂3-对位-壬基苯氧基-2-羟基丙基三甲基溴化铵(NPTAB)构建双水相体系,采用所建立的不同体系对水中L-色氨酸及亚甲基蓝等组分进行萃取分离,L-色氨酸主要富集于表面活性剂相,而亚甲基蓝主要富集于离子液体相,因此,采用该萃取体系可以将两种组分分离,但两种组分的萃取回收率仅为50.0%~70.0%。
2.2 有机化合物的萃取分离


表3 基于离子液体的双水相体系在有机化合物萃取分离中的应用Table 3 The application of aqueous biphasic systems based on ionic liquids on the extraction of organic compounds
a.ionic liquids can be found in Table 1,b.designates a value not reported in the reference
离子液体-盐的双水相体系也被广泛应用于天然药物活性成分的萃取分离,Tan等[52]采用[C4mim]Br与Na2CO3等无机盐构建双水相体系萃取分离金银花中的咖啡酰奎宁酸类化合物,Li等[53]采用[C4mim]Br与K2HPO4/十二烷基硫酸钠(SDS)的混合液构建双水相体系萃取分离血塞通注射液中的皂苷类化合物,待测组分的萃取回收率皆大于90.0%。Fan等[54]分别采用3种咪唑类离子液体:[C4mim]Br、[C4mim]OH及[C2OHmim]BF4与K2HPO4等无机盐构建双水相体系,并用于萃取分离葛根提取液中的葛根素,待测组分在不同体系中的萃取效率有较大差异,萃取回收率为89.0%~99.6%。Bogdanov等[55]采用[Ch][Sac]和Na2CO3构建双水相体系萃取分离人尿液中的生物碱类化合物,萃取回收率可达101%~102%。Pourebrahimi等[56]采用[Ch]Cl和K3PO4构建的双水相体系萃取分离水中的香兰素成分,待测组分的分配系数为3.2~12.6,萃取回收率为71.9%~94.0%。
[C4mim]Br与K2HPO4构建的双水相体系被用于萃取分离饮料及糖果中的柠檬黄和日落黄等色素组分[57],柠檬黄与日落黄的萃取回收率皆大于93.5%。Ventura等[58]采用季铵离子液体[N2222]Br和柠檬酸缓冲液建立双水相体系,该体系可有效萃取紫青霉发酵液中的红色着色剂,待测组分主要富集于离子液体相,分配系数最高可达24.4,萃取回收率为96.6%。
Santos等[59]比较了不同类型离子液体与柠檬酸钾/柠檬酸的缓冲溶液形成双水相体系的能力,发现不同离子液体的相分离能力如下:[C4mim]Cl<[C4mpyrr]Cl<[C4mpyr]Cl<[C4mpip]Cl ≪[N4444]Cl<[P4444]Cl,采用所建立的双水相体系萃取分离水中的丁香酚和没食子酸丙酯等抗氧化物,待测组分主要富集于离子液体相,其萃取回收率可达75.9%~100%。
虽然离子液体与无机盐形成的双水相体系的粘度小,更易于两相分离及样品萃取。但是,离子液体只能与弱碱性及强碱性的无机盐水溶液形成双水相体系,体系的两相溶液皆为碱性溶液,不适于在碱性条件下不稳定的有机化合物的提取分离,所以离子液体-盐形成的双水相体系在实际应用中受到了一定限制。
2.2.2 离子液体-聚合物的双水相体系的应用与离子液体-无机盐形成的双水相体系相比,离子液体-聚合物的双水相体系在有机污染物萃取中具有极大的优势,如所形成的双水相体系的两相皆为中性或弱碱性溶液,对碱性条件下不稳定的有机化合物也能提供友好的萃取环境,因而,采用该体系萃取有机化合物也受到广泛关注。
Gong等[60]以[C6mim]Br和SDS构建的双水相体系萃取分离人血浆或度他雄胺胶囊中的度他雄胺,该体系简单快速,对待测组分具有很高的萃取效率(96.7%~108%)。Yang等[61]以[C8mim]Br和SDS建立双水相体系萃取分离蜂蜜中的土霉素、四环素及氯霉素等抗生素,该体系可高效快速地萃取几种待测组分(85.5%~111%)。
Tian等[12]采用[Ch][Ac]和EOPO 2500(分子量为2 500)建立的双水相体系可以有效地萃取水中阿特拉津、西玛津及氰草津等除草剂残留,待测组分主要富集于聚合物相,分配系数可达25~60。采用优化后的体系萃取分离待测组分,其回收率在81.0%~92.0%之间,满足农药残留分析要求。Tian等[11]将上述体系应用于阿特拉津、西草净及扑草净等除草剂残留的萃取分离,待测组分的定量限为0.1~1.5 μg/kg,萃取回收率可达81.0%~108%。Tian等[13]还采用[Ch][Ac]与非离子表面活性剂Triton x-100构建了双水相体系,阿特拉津、西草净及扑草净等除草剂可在该体系中达到有效分离,待测组分主要富集于表面活性剂相,分配系数可达11~295,因此,该体系比[Ch][Ac]-EOPO 2500体系对待测组分的萃取效率更高。
3 结论及展望
基于离子液体的双水相体系由于具有低粘度、低毒性、生物兼容性好、萃取快速及操作简单等独特优势,在样品分离纯化方面展现出很好的应用前景。而且该体系可以完全不使用有机溶剂,通过调节离子液体结构即可使不同组分达到满意的萃取效率。尽管存在上述优点,该体系在应用方面仍存在一定的限制,如离子液体渗透性较低,无法萃取分离固体样品。另外,离子液体并不完全是真正意义上的“绿色溶剂”,如咪唑类离子液体就已经被报道有一定的环境毒性[62]。因此,在未来研究中还有许多工作有待完成:如建立离子液体的回收及再利用方法以便降低萃取成本,如可通过蒸馏去除其中萃取的有机成分;离子液体不易挥发与萃取成分分开,可通过采用离子交换树脂去除无机盐,再通过冷冻干燥法除去水分的方式回收离子液体。另一个方面是研究渗透性高、环境友好及相分离能力强的新型离子液体,如目前比较受关注的胆碱类离子液体、胍类离子液体及具有离子液体性质的共晶溶剂等,皆具有低毒、低成本及渗透性高等优点,从而可确保双水相体系的环境安全性及萃取高效性。
