LncRNA-ROR抑制结直肠癌细胞转移的作用研究
2020-06-28胡世丰
胡世丰,雷 春,施 炜,查 诚
结直肠癌是消化系统最常见的恶性肿瘤之一,随着国人生活习惯的改变,结直肠癌的发病率呈逐年增高趋势[1-3]。目前,结直肠癌的治疗以手术为主,辅以化疗、放疗、免疫治疗等综合治疗,尽管取得很好的效果,仍然有相当一部分病人出现转移。临床上亟需了解结直肠癌转移的分子机制,以期提高早期诊断率和病人的生存率[4-6]。
长链非编码RNA(long chain noncoding RNA,Lnc RNA)是一类长度>200个核苷酸的非编码RNA[7]。研究[8]表明,LncRNA在表观遗传、转录、转录后等多个层面调控基因的表达。在肿瘤发生中,LncRNA在多层面尤其在转录调控方面影响细胞的正常功能,引起细胞的增殖、转移、分化异常[9]。LncRNA在癌基因的调控方面发挥重要作用,其表达的失控可引起肿瘤的增殖、侵袭、凋亡异常[10]。LOEWER等[11]在2010年报道了一种能调节已经分化的细胞转换为多能诱导干细胞重编程过程的LncRNA,并将这该RNA命名为LncRNA-ROR(regulator of reprogramming,ROR),以下简称为ROR。ROR不仅能调控细胞的重编程过程,其在多种肿瘤细胞的增殖、侵袭、迁移、凋亡中发挥重要作用并与病人预后密切相关[12-13]。但是LncRNA-ROR在结直肠癌转移中的作用尚欠充分研究。在前期发表的研究中,我们发现ROR在癌组织中的表达相比于癌旁组织有明显降低,临床病理资料显示ROR的表达与病人的TNM分期有关,qRT-PCR检测证实SW620中的ROR表达增加,其高表达导致SW620增殖能力的下降。为了进一步了解ROR在结直肠癌中的作用,我们采用侵袭、迁移、划痕实验研究ROR在结直肠癌细胞迁移中的作用。现作报道。
1 材料与方法
1.1 细胞培养及转染、计数 结直肠癌细胞SW620用含10%FBS的1640培养基,置于5% CO2、37 ℃培养箱中常规传代培养,选对数生长期的细胞,将合成的含ROR的慢病毒滴入培养液中,24 h后换液,qRT-PCR检测转染效果,获得稳转细胞株后行后续实验。稳转细胞SW620/Vector、SW620/ROR用含10%FBS 的1640 培养基,置于5% CO2、37 ℃培养箱中常规传代培养。用无血清培养液把细胞悬浮并稀释至10 mL左右,取1 mL 的细胞悬液加入1 mL 的0.4%的台盼蓝染液。混匀后滴入血球计数板上,计数。
1.2 迁移实验 取对数生长期的细胞,吸去培养液后无血清培养液饥饿处理8 h。用胰酶消化细胞后,将细胞浓度调整成1×105/mL,在小室的下室加入500 μL含10%血清的培养液,上室加入200 μL细胞悬液。置入37 ℃、5% CO2培养箱中培养。48 h后,用镊子取出小室,吸去上室中培养液,用棉棒擦拭小室的上室内面后将上室放入用甲醇配置的0.1%结晶紫染液固定、染色30 min。PBS液漂洗两次后在倒置显微镜下观察、拍照、计数。
1.3 侵袭实验 取对数生长期的细胞无血清培养液饥饿处理8 h。Matrigel胶放到4 ℃冰箱中过夜,在冰上将无血清培养液与Matrigel胶按5∶1比例混合,取24孔板,每孔加入50 μL稀释后的Matrigel胶,37 ℃培养箱重放置30 min。将细胞浓度调整成1×105/mL,在小室的下室加入500 μL含10%血清的培养液,上室加入200 μL细胞悬液。置入37 ℃、5% CO2培养箱中培养。48 h后,用镊子取出小室,擦拭小室的上室内面后将上室放入用甲醇配置的0.1%结晶紫染液固定、染色30 min。PBS液漂洗后在倒置显微镜下观察、拍照、计数。
1.4 划痕实验 取对数生长期结直肠癌细胞,PBS缓冲液漂洗两次后,胰酶消化,吸去胰酶后用含10%血清的培养液悬浮细胞,将悬浮细胞按5×105/孔接种于6孔板中,对照组和实验组均设3个复孔。次日将细胞换液,20 μL的黄枪头及尺子进行高于蒸汽灭菌处理。待细胞长满时用黄枪头进行划痕,用PBS缓冲液漂洗细胞3次洗去划下的细胞,加入无血清培养液。拍照后置于37 ℃、5% CO2培养箱中培养。48 h用PBS缓冲液漂洗细胞3次,去除漂起来的细胞,加入无血清培养液。倒置显微镜下拍照。
1.5 统计学方法 采用t检验。
2 结果
2.1 ROR导致结直肠癌细胞的迁移及侵袭能力降低 SW620细胞在ROR过表达后,穿过人工膜的细胞数减少(P<0.01);Transwell侵袭实验结果表明过表达ROR 后,结直肠癌细胞的侵袭能力减弱(P<0.01)(见表1、图1)。
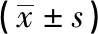
表1 2组结直肠癌细胞的迁移及侵袭能力比较
2.2 ROR抑制结直肠癌细胞的划痕愈合 在同样的初始划痕距离下,经过48 h的培养后,相比于空载体对照组,ROR过表达SW620细胞间间距较大(P<0.01)(见表2、图2)。
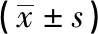
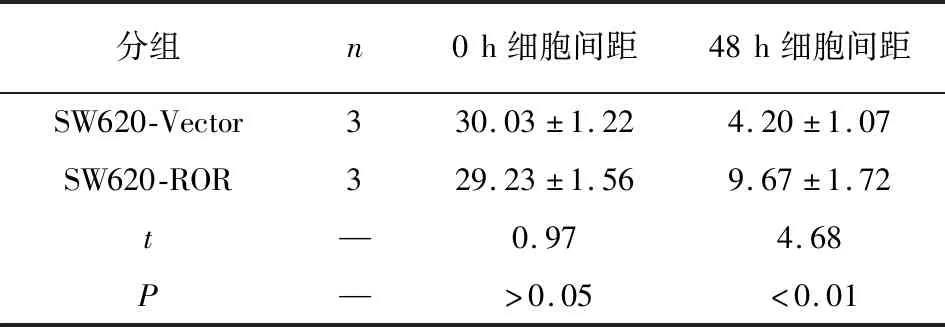
分组n0h细胞间距48h细胞间距SW620-Vector330.03±1.224.20±1.07SW620-ROR329.23±1.569.67±1.72t—0.974.68P—>0.05<0.01
3 讨论
高通量测序技术证明人类基因组有约98%为非编码基因,LncRNA占其中的80%[14]。LncRNA期初被当作转录噪声而未被重视,但越来越多的研究表明LncRNA在多个肿瘤中发挥重要作用。SUN等[15]发现MEG3调控胃癌的增殖和凋亡,在胃癌中提示预后不良的指标。LIU等[16]发现lncRNA-LET在肺癌中通过抑制EMT和Wnt/β-catenin抑制肺癌的进展。在非小细胞肺癌中,SNHG1表达增高,在非小细胞肺癌中干扰SNHG1表达后细胞增殖受抑制[17]。ROR是新近发现的参与肿瘤发生、发展多个过程的LncRNA。FAN等[18]研究发现ROR通过阻碍组蛋白G9A甲基转移酶、促进组蛋白H3K9甲基化的释放,从而激活TESC启动子。沉默ROR后,通过G9A甲基转移酶介导的H3K9甲基化引起的TESC启动子的表达被抑制,进而显著抑制肿瘤细胞增殖和转移。进一步研究表明,在不沉默ROR的情况下,沉默TESC启动子引起肿瘤增殖、转移方面类似的现象。从而证实,ROR作为一个诱饵RNA通过抑制组蛋白修饰酶的结合促进肿瘤的发生发展。ZHAN等[19]研究表明ROR通过调控ZEB1来促进胰腺癌的侵袭、转移。LI等[20]ROR与鼻咽癌的增殖、转移、凋亡、耐药均有关。我们的前期研究已经发现,结直肠癌中ROR的表达明显低于周围正常组织,其表达与病人的TNM分期有关,但关于ROR在结直肠癌转移中的作用尚缺乏深入的研究。
细胞的迁移实验是模拟肿瘤转移的理想体外模型,迁移实验通过Transwell小室将肿瘤细胞隔离在无血清培养液中,肿瘤细胞为了获取有血清的培养液,必须爬行穿过小室的孔隙,我们通过技术穿过孔隙的细胞数来评估细胞的迁移能力。细胞的侵袭实验除了常规的迁移实验外,我们在Transwell的上室中加入了Matregel胶,肿瘤细胞为了到达有血清的下室,除了穿过小室的孔隙,还需要穿过Matregel胶,结合迁移实验,可以更加完整的模拟肿瘤体内转移途径。我们的研究发现ROR过表达的SW620细胞不论在迁移还是在侵袭实验中,均表现出较低的迁移、侵袭能力。细胞划痕是模拟细胞爬行愈合能力的一个重要实验,通过对贴壁细胞划痕后观察细胞爬行愈合能力来评估细胞的转移能力。我们在划痕实验中发现,ROR过表达的SW620细胞及对照组细胞在初始划痕时间距无明显差异,经过48 h的培养液后,SW620/ROR组细胞的间距明显宽于对照组,说明ROR的过表达导致SW620细胞的爬行愈合能力下降。综上所述,SW620细胞中过表达ROR导致SW620细胞的迁移、侵袭、划痕愈合能力下降,表明ROR的过表达可导致结直肠SW620细胞转移能力下降,ROR作为潜在的抑癌基因,其作用机制值得进一步研究。
