平喘汤对哮喘小鼠模型NLRP3炎症小体活化的影响
2020-06-24昝杰彧孙剑玥徐亚娜付艳缇解玉
昝杰彧 孙剑玥 徐亚娜 付艳缇 解玉

摘要 目的:探究平喘湯对小鼠支气管气道炎性反应的抑制作用,及其作用机制是否与NLRP3炎症小体活化的调控相关。方法:将6~8周龄C57BL/6雄性小鼠38只随机分为空白对照组、哮喘模型组、低剂量平喘汤组(15 g/kg)、中等剂量平喘汤组(30 g/kg)、高剂量平喘汤组(60 g/kg)及阳性药物(地塞米松)对照组。采用腹腔注射及滴鼻吸入卵蛋白致敏法制备小鼠支气管哮喘模型。除阳性对照组予地塞米松腹腔给药外,余各组均予对应药物灌胃,连续4周。末次给药后,观察小鼠一般情况,行为学评分(打喷嚏、抓鼻次数,呼吸急促程度),小鼠肺泡灌洗液中细胞总数、中性粒细胞、嗜酸性粒细胞、淋巴细胞及巨噬细胞计数,肺泡灌洗液炎性反应因子IL-1β、IL-6、TNF-α及MCP-1表达,肺组织NLRP3炎症小体及其下游靶向炎性反应因子IL-1β及IL-18表达情况。结果:平喘汤可有效减少哮喘小鼠行为学评分,降低肺泡灌洗液细胞总数、中性粒细胞、嗜酸性细胞、淋巴细胞及巨噬细胞计数,下调肺泡灌洗液炎性反应因子IL-1β、IL-6、TNF-α及MCP-1表达,抑制肺组织NLRP3炎症小体、IL-1β及IL-18 mRNA和蛋白表达情况。结论:平喘汤可通过抑制NLRP3炎症小体活化介导的气道炎性反应进而减轻哮喘呼吸道症状。
关键词 平喘汤;哮喘;气道炎性反应;NLRP3炎症小体;IL-1β;IL-18
Effects of Pingchuan Decoction on NLRP3 Inflammasome Activation Induced by Asthma in Mice
ZAN Jieyu,SUN Jianyue,XU Yana,FU Yanti,XIE Yu
(Department of Pediatrics,Putuo Hospital,Shanghai University of Traditional Chinese Medicine,Shanghai 200062,China)
Abstract Objective:To explore the inhibitory effect of Pingchuan Decoction on bronchial airway inflammation in mice,and whether its mechanism is related to the regulation of NLRP3 inflammasome activation.Methods:A total of 38 C57BL/6 male mice aged 6-8 weeks were randomly divided into a blank control group,an asthma model group,a low-dose Pingchuan Decoction group(15 g/kg),and a medium-dose Pingchuan Decoction group(30 g/kg),a high-dose Pingchuan Decoction group(60 g/kg)and a positive drug(dexamethasone)and a control group.A mouse bronchial asthma model was prepared by intraperitoneal injection and intranasal inhalation of egg protein sensitization method.Except for the positive control group who was given dexamethasone intraperitoneally,the other groups were given the corresponding drugs by gavage for 4 consecutive weeks.After the last administration,the general condition of the mice,behavioral scores(number of sneezing,scratching,and degree of shortness of breath),the total number of cells in the mouse alveolar lavage fluid,neutrophils,eosinophils,lymphocytes and Macrophage count,expression of inflammatory factors IL-1β,IL-6,TNF-α and MCP-1 in alveolar lavage fluid,expression of NLRP3 inflammasome and its downstream target inflammatory factors IL-1β and IL-18 in lung tissue were observed.Results:Pingchuan Decoction can effectively reduce the behavioral scores of asthmatic mice,reduce the total number of alveolar lavage fluid cells,neutrophils,eosinophils,lymphocytes and macrophages,and down-regulate the inflammatory factors IL-1β and IL in the alveolar lavage fluid-6,TNF-α and MCP-1 expression,inhibit the expression of NLRP3 inflammasome,IL-1β and IL-18 mRNA and protein in lung tissue.Conclusion:Pingchuan Decoction can reduce the respiratory tract symptoms of asthma by inhibiting the airway inflammation mediated by the activation of NLRP3 inflammasomes.
Keywords Pingchuan Decoction; Asthma; Airway inflammation; NLRP3 inflammasome; IL-1β; IL-18
中图分类号:R242;R285.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2020.23.018
近10年来由于环境及人类生活方式的巨大改变,儿童支气管哮喘(简称哮喘)发病率呈逐年上升趋势。研究报道,我国城市儿童哮喘的发病率达3%,个别地区甚而高达4.2%[1]。因此,哮喘已经成为我国威胁儿童健康的严重社会和公共卫生问题。目前,尽管哮喘的发病机制尚未阐明清楚,但研究表明多种炎性反应细胞参与的气道慢性炎症在哮喘的发生、发展过程中起着核心作用,可导致气道黏膜损伤、气道高反应性及气道重塑[2]。值得注意的是,随着近年来对炎性反应机制研究的不断深入,现已明确炎症小体在启动细胞炎症级联反应和活化各种炎性反应因子中起着至关重要作用[3]。炎性小体由Tschopp教授于2002年首次发现,指含有NOD样受体家族成员蛋白如NLRP1、NLRP3、NLRC4和AIM2等形成的蛋白复合体[3]。其中,NLRP3炎症小体研究最为广泛,其由NLRP3、ASC和pro-caspase-1组成的蛋白复合体,其激活后可通过活化caspase-1进而剪切加工IL-1β和IL-18前体,生成IL-1β和IL-18成熟体,发挥致炎作用[4]。新近研究发现,NLRP3炎症小体在儿童哮喘中发挥重要作用[5]。平喘汤是邵氏肺科传人夏以琳教授在张仲景的“三拗汤”的基础上拟定而成,配合宣肺、平喘等药物加减而成。已有临床研究表明,平喘汤对患儿哮喘有显著疗效[6-8],但目前报道多基于其疗效观察,其作用机制尚不清楚;且各研究报道中平喘汤配方成分及比例不同,疗效亦存在差异。本文拟通过构建OVA小鼠哮喘模型,观察本院自拟平喘汤对哮喘小鼠NLRP3炎症小体及其介导的气道炎症级联反应的抑制作用,并在此基础上深入探讨该药的分子作用机制。
1 材料与方法
1.1 材料
1.1.1 动物 SPF级6~8周龄健康C57BL/6雄性小鼠,体质量20~24 g,购于上海斯莱克实验动物有限责任公司。小鼠饲养于本院动物房,饲养环境:温度(23±2)℃,湿度40%~70%,12 h/12 h昼夜交替。本研究中对小鼠采取的所有实验操作皆严格遵循上海中医药大学动物伦理委员会制定的准则下进行。实验小鼠自购入起,适应性饲养1周之后用于实验。
1.1.2 药物 本院自拟平喘汤每剂由炙麻黄5 g、杏仁6 g、生甘草6 g、黄芩6 g、蝉蜕6 g、地龙6 g、辛夷6 g、射干6 g、苏梗9 g、桃仁6 g、柴胡6 g、鱼腥草9 g组成。药物均由上海中医药大学附属普陀医院中药房提供,口服液由上海中医药大学化学教研室制剂,药物浓度为2 g(生药)/mL,密封后储存于4 ℃冰箱备用。地塞米松注射液(山东鲁抗辰欣药业有限公司,国药准字H37021967)。
1.1.3 试剂与仪器 卵蛋白(Sigma-Aldrich公司,美国,批号:A5503-1G);IL-1β ELISA试剂盒(R&D systems公司,美国,货号:SLB50);IL-6 ELISA试剂盒(R&D systems公司,美国,货号:SM6000B);TNF-α ELISA试剂盒(R&D systems公司,美国,货号:PDTA00D);MCP-1 ELISA试剂盒(R&D systems公司,美国,货号:DY479-05);IL-18 ELISA试剂盒(MBL公司,日本,货号:7625);NLRP3一抗抗体(Abcam公司,美国,货号:ab4207);ASC一抗抗体(Cell signaling Technology公司,美国,货号:67824);caspase-1一抗抗体(美国Abcam公司,货号:ab2012);β-actin一抗抗体(美国Abcam公司,货号:ab227387);羊抗兔二抗抗体(杭州华安生物公司,货号:HA1014);羊抗鼠二抗抗体(杭州华安生物公司,货号:HA1015);多功能酶标仪(BioTek公司,美国,型号:SynergyHTX/2型);成像分析系统(Bio-Rad公司,美国,型号:Gel Doc EZ型);PCR扩增仪(Bio-Rad公司,美国,型号:Thermal Cycler S1000TM型);荧光定量PCR仪(ABI公司,美国,型号:7900HT型);倒置显微镜(Leica公司,德国,型号:DMi8型)。
1.2 方法
1.2.1 分组与模型制备 将38只小鼠随机分成6组:1)空白对照组(n=6);2)哮喘模型组(n=8);3)低剂量给药组(平喘汤,15 g/kg,n=6);4)中等剂量给药组(平喘汤,30 g/kg,n=6);5)高剂量给药组(平喘汤,60 g/kg,n=6);6)阳性对照组(地塞米松,1 mg/kg,n=6)。参考文献方法[9],将小鼠在第1、15天腹腔注射OVA混悬液0.2 mL致敏,第15天经鼻腔滴注濃度为2 mg/mL OVA 50 μL激发,第26、27及28天鼻腔内滴注1 mg/mL OVA 50 μL再次激发。空白组以等量生理盐水替代。
1.2.2 给药方法 各组皆从鼻腔滴注激发阶段第1天起每天给药,其中空白组及哮喘模型组予等剂量生理盐水灌胃。各组灌胃或腹腔注射均在激发前1 h进行。末次给药24 h后测定相关指标。给药剂量参照实验动物和人临床用药剂量换算公式:dB=dA*RB/RAx3√WA3√WB[10]。
1.2.3 检测指标与方法 行为学评分:参考文献[11],自OVA末次鼻腔滴注激发后观察20 min,记分法记录各组小鼠打喷嚏、抓鼻次数及哮喘呼吸严重程度。记分方法如下:无喷嚏为0分,<4个为1分,4~10个为2分,>11个为3分;无抓鼻为0分,轻度抓鼻为1分,频繁抓鼻为2分,抓鼻不止为3分;无喘息为0分,呼吸急促为1分,明显喘息为2分,喘息致死为3分。
标本收集:腹腔注射10%水合氯醛麻醉小鼠,仰卧位固定,75%乙醇消毒小鼠颈、胸部,剪刀打开小鼠胸腔及游离颈部气管后,丝线结扎右主支气管,注射器注入0.6 mL预冷PBS溶液灌洗支气管肺泡共3次,4 ℃下以3 000 r/min转速离心15 min,离心半径9.9 cm,取上清为BALF,细胞沉渣用于细胞涂片。取左肺,置于4%多聚甲醛内固定保存。取右肺,置于-80 ℃保存。
BALF中细胞计数:BALF离心后细胞沉渣用0.2 mLPBS重悬制备细胞涂片,经Diff-Quick染色法,在光学显微镜下进行各种类型细胞计数。
BALF中IL-1β、IL-6、TNF-α及MCP-1含量:依据ELISA试剂盒说明书步骤,用酶标仪检测BALF的OD450 nm值,并绘制标准曲线,计算IL-1β、IL-6、TNF-α及MCP-1浓度。
RT-PCR检测:采用Trizol试剂提取肺组织总RNA,使用酶标仪测定总RNA浓度,去除肺组织样本中基因组DNA后逆转录以合成cDNA。引物设计见表1。微量分光光度计测量cDNA纯度及浓度后,ABI 7500型荧光定量PCR仪检测待测基因及内参β-actin扩增各循环荧光信号,计算其△Ct值及相对于空白组的相对值。
Western Blot检测:采用蛋白裂解液提取小鼠右肺组织总蛋白,BCA试剂盒检测蛋白浓度。取20 μg组织蛋白依次行电泳,转膜,封闭,接着分别加入NLRP3(1∶1 000)、ASC(1∶500)、caspase-1(1∶1 000)及内参β-actin(1∶5 000)一抗4 ℃过夜。常规洗膜后加入相应二抗(1∶5 000)室温下孵育。TBST洗膜三次后使用ECL免疫印迹化学发光底物暗室中显影。利用美国Quantility One软件半定量分析蛋白含量。
免疫组化检测:取4%多聚甲醛固定的左肺依次进行脱水、浸蜡、包埋、切片,将切片置于60 ℃烤箱内熔蜡后,行脱蜡、脱水、抗原修复步骤,接着分别加入NLRP3(1∶500)、ASC(1∶200)及caspase-1(1∶200)一抗和对应二抗孵育。采用DAB染色及苏木精复染后,常规脱水、封片并在光学显微镜下观察。免疫组化结果评分标准参考文献[12]:0分:无阳性染色;1分:低密度阳性染色;2分:中等密度阳性染色;3分:高密度阳性染色;4分:超高密度阳性染色。
1.3 统计学方法 采用SPSS 20.0统计软件进行数据分析,其中计数资料以(%)表示,采用χ2检验,计量资料以(±s)表示,采用t检验,以P<0.05为差异有统计学意义。
2 结果
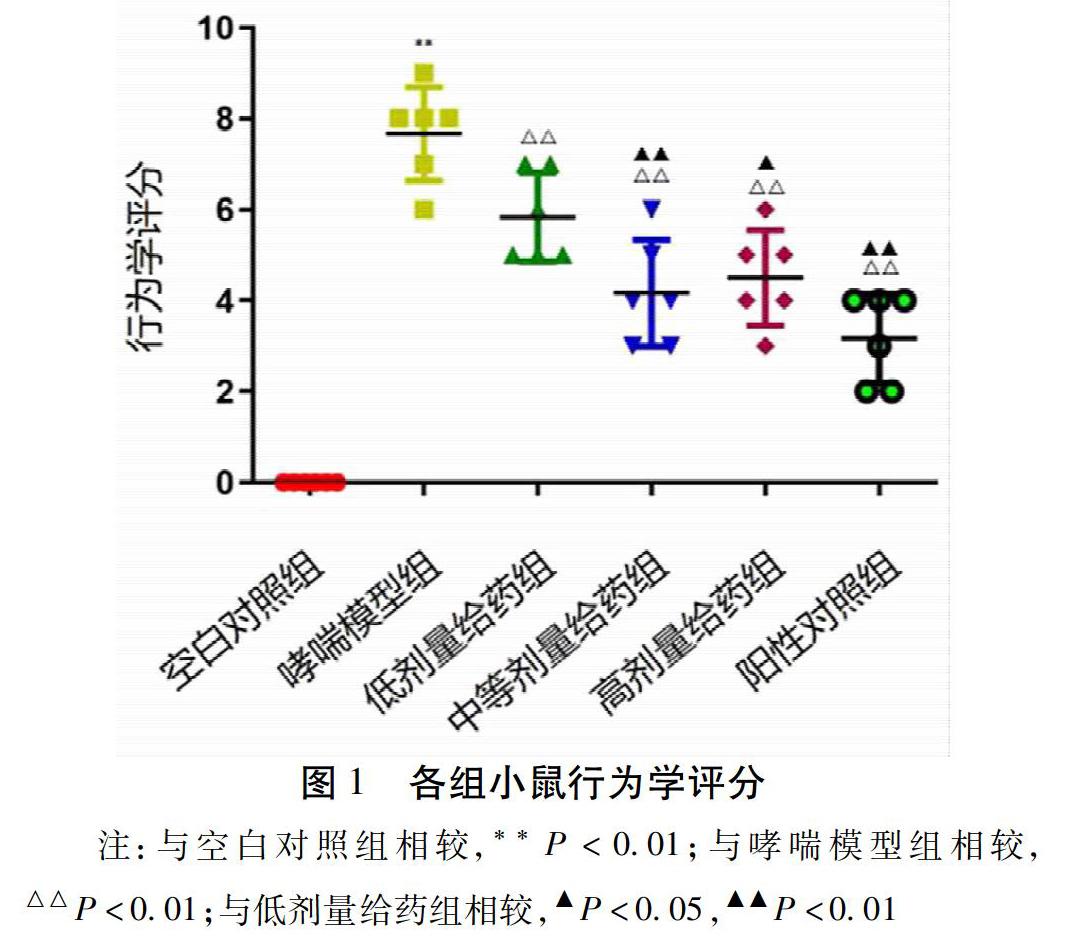
2.1 小鼠行为学改变 空白组小鼠一般情况可,精神状态良好,无明显异常。模型组小鼠皆出现不同程度烦躁不安,易惊,部分出现腹式呼吸、大小便失禁,打喷嚏、抓鼻次数增加,呼吸急促程度加深,相较于空白组行为学评分比较差异有统计学意义(P<0.01)。不同剂量给药组及阳性对照组小鼠行为学评分相较于模型组皆明显下降(P<0.01)。中等剂量及高剂量给药组小鼠行为学评分相较于低剂量给药组小鼠显著降低(P<0.05),但此两者间比较差异无统计学意义(P>0.05)。见图1。
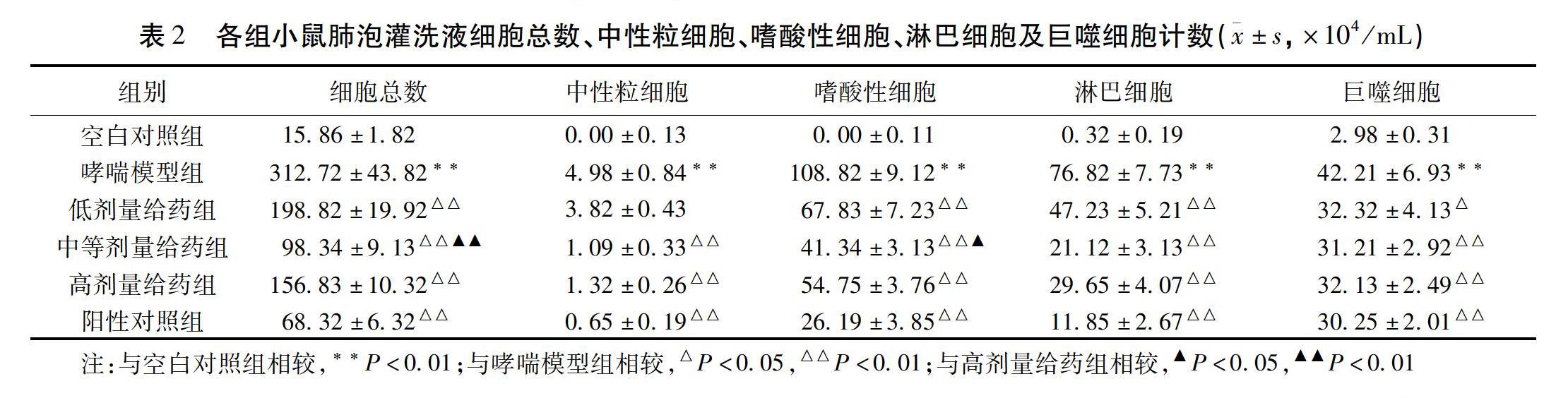
2.2 肺泡灌洗液细胞分类计数 各组小鼠肺泡灌洗液细胞分类计数结果发现,模型组小鼠细胞总数、中性粒細胞、嗜酸性细胞、淋巴细胞及巨噬细胞计数较空白组小鼠显著升高(P<0.01)。与模型组小鼠比较,除低剂量组小鼠中性粒细胞计数比较差异无统计学意义外,余各观察组小鼠细胞总数、中性粒细胞、嗜酸性细胞、淋巴细胞及巨噬细胞计数均显著降低(P<0.05)。中等剂量组小鼠细胞总数及嗜酸性细胞计数较高剂量组小鼠降低,且存在统计学意义(P<0.05)。见表2。基于以上实验结果,中等剂量平喘汤将被用于后续药物炎性反应抑制的机制研究。
2.3 肺泡灌洗液炎性反应因子表达 模型组小鼠肺泡灌洗液IL-1β、IL-6、TNF-α及MCP-1含量较空白组小鼠显著升高(P<0.01)。与模型组小鼠比较,给药组及阳性对照组小鼠IL-1β、IL-6、TNF-α及MCP-1含量明显下降(P<0.05)。见图2。
2.4 肺组织NLRP3炎症小体表达 与空白组比较,模型组小鼠肺组织NLRP3、ASC、pro-caspase-1及caspase-1 mRNA及蛋白表达水平升高(P<0.01)。见图3A。给予平喘汤或地塞米松后,NLRP3、ASC、pro-caspase-1及caspase-1 mRNA及蛋白表达水平显著下降(P<0.05)。见图3B。免疫组化染色结果进一步表明,平喘汤可降低哮喘小鼠NLRP3、ASC及caspase-1表达水平(P<0.01)。见图4。
2.5 肺组织IL-1β及IL-18表达 模型组小鼠肺组织NLRP3炎症小体下游活性炎性反应因子IL-1β及IL-18 mRNA较空白组小鼠明显上升(P<0.01)。与模型组小鼠比较,给药组及阳性对照组小鼠IL-1β及IL-18蛋白表达显著下降(P<0.05)。见图5。
3 讨论
气道慢性炎症是哮喘的重要特征,包括多种炎性细胞参与,如中性粒细胞、淋巴细胞、嗜酸性粒细胞和巨噬细胞等,这些炎性细胞可产生及活化各种炎性反应因子,如IL-1β、IL-6、IL-18、IFN-β、TNF-α和嗜酸性细胞趋化因子等,进而发挥促炎效果。本研究通过构建OVA致敏小鼠模型,首次证实我院自拟平喘汤对哮喘的治疗作用;进一步分子机制研究发现,NLRP3炎症小体介导的气道炎性反应在平喘汤发挥哮喘治疗作用中有着重要作用。
目前,临床上针对患儿哮喘常用的抗炎药,如糖皮质激素、白三烯受体拮抗药等,虽能短期内控制气道炎性反应,缓解症状,但长期用药可导致免疫功能低下、骨质疏松等不良反应[13]。因此,临床急需寻找安全、有效、经济且不良反应小的哮喘治疗药物方案。中医药大多为天然植物,其相对价廉,不良反应小,可作为理想选择。本院自拟平喘汤是邵氏肺科传人夏以琳教授在张仲景的“三拗汤”的基础上拟定而成,以炙麻黄、蝉蜕宣肺解痉平喘;杏仁、地龙宣降肺气、解痉止咳平喘;黄芩清热润肺;辛夷祛风通窍;射干、苏梗温肺下气、化痰止咳等,调和诸药。具有宣降肺气,理气祛痰,止咳平喘之功效。前期研究发现,平喘汤可降低哮喘患儿及动物模型炎性反应因子IL-17、IL-33及TNF-α表达水平,减轻气道炎性反应症状[14]。本研究通过动物实验进一步发现,平喘汤可有效降低哮喘后细胞总数计数,抑制中性粒细胞、嗜酸性细胞、淋巴细胞及巨噬细胞聚集,下调BALF中炎性反应因子IL-1β、IL-6、TNF-α、MCP-1及IL-18表达。结合前期研究,这些结果提示平喘汤可以通过抑制炎性反应,缓解哮喘症状。本实验结果同时指出平喘汤能够有效降低哮喘小鼠行为学评分,减少打喷嚏、抓鼻次数,缓解呼吸急促程度,提示平喘汤可显著改善哮喘临床症状,提高患儿生命质量[15]。
前期研究报道,NLRP3炎症小体作为固有免疫及适应性免疫系统中的重要成分,在哮喘气道慢性炎症的发生和发展中发挥着至关重要的作用,其可从上游触发及调节气道炎性反应,参与气道高反应性和重塑过程[16-17]。NLRP3炎症小体由NLRP3、接头蛋白ASC和caspase-1组成,当细胞受到各种有害刺激后,一方面,NLRP3通过与ASC相互作用,激活核因子-κB(NF-κB),促进炎性反应因子前体(pro-IL-1β、pro-IL-18)或炎性反应因子(如IL-6、TNF-α、MCP-1等)表达。另一方面,NLRP3与ASC结合后能够招募pro-caspase-1即caspase-1前体,形成蛋白复合体,生成具有生物学活性的成熟体caspase-1,后者可剪切炎性反應因子前体pro-IL-1β及pro-IL-18,使其活化为具有促炎活性的成熟体炎性反应因子IL-1β及IL-18。由此可见,NLRP3炎症小体的活化是启动炎症级联反应和造成炎性反应损伤的核心环节。IL-1β是一种促进和放大炎性反应的细胞因子,能够招募淋巴细胞、中性粒细胞及巨噬细胞等免疫细胞聚集,刺激嗜酸性粒细胞活化,诱导NF-κB炎性通路激活,促进IL-6、TNF-α及MCP-1生成,进而加剧气道慢性炎症[18]。IL-18能够调节Th1/Tc1极化,且可通过T细胞促进Th2细胞炎性反应因子,如IL-4、IL-5、IL-9和IL-13等释放,从而加剧肺部局部炎性反应,造成气道高反应性[19]。Li R等[20]研究发现,哮喘后NLRP3炎症小体活化,其介导生成的IL-1β和IL-18可明显触发气道炎性反应,其表达与哮喘严重程度密切相关。相反,抑制哮喘后NLRP3炎症小体活化能够有效减轻哮喘严重程度,减轻气道炎性反应,降低气道高反应性[5,21]。本研究亦发现NLRP3炎症小体在哮喘肺组织中激活,其可有效触发局部炎性反应,加剧哮喘严重程度;但给予本院自拟平喘汤治疗后,肺组织NLRP3炎症小体表达及活性受到明显抑制,其所介导的炎性反应亦显著降低,证实平喘汤对哮喘的治疗作用是通过抑制NLRP3炎症小体介导的炎症级联反应实现的。
值得注意的是,虽然平喘汤可显著降低气道炎性反应,但NLRP3炎症小体及其下游靶向炎性反应因子仍明显高于空白组,说明平喘药不能短期内从根本上逆转哮喘后气道炎性反应的病理生理学改变,这也是中医学强调哮喘患儿需长期同本(补肺健脾益肾)治疗的重要原由。此外,与徐增梅等[22]研究结果不同,我们发现平喘汤对哮喘的疗效低于地塞米松,这可能与动物模型和药方配比不同有关。
综上所述,平喘汤可通过抑制NLRP3炎症小体活化所介导的炎症级联反应,减轻气道慢性炎症,缓解哮喘呼吸道症状,改善预后。本研究在国家大力发展中医药和民族医药事业的背景下,以儿科临床需要为出发点,探析经验药方的作用及其分子机制,为患儿哮喘的临床治疗提供理论依据和意见参考。
参考文献
[1]Zhou X,Hong J.Pediatric asthma management in China:current and future challenges[J].Paediatr Drugs,2018,20(2):105-110.
[2]Barnig C,Frossard N,Levy BD.Towards targeting resolution pathways of airway inflammation in asthma[J].Pharmacol Ther,2018,186:98-113.
[3]Schroder K,Tschopp J.The inflammasomes[J].Cell,2010,140:821-832.
[4]Jo EK,Kim JK,Shin DM,et al.Molecular mechanisms regulating NLRP3 inflammasome activation[J].Cell Mol Immunol,2016,13:148-159.
[5]Sethi GS,Sharma S,Naura AS,et al.PARP inhibition by olaparib alleviates chronic asthma-associated remodeling features via modulating inflammasome signaling in mice[J].IUBMB Life,2019,71(7):1003-1013.
[6]李敬华.平喘汤治疗支气管哮喘疗效观察[J].陕西中医,2014,35(4):391-392.
[7]李冬梅,杨志华,刘晓霞,等.止咳平喘汤治疗小儿咳嗽变异性哮喘32例[J].西部中医药,2014,27(4):102-103.
[8]余晓芬.平喘汤治疗小儿非急性期哮喘的临床疗效观察[J].中国医药科学,2018,8(10):69-71.
[9]Henderson WR Jr,Lewis DB,Albert RK,et al.The importance of leukotrienes in airway inflammation in a mouse model of asthma[J].J Exp Med,1996,184(4):1483-1494.
[10]陈奇.中药药理研究方法学[M].北京:人民卫生出版社,2006:33.
[11]刘建文,季光,魏东芝,等.药理实验方法学:新技术与新方法[M].北京:化学工业出版社,2003,136:141.
[12]Chiu GS,Chatterjee D,Darmody PT,et al.Hypoxia/reoxygenation impairs memory formation via adenosine-dependent activation of caspase-1[J].J Neurosci,2012,32:13945-13955.
[13]窦金丽,陈静,杨青慧.健康教育对支气管哮喘患者吸入糖皮质激素口咽部不良反应的影响[J].世界最新医学信息文摘,2016,58:172.
[14]冯高华,朱虹,孙峰,等.平喘汤对支气管哮喘大鼠肺组织IgE、TGF-β1,及TNF-α的影响[J].中药新药与临床药理,2011,16(3):273-276.
[15]李草旎,陈雪莉.自拟平喘汤配合GINA阶梯方案对支气管哮喘患儿血清IL-17、IL-33水平及生活质量的影响[J].现代中西医结合杂志,2016,25(29):3205-3207.
[16]Liu Y,Gao X,Miao Y,et al.NLRP3 regulates macrophage M2 polarization through up-regulation of IL-4 in asthma[J].Biochem J,2018,475(12):1995-2008.
[17]Kim RY,Pinkerton JW,Essilfie AT.Role for NLRP3 inflammasome-mediated,IL-1β-dependent responses in severe,steroid-resistant asthma[J].Am J Respir Crit Care Med,2017,196(3):283-297.
[18]Liao Z,Xiao T,Zhang Y,et al.IL-1β:a key modulator in asthmatic airway smooth muscle hyper-reactivity[J].Expert Rev Respir Med,2015,9(4):429-436.
[19]Kawayama T,Okamoto M,Imaoka H,et al.Interleukin-18 in pulmonary inflammatory diseases[J].J Interferon Cytokine Res,2012,32(10):443-439.
[20]Li R,Wang J,Li R,et al.ATP/P2X7-NLRP3 axis of dendritic cells participates in the regulation of airway inflammation and hyper-responsiveness in asthma by mediating HMGB1 expression and secretion[J].Exp Cell Res,2018,366(1):1-15.
[21]Liu X,Shen J,Fan D,et al.Yupingfeng San inhibits NLRP3 inflammasome to attenuate the inflammatory response[J].Front Pharmacol,2017,8:944.
[22]徐增梅,丁偉伟,李泽庚.麻芍平喘汤对哮喘大鼠气道重塑及TGF-β1、PDGF-BB的影响[J].天津中医药大学学报,2017,36(2):123-127.
(2019-11-04收稿 责任编辑:徐颖)
