物理化学电池电动势部分考研考点的分析及应用*
2020-06-19徐秋红
徐秋红
(滨州学院化工与安全学院,山东 滨州 256603)
物理化学是用物理的原理和方法来研究化学中最基本的规律和理论的课程[1-2],是化学化工类、高分子材料类、 环境工程类、生物制药类等专业的一门重要的专业基础课。它是我校化学工程与工艺、应用化学、能源化学工程、高分子材料与工程、油气储运工程、环境工程、生物制药和食品质量与安全专业的必修课程,也是一门重要的考研课程。电化学是物理化学考研科目的必考内容,是研究化学现象和电现象之间的相互关系以及化学能与电能相互转化规律的学科[3]。化学现象与电现象的联系,化学能与电能的转化,都必须通过原电池或电解池才可以实现。将化学能转换为电能的装置称为原电池,若转换过程是以热力学可逆方式进行的,称为可逆电池。可逆电池电动势计算及应用是电化学中非常重要的组成部分。对近年来物理化学课程可逆电池电动势的计算及应用部分的主要内容、考研考点和真题进行了分析,以期为物理化学的教学和学生考研提供参考。
1 电池电动势应用简介
原电池电动势等于组成电池的各相间的各个界面上(电极和溶液之间的界面,溶液和溶液之间的界面,金属和金属之间的界面等)所产生的电势差的代数和[4-5]。电池电动势的应用是极其广泛的,一方面它能揭示化学能转化为电能的最高极限,从而为改善电池性能提供依据;另一方面,使得用电化学测定的数值计算热力学函数的变化值成为可能[6]。借助于能斯特方程[7]所计算的电极电势和电池电动势可以计算电池反应的各种热力学函数的变化值,可以判别氧化还原反应可能进行的方向,还可以计算电解质溶液的活度或平均活度因子以及计算难溶盐的活度积等[8]。
2 考研考点及真题分析
2.1 考研考点
考点1:计算热力学函数的变化值。根据电极电势和电池电动势的Nernst方程[7],计算出电池电动势E。再根据热力学与电化学的联系公式ΔrGm=-ZEF和热力学的基本公式,可以较精确的计算热力学函数的变化值ΔrGm、ΔrSm、ΔrHm和ΔrUm以及QR和W。需要注意的是并不是所有的反应都可以用电化学方法来计算,只有氧化还原反应并可以排成可逆电池的反应才能用电化学方法求算热力学函数的变化值。
考点2:计算电解质溶液的活度或平均活度因子。根据电池的标准电池电动势Eθ和电池电动势E,结合Nernst方程就可以计算出电解质溶液的离子平均活度及离子的平均活度因子。
考点3:计算难溶盐的活度积。难溶盐的活度积(习惯上称为溶度积)Ksp实际上就是难溶盐溶解过程的平衡常数。若将难溶盐的溶解过程设计成电池,就可以利用电池电动势求出其活度积。
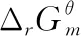
考点5:判断电池反应可能进行的方向。电极电势的高低,反映了电极中反应物质得到或失去电子的能力的大小。电极电势越低,越容易失去电子而被氧化,反之,电极电势越高,越容易得到电子而被还原。因此,可以根据正负极电极电势的高低,判断反应进行的趋势。如果电池的电动势E大于0,说明该反应是自动发生的;如果该电池的电动势E小于0,说明该反应的逆反应是自动发生的。
考点6:根据电池反应,设计电池。设计电池是电化学方法解决热力学问题的关键。设计电池的一般步骤为三步,第一步确定电解质溶液,第二步确定正负电极,第三步写出电池,并检验电池的正确性。设计电池时要对各类可逆电极的类型非常熟悉,例如金属电极,气体电极,金属-难溶盐电极等[9]。
2.2 真题分析
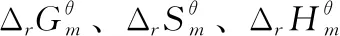
涉及考点1和6。
解析:(1)有1个电子得失的电极反应和电池反应如下:
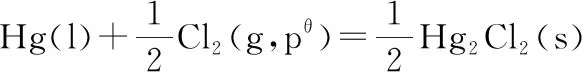
(2)根据电池电动势的计算公式
所以Eθ=E=1.092 V
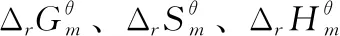
(3)同温同压下,有1个电子得失时,
真题2:有电池 Ag(s)|AgCl(s)|KCl (0.1 mol·kg-1)|Hg2Cl2(s)|Hg(l),请:(1) 写出电极反应及电池反应;(2)计算298 K时该电池的电动势、电池反应的平衡常数,并判断反应方向;(3)计算298 K 时所写电池反应的ΔrGm、ΔrSm、Qr,m。假设各物质的活度因子均为 1,并已知Eθ= 0.0584 V+3.41×10-4(T/K- 298) V。
涉及考点1、4和5。
解析:(1)电极及电池反应如下:


电池反应:2Ag(s)+Hg2Cl2(s)=2AgCl(s)+2Hg(l)
(2)298 K时的电池电动势
Eθ=0.0584+3.41×10-4(T-298)
=0.0584+3.41×10-4(298-298)=0.0584V
因为电池电动势大于0,所以该电池反应能正向自发进行。
(3)热力学函数的计算如下:
ΔrGm=-ZEF=-2×0.0584×96500=-11.271 kJ·mol-1
Qr,m=TΔrSm=298×65.813=19.612 kJ·mol-1
真题3:已知298K时,Eθ(Ag+/Ag)=0.7991 V,Eθ[Br-/AgBr,Ag(s)]=0.0713 V。设有一电池Pt|H2(100 kPa)||HBr (0.1 mol·kg-1)|AgBr(s)|Ag(s),测得25 ℃时的电动势E=0.2005 V。(1)写出该电池的电极反应及电池反应;(2)计算298 K时,0.1 mol·kg-1的HBr水溶液的离子平均活度因子(系数)γ±;(3)根据所给数据,设计一电池,计算298 K时AgBr的活度积。
涉及考点2、3和6。
解析:(1)电极及电池反应如下:


电池反应:1/2H2(g,100 kPa)+AgBr(s)=Ag(s)+HBr(a)
(2)根据电池电动势
b±=b=0.1 mol·kg-1
代入数据:
解得:γ±=0.808
(3)电池设计为:Ag(s)|Ag+(a)||Br-(a)|AgBr(s)|Ag(s)

电池反应:AgBr(s)=Ag+(a)+Br-(a)
电池的电动势
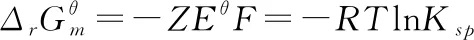
Ksp=e(ZEθF/RT)=e[1×(-0.7278)×96500/8.314×298]=4.89×10-13
3 结 语
针对物理化学考研中电池电动势计算及应用考点结合相关考研真题从计算热力学函数的变化值、计算电解质溶液的活度或平均活度因子、计算难溶盐的活度积、计算电池反应的平衡常数、判断电池反应可能进行的方向及根据电池反应,设计电池等6个方面进行了总结和深入分析,以期为物理化学的教学和学生考研提供参考。
