Snail介导的肺上皮间质转化在肌成纤维细胞活化中的作用
2020-06-19李思泠朱钟慧李秋月许春杰
李思泠 朱钟慧 李秋月 许春杰 赵 静 王 炎 田 琳
(首都医科大学公共卫生学院劳动卫生与环境卫生学系,北京 100069)
肺纤维化是指通过肺组织瘢痕化和肺泡间隔的增厚而损害呼吸气体交换的多种病症[1],是肺组织对毒物、自身免疫以及感染性反应的终末阶段[2]。肺纤维化是包括矽肺在内的众多肺部疾病的最终表现,形成过程复杂,发生机制尚未完全阐明。成纤维细胞增生在肺纤维化疾病中发挥重要作用,一般认为,成纤维细胞主要来源于肺内固有的间充质细胞和血液(骨髓源性),而目前研究[3]显示,肺泡上皮细胞间质转化(epithelial-mesenchymal transition, EMT)是成纤维细胞的来源之一,对肺纤维化的发生发展起重要的推动作用。
EMT被视为上皮细胞失去其上皮表型特征而逐渐获得间质细胞表型特征的过程。上皮细胞由于紧密连接,具有细胞极性,形态排列紧密,似铺路石样,不容易进行自由移动。相反,间质细胞失去了细胞极性,缺少细胞之间的连接,细胞形态变成长梭形,易于迁移,同时伴有细胞表型的改变。国外学者[4]和本课题组研究[5-6]都显示,抑制EMT可以抑制组织器官的纤维化。但Tanjore等[7]发现,在肺纤维化小鼠肺内EMT来源的肌成纤维细胞极少,这说明EMT来源的成纤维细胞极少转化为肌成纤维细胞。EMT是如何参与纤维化过程,是否间接参与了成纤维细胞的活化是本研究拟探讨的重点。在EMT过程中,多条信号通路发挥作用,上调核转录因子,促进上皮细胞向间充质细胞转变,其中,核转录因子Snail参与多条重要信号通路的信号转导过程,能够介导细胞发生EMT。本课题组前期研究[6]也显示,在石英诱导肺泡上皮细胞发生EMT过程中,Snail的表达上调。Snail介导的EMT如何参与组织纤维化,具体机制并不清楚。近年来,有研究[8]显示,上皮细胞受到损伤后可以促进成纤维细胞活化为肌成纤维细胞,在基因层面上体现为成纤维细胞的纤维化标志物Ⅰ型胶原(collagen Ⅰ α1,COL1A1)、Ⅲ型胶原(collagen Ⅲ α1,COL3A1)和间质标志物α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)等基因表达的上调,进而引起纤维化的发生。
因此,笔者设想,上皮细胞发生EMT后可以促进肺内肌成纤维细胞活化。肺泡上皮细胞发生EMT后能否活化肺内固有成纤维细胞从而引起肺纤维化,目前未见报道。本研究通过体外共培养小鼠Ⅱ型肺泡上皮细胞(MLE-12)和小鼠胚肺成纤维细胞(NIH-3T3)并进行相关实验,拟讨论发生由Snail介导的EMT的上皮细胞能否引起肺内固有成纤维细胞的活化。
1 材料与方法
1.1 细胞株、试剂和仪器
小鼠Ⅱ型肺泡上皮细胞株MLE-12(美国ATCC细胞研究中心),小鼠胚肺成纤维细胞株NIH-3T3(中国医学科学院基础医学研究所基础医学细胞中心),高糖DMEM、胎牛血清(美国HyClone公司),青链霉素混合液、胰酶、全蛋白提取试剂盒KGP2100(南京凯基生物科技发展有限公司),重组人转化生长因子-β1(transforming growth factor-β1, TGF-β1)(美国PeproTech公司),Snai1-shRNAi、阴性对照病毒(上海吉凯基因科技有限公司),Transzol up、mRNA反转录试剂盒AT301、qPCR试剂盒AQ141(北京全式金生物技术有限公司),BCA蛋白定量试剂盒(北京鼎国昌盛生物技术有限责任公司),兔多克隆Snail抗体(美国Abgent公司),兔多克隆GAPDH抗体、羊抗兔二抗抗体(美国CST公司),酶标仪(美国BioTek技术有限公司),PCR扩增仪(美国Thermo Hybaid公司),荧光定量PCR仪(美国Bio-Rad公司)。
1.2 细胞培养及TGF-β1刺激细胞
1.2.1 细胞分组
对照组:上室加入基础培养基,下室加入NIH-3T3;TGF-β1组:上室加入基础培养基和10 ng/mL TGF-β1,下室加入NIH-3T3;MLE-12组:上室加入MLE-12,下室加入NIH-3T3;MLE-12+TGF-β1组:上室MLE-12培养中加入TGF-β1,下室加入NIH-3T3。
1.2.2 试验方法
小鼠Ⅱ型肺泡上皮细胞(MLE-12)和小鼠胚肺成纤维细胞(NIH-3T3)均在含有10%(体积分数)胎牛血清、1%(质量分数)双抗(100 U/mL青霉素和100 mg/L链霉素)的基础培养基中,置于37 ℃恒温[95% 湿度,5%(体积分数)CO2]的细胞培养箱中孵育。
用10 ng/mL的TGF-β1刺激MLE-12 48 h可诱发EMT。
在共培养体系中,使用上室膜孔隙为0.4 μm的六孔Transwell板,在下室接种NIH-3T3,细胞密度为1×106个/mL,上室接种MLE-12,细胞密度为2×105个/mL。待上下室细胞密度均达到80%开始进行共培养,使用10 ng/mL的TGF-β1刺激上室MLE-12,共培养48 h。
1.3 慢病毒转染MLE-12细胞
1.3.1 细胞分组
对照组:上室加入空病毒转染的MLE-12,下室加入NIH-3T3;对照+TGF-β1组:上室空病毒转染的MLE-12培养中加入TGF-β1,下室加入NIH-3T3;Snail-shRNA组:上室加入Snail-shRNA病毒转染的MLE-12,下室加入NIH-3T3;Snail-shRNA+TGF-β1组:上室Snail-shRNA病毒转染的MLE-12培养中加入TGF-β1,下室加入NIH-3T3。
1.3.2 试验方法
根据预实验确定的最佳染毒条件慢病毒转染复数(multiplicity of infection,MOI)=50对MLE-12进行转染(阴性对照病毒、Snail-shRNA病毒),转染72 h后进行传代,获得稳定转染株。
1.4 荧光定量PCR法检测EMT及纤维化相关基因表达
使用Tranzol up提取细胞总RNA,使用酶标仪测定样品总RNA浓度及纯度,用于对总RNA进行反转录以得到cDNA。将cDNA稀释3倍后,取1 μL作为实时荧光定量PCR的模板,用于PCR扩增。反应条件为:预变性94 ℃,5 s;变性94 ℃,5 s;退火58 ℃,15 s;延伸72 ℃,10 s,共40个循环数。每个样品做3个复孔。上皮标志物E钙粘蛋白(E-cadherin,CDH1)、间质标志物α-SMA、核转录因子Snail、纤维化标志物COL1A1、COL3A1的Ct值经内参基因GAPDH标化后,根据2-ΔΔCt公式计算各样品相关基因的mRNA 相对表达量。引物序列详见表1。

表1 mRNA引物序列(小鼠)
1.5 Western blotting检测Snail蛋白表达
细胞样品蛋白质的提取按蛋白抽提试剂盒说明书进行,BCA法测定各样品蛋白质浓度,加入5×SDS蛋白上样电泳缓冲液,沸水浴10 min,冷却至室温。聚丙烯酰胺凝胶电泳检测Snail蛋白质表达。
1.6 统计学方法
采用SPSS 22.0软件进行统计学分析。两组均数比较采用独立样本t检验,两组以上的均数比较采用单因素方差分析(ANOVA)及LSD多重比较检验分析,统计结果以P<0.05为差异有统计学意义。所有实验均独立重复3次。
2 结果
2.1 TGF-β1对MLE-12细胞形态及EMT相关表型的影响
诱导48 h后,光镜下可见对照组MLE-12细胞状态良好,保持了上皮样形态;TGF-β1诱导组MLE-12细胞则呈现出纺锤形(图1)。RT-qPCR结果显示,TGF-β1诱导48 h后,MLE-12的CDH1 mRNA表达量较对照组降低,而α-SMA以及核转录因子Snail mRNA 表达量则升高,差异有统计学意义(P<0.05),详见图2。

图1 TGF-β 1(10 ng/mL)刺激48 h对MLE-12细胞形态的影响Fig.1 Effect of TGF-β 1 (10 ng/mL) on the morphology of MLE-12 cells stimulated by 48 h(10×) A:before stimulation; B: after stimulation; TGF-β 1:transforming growth factor-β 1.

图2 TGF-β 1刺激48 h对MLE-12 CDH1、α-SMA、Snail mRNA表达的影响Fig.2 Effect of TGF-β 1 on the expression of CDH1, α-SMA, Snail mRNA of MLE-12 cells stimulated by 48 h TGF-β 1:transforming growth factor-β 1; CDH1:E-cadherin; α-SMA:α-smooth muscle actin; *P<0.05, ** P<0.01 vs control; n=3.

图3 上室不同条件共培养48 h对NIH-3T3 α-SMA、COL1A1、COL3A1 mRNA表达的影响Fig.3 Effects of 48 h of co-culture on the expression of α-SMA, COL1A1 and COL3A1 mRNA of NIH-3T3 in different conditions of insert*P<0.05, **P<0.01 vs control; #P<0.05, ##P<0.01 vs MLE-12; &&P<0.01 vs TGF-β 1; n=3; TGF-β 1:transforming growth factor-β 1;α-SMA:α-smooth muscle actin:COL1A1:collagen Ⅰ α1; COL3A1:collagen Ⅲ α1.
2.2 发生EMT的MLE-12能够促进NIH-3T3的活化
与空白对照相比,TGF-β 1与MLE-12都可引起下室NIH-3T3 α-SMA、COL1A1、COL3A1 mRNA表达的上调。经由TGF-β 1诱导的MLE-12引起下室NIH-3T3 α-SMA、COL1A1、COL3A1 mRNA表达的上调程度分别高于TGF-β 1和MLE-12的单独作用,差异有统计学意义(P<0.05),详见图3。
2.3 敲减MLE-12的Snail基因能够抑制共培养体系NIH-3T3的活化
慢病毒处理MLE-12后,相对于空病毒对照组,Snail-shRNA慢病毒可明显降低MLE-12的Snail mRNA和蛋白质表达,差异有统计学意义(P<0.05),详见图4、图5。
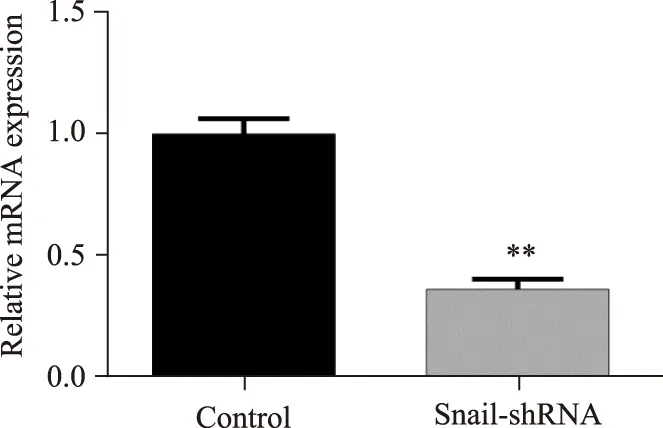
图4 慢病毒转染后MLE-12 Snail mRNA表达Fig.4 Expression of Snail mRNA of MLE-12 cells after lentivirus transfection ** P<0.01 vs control; n=3.
与对照组相比,TGF-β 1可引起下室NIH-3T3 成纤维标志物α-SMA、COL1A1、COL3A1 mRNA表达的上调,相比于Snail-shRNA-MLE-12,由TGF-β 1诱导的Snail-shRNA-MLE-12同样可引起下室NIH-3T3 成纤维标志物α-SMA、COL1A1、COL3A1 mRNA表达的上调。但相对于对照+TGF-β 1组,由TGF-β 1诱导的Snail-shRNA-MLE-12可下调下室NIH-3T3的α-SMA、COL1A1、COL3A1 mRNA表达,差异有统计学意义(P<0.05),详见图6。

图5 慢病毒转染后MLE-12 Snail 蛋白表达Fig.5 Expression of Snail protein of MLE-12 cells after lentivirus transfection ** P<0.01 vs control; n=3.

图6 上室不同条件共培养48 h对NIH-3T3 α-SMA、COL1A1、COL3A1 mRNA表达影响Fig.6 Effects of 48 h of co-culture on the expression of α-SMA, COL1A1 and COL3A1 mRNA of NIH-3T3 in different conditions of insert *P<0.05, **P<0.01 vs control;##P<0.01 vs Snail-shRNA,&P<0.05,&&P<0.01 vs control+TGF-β 1;n=3;TGF-β 1:transforming growth factor-β 1; α-SMA: α-smooth muscle actin; COL1A1:collagen Ⅰ α1; COL3A1:collagen Ⅲ α1.
3 讨论
肺纤维化是多种肺部疾病的最终表现结果,一般指多种原因导致肺组织损伤后的病理过程,早期表现为弥漫性肺炎,后期为成纤维细胞增生和细胞外基质(extracellular matrix,ECM)过度沉积[9]。临床表现为进行性呼吸困难并伴刺激性干咳,且随着病情进展,患者呼吸功能不断恶化,最终演变为呼吸衰竭甚至死亡[10]。肺纤维化可由各种急性和慢性肺损伤引发[11],是一种复杂的肺间质疾病,基因异常、自身免疫、职业暴露、创伤、药物及病原微生物感染等多种因素均可引起肺纤维化的发生。例如,矽肺就是石英粉尘的职业暴露引起的肺部弥漫性纤维化为主的全身性疾病,是我国目前常见的且危害较为严重的职业病,已经成为我国亟待解决的公共卫生问题。不论是何种病因,肺纤维化在细胞水平上都体现为一些持续或反复损伤的修复反应,或对于刺激的异常调节以及不恰当的修复[12]。由于发病机制不明,目前临床上缺乏疗效显著的治疗药物[13]。探索肺纤维化的发病机制以延缓或阻断其发生发展的策略,具有重要的实际意义。
在肺纤维化疾病中,成纤维细胞的增生发挥重要作用。近年来有研究[3]显示EMT是成纤维细胞的主要来源之一,并且对纤维化的发生发展起重要推动作用。Iwano等[14]在肾脏纤维化的肾间质中发现了成纤维细胞活化标志物成纤维细胞特异性蛋白1(fibroblast specific protein1,FSP1)、波形蛋白、α-SMA的高表达,在肾纤维化发生期间,FSP1表达阳性的成纤维细胞也通过局部EMT大量出现,证明了上皮细胞可以通过EMT导致成纤维细胞的活化和纤维化发生。Zeisberg等[15]通过谱系追踪发现,在肝纤维化病灶内,大量的成纤维细胞来源于发生EMT的上皮细胞。Kim等[3]在特发性肺纤维化患者的肺上皮细胞中同时发现了上皮和间质标志物的表达,并通过转基因小鼠证实发生EMT的肺泡上皮细胞是纤维化病灶中间质细胞的主要来源之一。在EMT过程中,多条信号通路发挥作用,上调转录因子,促上皮细胞向间充质转变,其中,核转录因子Snail参与包括TGF-β通路在内的多条信号通路的信号转导过程,能够诱导上皮细胞发生EMT,在肌成纤维细胞活化过程中起到重要作用。TGF-β是一种促分泌的蛋白,能够影响细胞的自分泌及旁分泌。TGF-β主要包括3种类型,即TGF-β 1、TGF-β2和TGF-β3,其中,TGF-β 1在包括肿瘤和纤维化等病理过程的发生发展中都起到重要的调节作用。TGF-β 1在所有哺乳动物的细胞中都有表达,是诱导EMT的重要细胞因子。在一些体外培养的上皮细胞中,单纯使用TGF-β 1刺激就可以诱导EMT的发生[16]。TGF-β 1在肺纤维化疾病中是一个重要的促纤维化因子,在矽肺中,石英刺激巨噬细胞后主要通过分泌TGF-β 1,作用于包括肺泡上皮细胞在内的特异的靶细胞,促进肺泡上皮细胞发生EMT,成纤维细胞增生和胶原合成并活化为肌成纤维细胞,分泌胶原蛋白,最终引起肺纤维化[17]。因此在本研究中,使用TGF-β 1的刺激建立肺上皮细胞发生EMT模型。结果显示,使用TGF-β 1刺激MLE-12 48 h后,与对照组相比,MLE-12在形态学上由铺路石样形态变为纺锤形,呈现间质样变化;在基因表达方面,与对照组相比,上皮标志物CDH1表达下调,α-SMA表达上调,并且Snail基因表达显著升高,这表明TGF-β 1能够诱导MLE-12发生EMT。
国外学者[4]和本课题组的前期研究[5-6]都显示抑制EMT与抑制组织器官纤维化关系密切。本课题组在前期研究[5-6]显示, 骨形态发生蛋白7可以抑制大鼠矽肺模型中的肺纤维化,这可能与肺组织中EMT的抑制有关。然而,有学者[7]发现,EMT来源的成纤维细胞极少活化为肌成纤维细胞,而肌成纤维细胞在细胞外基质合成以及纤维化疾病发生中起关键作用,这提示EMT可能不是通过直接转化为成纤维细胞在纤维化疾病中发挥作用。EMT究竟如何参与纤维化的发生已成为近年来的研究热点,Richeldi等[8]发现,上皮细胞受到刺激后,可以通过旁分泌的方式促进成纤维细胞的活化,进而引起纤维化的发生。本课题组结合前期研究以及国内外相关研究[8],认为旁分泌可能在纤维化发生发展中具有重要作用,因此,通过在体外建立上皮-间质细胞共培养体系,模拟旁分泌模型,拟探讨上皮细胞能否通过旁分泌的方式引起成纤维细胞活化为肌成纤维细胞。本研究通过建立MLE-12与NIH-3T3共培养体系,模拟体内环境的相互作用,探讨上皮细胞发生EMT能否活化成纤维细胞进而引起纤维化的发生。本研究表明,在MLE-12与NIH-3T3共培养体系中,发生EMT的MLE-12能显著诱导NIH-3T3 α-SMA、COL1A1、COL3A1 mRNA表达的上调。该研究结果提示发生EMT的上皮细胞能够引起成纤维细胞活化为肌成纤维细胞。但发生EMT的上皮细胞具体通过旁分泌哪种细胞因子发挥作用,还有待继续研究。
Lovisa等[18]发现,在肾纤维化小鼠模型中,纤维化病灶内的肾小管上皮细胞中Snail表达量丰富,对肾小管上皮细胞Snail基因进行敲除后,肾小管上皮细胞EMT被抑制,肾纤维化减轻。本课题组的前期研究[19]也显示在石英诱导肺上皮细胞发生EMT的过程中,Snail表达上调。Snail是转录抑制因子中的一员,是连接多个信号通路的中心分子,如核因子-κB(nuclear factor-κB,NF-κB)信号通路和TGF-β信号通路等,并且已被证实可以抑制上皮标志物CDH1的表达[20-21]。抑制上皮细胞的Snail能否抑制成纤维细胞活化为肌成纤维细胞,是本研究的研究重点。在本研究中,对MLE-12分别使用Snail慢病毒和阴性对照病毒进行转染,使用转染后的MLE-12与NIH-3T3建立共培养体系,并用TGF-β 1对MLE-12进行刺激,结果表明,与TGF-β 1+阴性对照病毒组相比,TGF-β 1+Snail慢病毒转染组下室NIH-3T3 的α-SMA、COL1A1、COL3A1 mRNA表达上调程度降低。该结果提示,抑制上皮细胞Snail基因的表达可以抑制其对成纤维细胞的活化作用。
本研究证实了Snail介导的小鼠Ⅱ型肺泡上皮细胞发生EMT可引起成纤维细胞的活化,敲减Ⅱ型肺泡上皮细胞的Snail基因可以抑制成纤维细胞活化为肌成纤维细胞。 提示Snail介导的肺上皮间质转化在肌成纤维细胞活化中发挥重要作用。
