2*mapping辅助MRI技术对差异性膝关节骨性关节炎软骨损伤程度的诊断价值
2020-06-17李志刚杜立新赵云辉
李志刚,文 戈,杜立新,王 攀,赵云辉,兰 鹏
1广东医科大学附属龙华中心医院(深圳市龙华区中心医院)医学影像科,广东 深圳518110;2南方医科大学南方医院影像教研室,广东 广州510515
膝关节骨性关节炎(OA)属于膝关节软骨损伤之一,近年来随着我国居民生活方式的不断改变以及人口老龄化问题的日益加剧,膝关节OA的发病率正呈逐年升高趋势[1]。针对膝关节软骨损伤退变,早期准确的诊断和治疗显得尤为重要,对改善患者预后具有极其重要的意义[2]。而关节软骨的退变至OA是一个由量变到质变的过程,在分子水平上,先有生化成分的改变,之后才有结构和形态的改变。针对关节软骨退变的主要病理生理改变,MRI已成为膝关节OA的常规检查方法,相较于既往常规检查而言,该检查方式具有无创、敏感、准确等优势。
目前,国内外研究的热点是定量MR成像技术,主要有:T2 mapping、T2*mapping、DWI及DTI来评估关节软骨的水含量及渗透压的改变;钠磁共振成像、延迟钆增强磁共振软骨成像来评估蛋白多糖的变化;以及DTI来评估胶原蛋白的变化等,但评估效果尚存争议[3-4]。虽然T2 mapping在评价关节软骨退变方面文献报道较多,主要是基于多回波自旋回波(MESE)序列的T2值来反映软骨内成分的改变,且对软骨内的水及胶原纤维的变化较敏感,能有效检测关节软骨早期退变或损伤区域,间接反映蛋白多糖含量,可提高对膝关节软骨损伤检测的敏感度。但其缺陷是存在特异度降低,应用于早期膝关节软骨损伤评价方面的效果仍不理想,T2值与胶原蛋白含量是否相关尚存在争议[5-7],且存在扫描时间相对较长、图像质量较低及可重复性不强等问题。针对上述问题和缺陷,我们尝试选择在3.0 T常规MRI扫描的基础上选择T2*mapping成像序列来对OA进行研究,利用T2*mapping软骨生化成像手段、成像速度快、图像分辨率高、能进行三维各向同性评价等优势。相对T2 mapping技术而言,在一定程度上缩短了成像时间,同时提高了空间分辨率[3,8]。通过分析T2*mapping辅助MRI诊断技术评价差异性膝关节OA软骨损伤程度患者的作用并进行分析,旨在为膝关节OA的早期诊断提供一种行之有效的手段。
1 资料与方法
1.1 一般资料
选取我院2016年6月~2019年6月收治的膝关节OA患者46例作为病变组,其中男性32例,女性14例,年龄22~69岁(41.19±15.53岁)。纳入标准:所有患者均存在不同程度的膝关节疼痛及功能障碍;年龄18周岁以上;入院前尚未接受任何相关治疗;临床病历资料完整。排除标准:存在急性外伤及骨折者;入院前便已有糖尿病和类风湿性关节炎等其他内科疾病者;既往有膝关节肿瘤或(和)手术病史者。另取正常健康志愿者7名作为对照组,其中男性5例,女性2例,年龄23~64岁(42.05±15.28岁)。两组一般资料相比较,差异无统计学意义(P>0.05),具有可比性。纳入对象均在知情同意书上签字,并有完善的医院伦理委员会审批手续。
1.2 研究方法
使用Siemens Skyra 3.0 T超导磁共振成像仪。18通道膝关节线圈。检查前要求患者静坐30 min,随后取仰卧位,保持膝关节自然伸直,先完成膝关节常规MRI扫描后,进行基于FLASH(梯度回波)多回波序列的T2*mapping扫描,相关扫描参数如下:TR=784 ms,TE=4.84/12.37/19.91/27.48/34.99/42.53 ms,翻转角60°,层厚3.0 mm,层间隔0.6 mm,FOV:160 mm×160 mm,矩阵:384×384,NEX:1,采集时间2min30s。
1.3 图像分析
(1)将所获取的图像上传至工作站,借助Mapit软件包和PACS系统完成图像的处理和分析。将融合TE=12.37 ms解剖图以及T2*mapping图像,适当调节色阶,以蓝色表示T2*最低,红色最高,绿色中等。以Siemens Syngo MMWMPver:1.8作为图形工作站。由我院两名经验丰富的MRI医师采用双盲法完成阅片;(2)选择膝关节承重面,非承重面软骨区放置ROI,重复测量3次,以平均值作为最终结果。其中承重面测量部位包括股骨内、外侧髁以及内、外侧胫骨平台。以软骨异常信号区作为ROI的放置部分,若无软骨异常信号区,则随机选取上述每个区域的任意3点,以平均值作为结果。非承重面测量部位涵盖股前、股后及髌骨软骨关节接触面和非接触面,上述各区域分别取3点进行测量,以平均值作为结果。
1.4 评价标准
膝关节OA病情评估主要是参照Kellgren-Lawrence放射学诊断标准[9-10]完成:0级:无异常;Ⅰ级:关节间隙轻微变窄,伴或不伴骨赘;Ⅱ级:关节间隙轻微变窄,骨赘明显;Ⅲ级:关节间隙变窄程度较明显,且有中等量的骨赘以及硬化性改变;Ⅳ级:关节间隙变窄程度十分明显,且有大量的骨赘以及硬化性改变或明显畸形。将Ⅰ、Ⅱ级记为轻度OA,Ⅲ、Ⅳ级记为重度OA。
1.5 统计学方法
采用SPSS20.0软件进行数据分析,计数资料以率表示,行χ2检验;计量资料以均数±标准差表示,行t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 病变组与对照组膝关节不同区域软骨T2*值对比
病变组膝关节股骨内侧髁、股骨外侧髁、内侧胫骨平台、外侧胫骨平台T2*值均高于对照组(P<0.05,表1、图1A~F)。
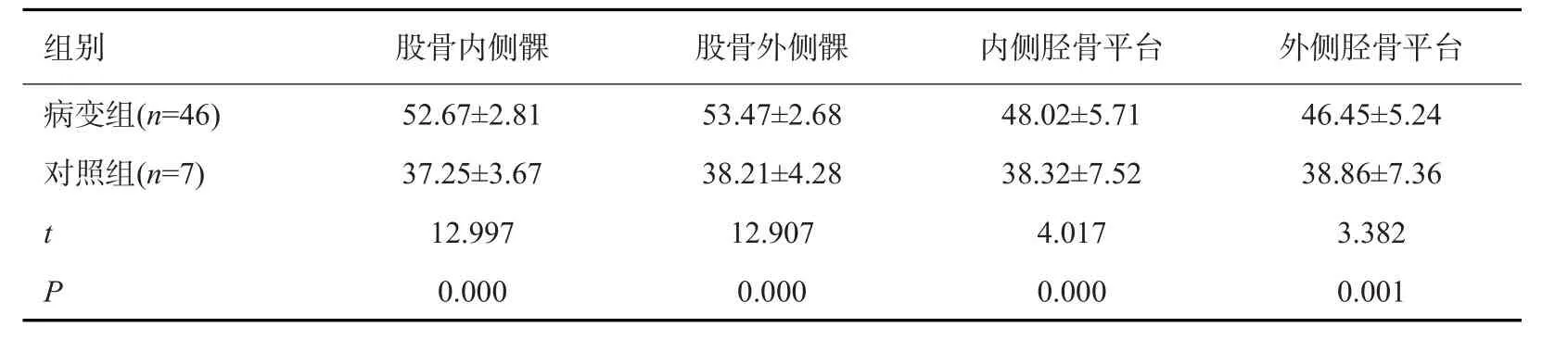
表1 病变组与对照组膝关节不同区域软骨T2*值对比(ms,Mean±SD)Tab.1 Comparison of the T2* values of cartilage in different areas of knee joint in lesion group and control group
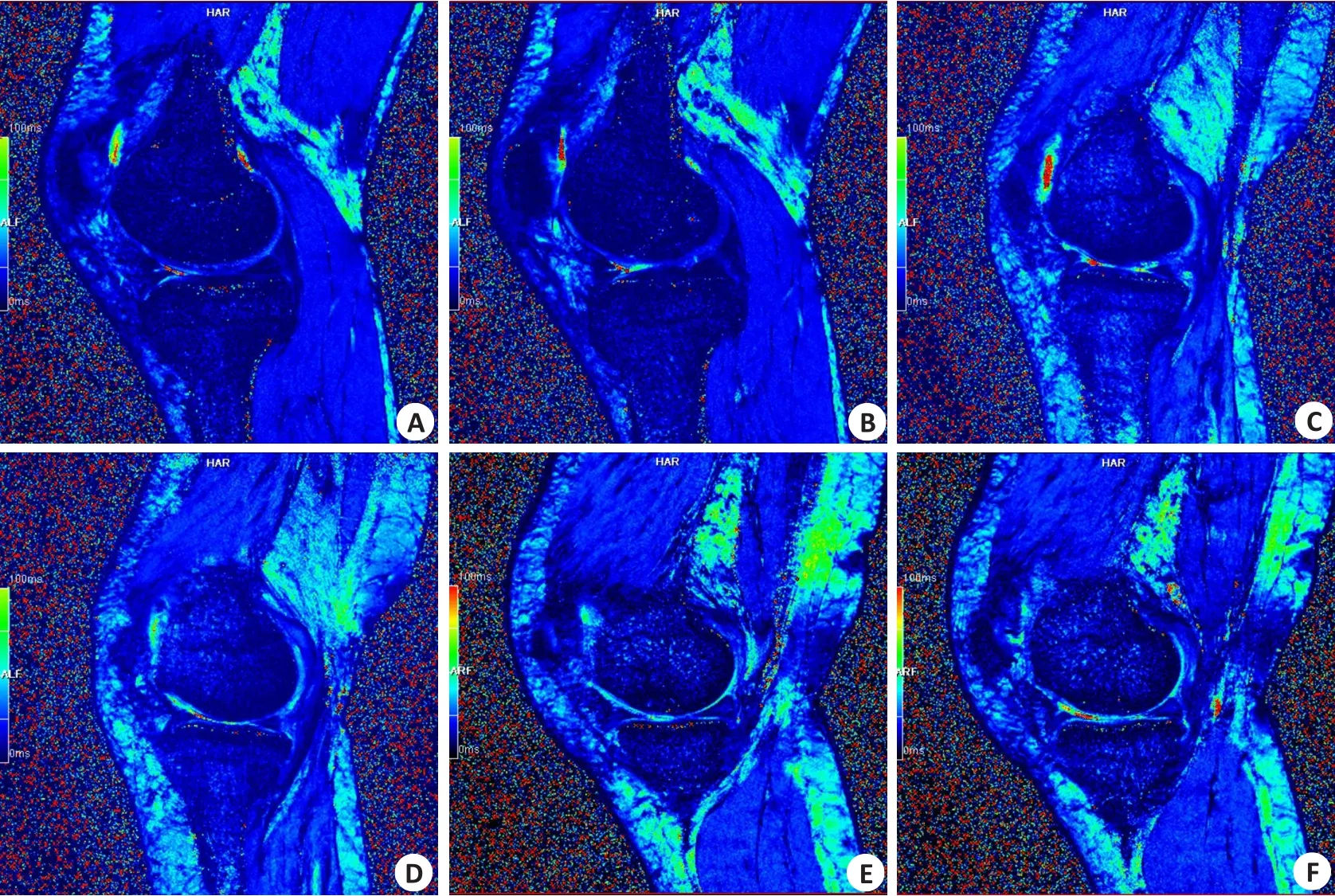
图1 典型的膝关节软骨伪彩图Fig.1 Typical pseudo-color image of knee cartilage
2.2 病变组不同严重程度OA不同区域软骨T2*值对比
重度患者股骨内侧髁、股骨外侧髁、内侧胫骨平台、外侧胫骨平台T2*值均高于轻度患者(P<0.05,表2)。
2.3 病变组OA各区域浅深层软骨T2*值对比
病变组OA股骨内侧髁、股骨外侧髁、内侧胫骨平台、外侧胫骨平台浅层软骨的T2*值均高于深层软骨(P<0.05,表3)。
2.4 病变组OA股骨内侧髁、外侧髁负重区与非负重区的T2*值对比
病变组OA股骨内侧髁、外侧髁负重区的T2*值均高于非负重区(P<0.05,表4)。
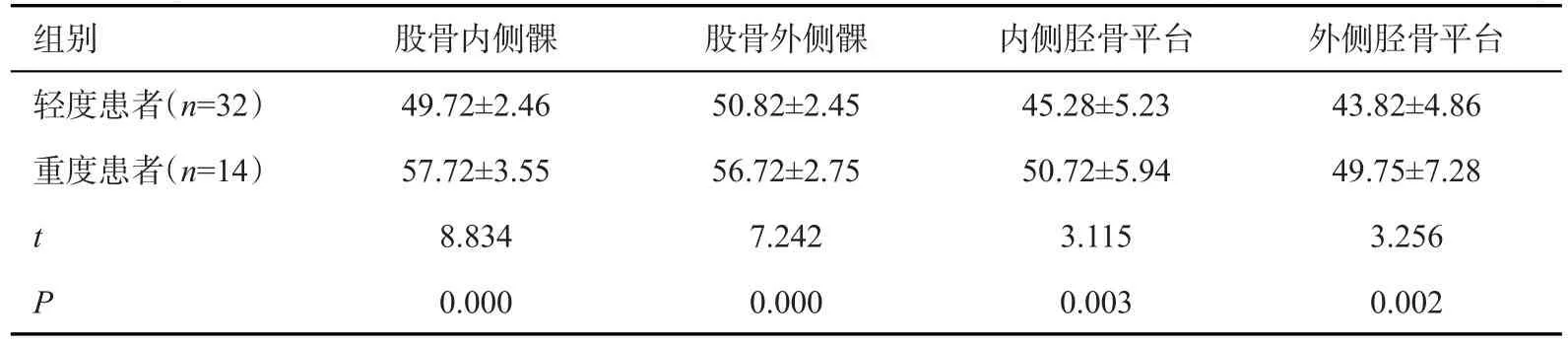
表2 病变组不同严重程度OA不同区域软骨T2*值对比(ms,Mean±SD)Tab.2 Comparison of the T2* values of cartilage in different areas of different severity OA in the lesion group

表3 病变组OA各区域浅深层软骨T2*值对比(ms,Mean±SD,n=46)Tab.3 Comparison of the T2* values of shallow and deep cartilage in each region ofOAin the lesion group
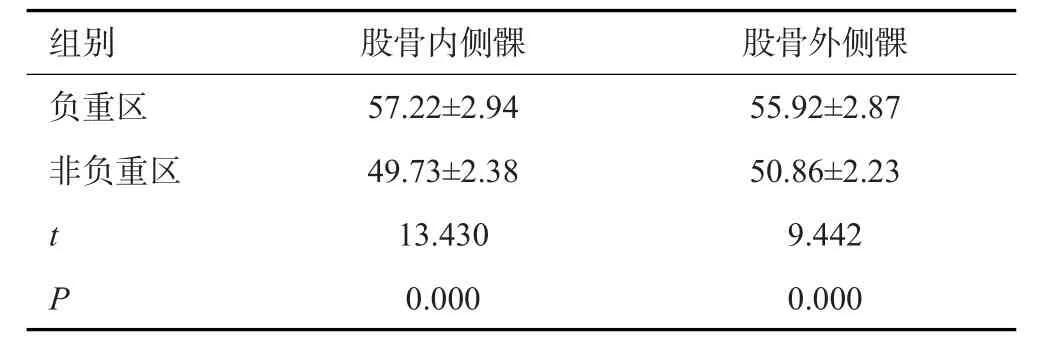
表4 病变组OA股骨内侧髁、外侧髁负重区与非负重区的T2*值对比(ms,Mean±SD,n=46)Tab.4 Comparison of the T2* values of loading zone and nonloading zone of the medial and lateral condyles of the femur of OA in the lesion group
3 讨论
长期重体力劳动、负重以及自身免疫性因素等均可能引发膝关节软骨上皮细胞的损伤,继而引发OA的发生[11-12]。尤其是合并吸烟史的患者中,OA的发病率明显更高,远期关节功能障碍的发生风险较高[13]。相关研究报道表明,OA患者的关节功能丧失几率在8%以上,需接受关节置换术治疗的患者占比超过15%,由此可见,对于OA的早期诊断具有极其重要的意义[11,14-15]。早期准确的诊断有利于指导OA的早期干预,为甾体类抗炎药物的应用或软骨保护剂类药物的早期治疗提供参考依据。迄今为止,关节镜检查是国内外所公认的诊断OA的金标准,可对不同类型以及损伤程度的OA实施诊断,然而,关节镜检查属于有创检查手段,且检查费用较高,不利于推广,同时无法动态检查,难以对患者的病情进行评估[16-17]。而随着近年来膝关节MRI相关研究的日益深入,定量MRI成像技术在评估OA方面的应用成为焦点,主要是在分子水平上,探讨软骨细胞、软骨基质及软骨下骨三者代谢失衡,进而发展软骨退变的结果,发生的改变包括胶原纤维变性退化、蛋白多糖丢失、水含量降低以及水渗透改变。T2 mapping是目前研究较多评估关节软骨退变的定量MRI成像技术,关节软骨的T2值反映了软骨的水及胶原蛋白含量,关节软骨的退变直接导致T2值异常升高。但存在扫描时间较长、图像质量较低及可重复性不强、软骨退变早期评价不理想、特异性不强等缺点[11,15-16]。
近年来,越来越多的学者发现通过计算机获得的T2*值实施图像重构,可借助不同的ROI值,进一步对不同组织平面上的T2*值的评估,继而定量分析软骨组成成分,同时完成病变严重程度的评估[8,17]。且T2*mapping辅助MRI诊断技术可评估软骨表面以及深部组织,从而对软骨内部骨微观结构变化情况实施诊断,研究表明T2*mapping技术对早期膝关节软骨退变的阳性率提高到63.7%[18]。相对于T2 mapping而言,T2*mapping具有成像速度快、图像分辨率高、能进行三维各向同性评价等优势。有关T2*mapping应用于早期膝关节退变的研究报道不多,且MRI机器型号、场强不同、选择序列缺乏统一标准、技术单一,以及仅仅对软骨的T2*值量化,没有进一步分级分度研究等缺陷。正是基于上述情况,我们创新性地提出利用高场强(Siemens Skyra 3.0 T)测量关节软骨的T2*值,并且根据OA的退变程度、软骨的分层、负重与非负重区来分别测量对比,以观察不同条件下T2*值的变化,从分子水平上反映OA的变化。
本研究结果发现,病变组膝关节股骨内侧髁、股骨外侧髁、内侧胫骨平台、外侧胫骨平台T2*值均显著高于对照组(P<0.05)。有研究结果显示[19]:膝关节OA患者股骨内侧/外侧软骨、胫骨内侧/外侧软骨的磁共振T2*Mapping成像T2*值均显著高于对照组。两项研究高度一致,说明T2*mapping辅助MRI诊断技术具有一定的诊断膝关节OA价值。分析原因,笔者认为自由水质子存在OA患者滑膜周围组织的润滑液体内,从而导致软骨组织T2*值的显著升高;与此同时,OA病变过程中细胞外基质成分会出现代偿性增加,加之软骨细胞的不同程度减少,从而引起软骨微观结构的改变,最终促进了T2*值的升高。此外,重度组患者股骨内侧髁、股骨外侧髁、内侧胫骨平台、外侧胫骨平台T2*值均显著高于轻度组(P<0.05)。这表明T2*mapping辅助MRI诊断技术可能是评估膝关节OA患者病情严重程度的潜在指标。究其原因,本研究认为随着病情的不断加剧,其微观结构内的嵌合水分子以及折叠的蛋白质糖分子浓度随之升高,从而使得磁共振成像过程中的T2*回声信号增强,T2*值越高。另有相关研究报道表明,随着OA患者软骨损伤程度的不断加重,关节软骨的基底膜软骨组织纤维排列紊乱越明显,且细胞外基质的占比越重,从而使得T2*值受部分容积现象以及化学位移等因素的影响而升高[20-22]。另外,病变组患者股骨内侧髁、股骨外侧髁、内侧胫骨平台、外侧胫骨平台浅层软骨的T2*值均显著高于深层软骨(P<0.05)。这和研究报道相一致[23]:膝关节OA患者股骨内侧/外侧髁负重区的T2*值显著高于非负重区。分析原因,可能和关节软骨内生物化学成分以及生物力学的空间改变有关。本文结果还显示了病变组OA股骨内侧髁、外侧髁负重区的T2*值均显著高于负重区(P<0.05),导致该结果的主要原因可能在于:软骨的特征在于区域解剖结构由差异性胶原纤维组织产生,丰富的地带性差异可能表示骨关节炎软骨的成分以及结构变化的多面性,T2*弛豫时间受含水量、水分子和胶原纤维相互作用的影响,T2*值越高,反映了含水量越高,水分子的迁移率越高[24-26]。
综上所述,相比文献中常用的T2 mapping,T2*mapping的主要优势在于:时间分辨率提高,成像速度快(采集时间T2*mapping为2 min 30 s,T2 mapping为2 min 36 s);空间分辨率高,软组织对比度好,膝关节解剖结构显示清晰;中高信号的软骨层与其下面低信号的骨质对比鲜明,有利于病变的显示。本研究显示应用T2*mapping辅助MRI诊断技术对差异性膝关节OA软骨损伤程度患者的诊断价值较高,能有效为患者病情的评估提供可靠依据,具有较高的临床推广应用价值,T2*值有望成为差异性膝关节OA诊断和监测早期软骨退变的无创性影像学检查指标。不过,由于样本含量有限,还需要大数据、多中心等更多的科学数据来确定T2*值评估关节软骨退变的可靠性、有效性和潜在机制。