自拟活血壮骨汤对膝关节骨性关节炎大鼠作用机制研究∗
2020-06-15杨博鸿田聪阳张志清柴欣楼
杨博鸿 田聪阳 张志清 柴欣楼
(北京中医药大学,北京 100029)
膝骨性关节炎(KOA)是一种以疼痛及关节活动障碍为主要症状的疾病,是膝关节软骨和滑膜、肌肉、软骨下骨、皮质骨等膝关节软骨周围组织相互作用的结果[1]。由于关节软骨细胞是一种静止细胞,在一般情况下不会自我增殖、修复,因此临床治疗较为困难。目前,对于轻中度的KOA患者,以缓解疼痛、缓解软骨损伤、改善患者生活质量为主要治疗原则。中医学认为本病是由正气不足、肝肾亏损所致。本课题组自拟方活血壮骨汤由怀牛膝、川芎、当归、杜仲、桑寄生、狗脊组成,其中牛膝通而能补,性善下行,川芎活血行气止痛,当归补血活血止痛,杜仲、狗脊、桑寄生补肝肾强腰脊,诸药配伍具有补肾强骨、活血通络止痛的功效。本实验以木瓜蛋白酶诱导大鼠KOA模型为研究对象,研究活血壮骨汤的治疗作用并初步探讨其机制。
1 材料与方法
1.1 实验动物
SPF级健康雄性SD大鼠40只,体质量250 g,由北京斯贝福公司提供,动物合格证号SCXK(京)2016-0002。
1.2 试药与仪器
活血壮骨汤,组方:怀牛膝15 g,川芎10 g,当归12 g,杜仲11 g,狗脊15 g,桑寄生10 g。由北京同仁堂公司提供,北京中医药大学附属东直门医院制剂室制备,加工为含生药1 g/mL的汤剂。木瓜蛋白酶(BIOR-uler公司);L-半胱氨酸(Abfans公司),盐酸氨基葡萄糖胶囊(北京康必得药业有限公司,国药准字H20170173);酶联免疫吸附(ELISA)试剂盒(天津安诺瑞康有限公司);BP211D分析天平(德国赛多利斯有限公司);BS系类电子天平(上海友声衡器有限公司);游标卡尺(上海恒胜工具有限公司);YLS-7C足趾容积仪(广州市飞迪生物有限公司);ELX800酶标仪(美国伯腾仪器有限公司)。
1.3 分组与造模
40只大鼠随机分为5组,分别为空白组、模型组、活血壮骨汤低剂量组、活血壮骨汤高剂量组、阳性对照组,每组各8只。空白组不做任何处理,其他组用2%的木瓜蛋白酶溶液与0.03 mol/L的L-半胱氨酸溶液,按照2∶1的比例混合,将大鼠膝关节屈曲45°,以髌骨下极白色髌腱外缘的膝眼为进针点,向髁间窝方向穿刺进针,抵达股骨髁后回撤2 mm,每周注射2次,每次每个膝关节腔0.15 mL,连续4周。
1.4 给药方法
造模完成后开始灌胃给药,活血壮骨汤低剂量组予活血壮骨汤75 mg/(kg·d),活血壮骨汤高剂量组予活血壮骨汤300 mg/(kg·d),阳性对照组给予盐酸氨基葡萄糖药液157.5 mg/(kg·d),模型组、空白组给予等量的0.9%氯化钠注射液,每日1次,连续给药4周。
1.5 标本采集与检测
1.5.1 大鼠一般状况观察 于造模结束后和给药4周后,观察大鼠体征的变化,包括毛发、精神状况、活动情况等。
1.5.2 大鼠膝关节直径及足趾容积测量 于造模结束后和给药4周后,用游标卡尺对大鼠的膝关节直径进行测量集,对两个时期的关节直径进行比较;用足趾容积仪对大鼠的足趾容积进行测量集,对两个时期的足趾容积进行比较。
1.5.3 血清细胞因子的检测 连续给药4周后,大鼠腹腔注射10%的水合氯醛麻醉,采用腹主动脉取血的方法采集血样,3 000 r/min离心30 min,取100 μL上清液,用ELISA试剂盒测定血清白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)含量。
1.5.4 大鼠关节软骨组织病理学观察 采血后处死大鼠,取双侧膝关节,充分剥离皮肤肌肉之后置于4%多聚甲醛溶液中固定24 h,10%稀盐酸脱钙2~4 d,梯度脱水后石蜡包埋,行额状面切片(沿膝关节矢状面将胫骨内侧平台软骨下松质骨和股骨内侧髁软骨下松质骨沿下肢纵轴方向切片,厚度约5 μm),行染色,常规脱水、透明、封片处理。镜下用国际骨关节炎研究学会(OARSI)评分标准[2]对软骨组织病理学进行分级评分,所得评分越高,说明关节炎病变程度越高。
1.6 统计学处理
应用SAS8.2统计软件。计量资料以()表示,采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠一般状况观察
造模结束后,空白组的大鼠毛发整齐光滑,情绪不易激怒,纳食正常,活动未受限;模型组大鼠皮毛杂乱无章、无光泽,情绪急躁易怒,活动减少。给药4周后,活血壮骨汤低剂量组较空白组活动较少,下肢运动受限,易激怒程度较高,活血壮骨汤高剂量组以及阳性对照组皮毛有光泽,下肢运动轻微受限,情绪不易激怒。
2.2 各组大鼠膝关节直径比较
见表1。造模完成后,与空白组比较,模型组大鼠膝关节直径明显增大(P<0.05)。给药4周后,与模型组比较,各用药组大鼠膝关节直径值均降低(P<0.05);阳性对照组与活血壮骨汤高剂量组之间差异无统计学意义(P>0.05);活血壮骨汤低剂量组与阳性对照组以及活血壮骨汤高剂量组之间差异有统计学意义(P<0.05)。
表1 各组大鼠膝关节直径比较(mm,±s)

表1 各组大鼠膝关节直径比较(mm,±s)
与空白组比较,∗P<0.05;与模型组比较,▲P<0.05;与阳性对照组比较,#P<0.05。下同
组别空白组模型组活血壮骨汤低剂量组活血壮骨汤高剂量组阳性对照组n 8 8 8 8 8造模4周后7.165±0.097 8.050±0.092*8.103±0.110*8.118±0.114*8.126±0.128*给药4周后7.309±0.090▲#8.163±0.079#8.003±0.108▲#7.905±0.121▲7.873±0.149▲
2.3 各组大鼠足趾容积比较
见表2。造模完成后,与空白组比较,模型组大鼠足趾容积明显增大(P<0.01);给药4周后,与模型组比较,各用药组大鼠足趾容积均降低(P<0.05);各用药组之间,阳性对照组与活血壮骨汤高剂量组之间的差异无统计学意义(P>0.05);活血壮骨汤低剂量组与阳性对照组及活血壮骨汤高剂量组之间差异有统计学意义(P<0.05)。
表2 各组大鼠足趾容积比较(mL,±s)

表2 各组大鼠足趾容积比较(mL,±s)
组别空白组模型组活血壮骨汤低剂量组活血壮骨汤高剂量组阳性对照组n 8 8 8 8 8造模4周后1.431±0.028 1.644±0.031*1.641±0.029*1.629±0.020*1.626±0.023*给药4周后1.438±0.032▲#1.639±0.048#1.541±0.040▲#1.484±0.033▲1.475±0.038▲
2.4 各组大鼠血清炎症因子水平比较
见表3。给药4周后,与空白组比较,其余各组大鼠血清中TNF-α、IL-1β含量均升高(P<0.05);与模型组比较,各给药组大鼠血清TNF-α、IL-1β含量均降低(P<0.05);与阳性对照组比较,活血壮骨汤高、低剂量组血清TNF-α差异有统计学意义(P<0.05),活血壮骨汤高剂量组血清TNF-α水平显著低于阳性对照组及活血壮骨汤低剂量组(P<0.05)。与阳性对照组比较,活血壮骨汤高剂量组血清IL-1β含量差别不大(P>0.05),活血壮骨汤低剂量组的血清IL-1β含量高于阳性药组(P<0.05)。
表3 各组大鼠炎症因子水平比较(pg/mL,±s)
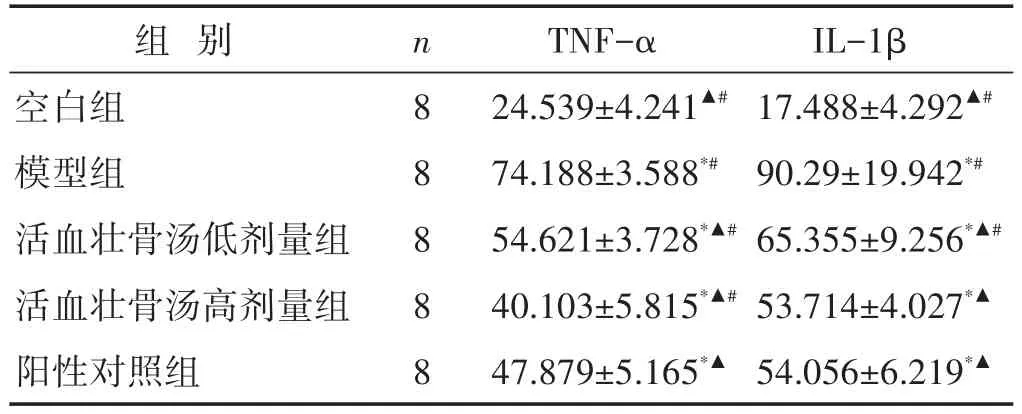
表3 各组大鼠炎症因子水平比较(pg/mL,±s)
组别空白组模型组活血壮骨汤低剂量组活血壮骨汤高剂量组阳性对照组n 8 8 8 8 8 TNF-α 24.539±4.241▲#74.188±3.588*#54.621±3.728*▲#40.103±5.815*▲#47.879±5.165*▲IL-1β 17.488±4.292▲#90.29±19.942*#65.355±9.256*▲#53.714±4.027*▲54.056±6.219*▲
2.5 病理切片观察结果
2.5.1 大鼠关节软骨甲苯胺蓝染色切片 见图1。空白组:甲苯胺蓝染色软骨表面平整光滑,表面无裂缝或者缺损,无骨赘的生成,软骨细胞形态正常,排列整齐,关节软骨4层结构清晰可辨,潮线清晰完整,软骨基质染色均匀成蓝色。模型组:关节软骨表面不平整,有缺损及裂缝,伴有骨赘的生成;关节软骨细胞形态异常,排列紊乱,各个层次不能清晰辨识出,潮线完全缺损,软骨细胞大量减少,出现大量空软骨陷窝,关节软骨染色不均匀,蛋白聚糖出现丢失。活血壮骨汤低剂量组:关节软骨表面相对于模型组较光滑平整,相对于正常组,软骨细胞形态较为异常,排列较为紊乱,潮线被破坏,部分部位出现关节软骨细胞的缺失,有相对较多的空软骨陷窝,基质染色不均匀,蛋白多糖出现丢失。活血壮骨汤高剂量组和阳性对照组:相较于模型组,软骨表面平整,细胞排列较为整齐,关节软骨4层结构基本清晰可见,潮线大致完整,染色较为均匀,缺损的蛋白多糖有所恢复。

图1 各组大鼠膝关节软骨组织病理切片(甲苯胺蓝染色,400倍)
2.5.2 大鼠关节软骨MASSON染色切片 见图2。空白组:MASSON染色软骨表面平整光滑,表面无裂缝或者缺损,无骨赘的生成;软骨细胞形态正常,排列整齐;关节软骨4层结构清晰可辨,潮线清晰完整,软骨基质染色均匀成蓝色。模型组:关节软骨表面不平整,有缺损及裂缝,伴有骨赘的生成;关节软骨细胞形态异常,排列紊乱,各个层次不能清晰辨识出,潮线完全缺损,软骨细胞大量减少,出现大量空软骨陷窝,关节软骨染色不均匀,胶原纤维出现丢失。活血壮骨汤低剂量组:关节软骨表面相对于模型组较光滑平整,相对于正常组,软骨细胞形态较为异常,排列较为紊乱,潮线被破坏,部分部位出现关节软骨细胞的缺失,有相对较多的空软骨陷窝,基质染色不均匀,胶原纤维出现丢失。活血壮骨汤高剂量组和阳性对照组:与模型组比较,软骨表面平整,细胞排列较为整齐,关节软骨4层结构基本清晰可见,潮线大致完整,染色较为均匀,缺损的胶原纤维有所恢复。
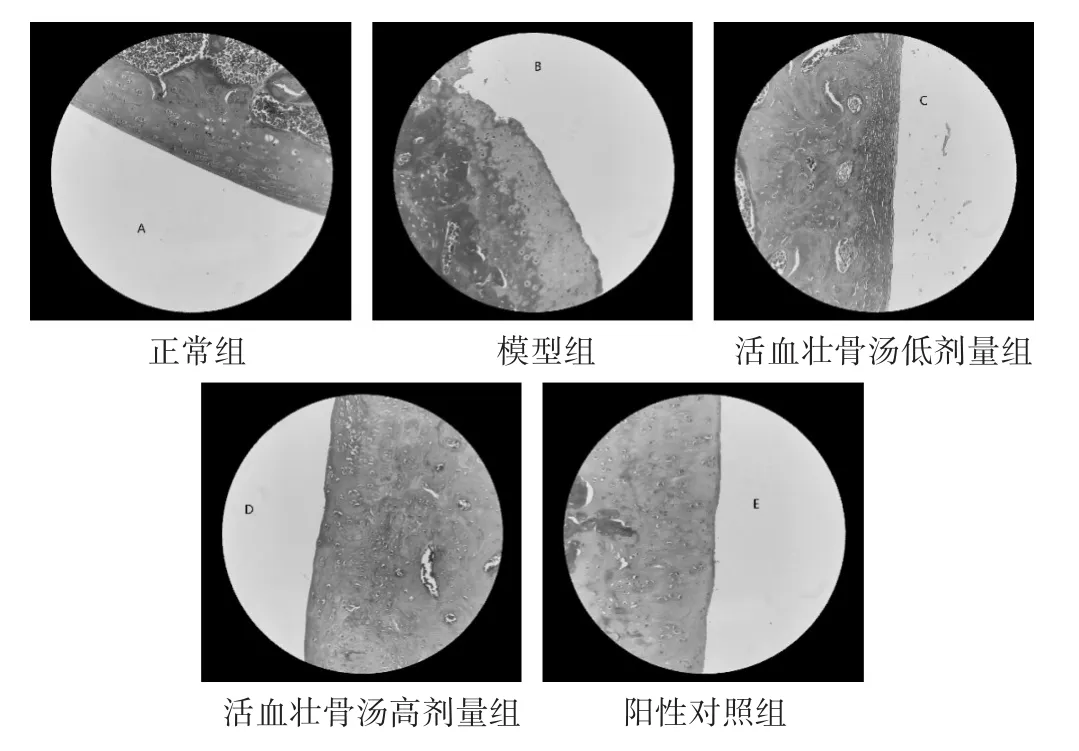
图2 各组大鼠膝关节软骨组织病理切片(MASSON染色,200倍)
2.6 大鼠膝关节软骨损伤OARSI评分
见表4。与空白组大鼠比较,其余各组大鼠膝关节软骨损伤OARSI评分均偏高(P<0.05)。其中活血壮骨汤高剂量组及阳性对照组的OARSI评分要明显低于活血壮骨汤低剂量组(P<0.05)。活血壮骨汤高剂量组与阳性对照组的OARSI评分比较,差异无统计学意义(P>0.05)。
表4 各组大鼠关节软骨损伤OARSI评分比较(分,±s)

表4 各组大鼠关节软骨损伤OARSI评分比较(分,±s)
组别空白组模型组活血壮骨汤低剂量组活血壮骨汤高剂量组阳性对照组n 8 8 8 8 8 OARSI评分0.32±0.41▲#★2.28±0.78*#1.83±0.54*▲#1.05±0.62*▲1.18±0.57*▲
3 讨 论
KOA主要病理表现为关节软骨的进行性退变,继发于炎症相关的增生和关节软骨细胞凋亡,女性的患病概率明显高于男性。KOA属中医学“骨痹”范畴,其发病与肝、脾、肾亏损及风、寒、湿、瘀血客于局部密切相关,最终导致局部气滞血瘀、脉络痹阻不通而发病[3]。临床大样本研究显示肝肾亏虚是KOA的基础证型,瘀血贯穿KOA的始终[4]。由此,可以认为KOA患者主要以肝肾亏损并且伴随气滞血瘀最为多见。在此基础上本课题组自拟活血壮骨汤,其组方原则立足于“不通则痛”与“不荣则痛”,通过其补肾、壮骨、强腰膝以及活血行气的功效达到治病求本的目的。研究表明,活血壮骨汤方中的杜仲、牛膝等药有抗炎作用,对骨关节炎患者起到骨保护作用[5-6]。
目前大鼠KOA模型的制备方法多种多样,大致以关节固定、关节腔注射药物、关节内手术、关节外诱导以及自发动物模型为主[7]。本研究采用的是关节腔内注射木瓜蛋白酶诱导骨关节炎,此方法操作简单方便,所用时间短,重复性好,并且与人类的骨关节炎相似[8]。通过实验结果得知,造模完成后的大鼠关节直径、足趾容积等与空白组比较差异均有显著性,提示造模成功。在运用活血壮骨汤干预后,活血壮骨汤高、低剂量组的膝关节直径、OARSI评分均低于模型组。结果证明,活血壮骨汤能减轻KOA大鼠的炎症反应,修复关节软骨损伤,并且与剂量呈正相关性。
普遍认为,KOA主要是由于关节磨损所导致的,但是越来越多的证据表明在KOA患者关节软骨组织、关节液以及血浆中具有高度表达的炎症因子[9-10]。持续存在的炎症也是KOA过程中导致关节软骨退变的重要驱动因素,其不仅可以引起关节软骨细胞合成和分解代谢失衡,而且还能导致关节软骨细胞的凋亡[11]。TNF-α是KOA发病的关键性的炎症因子之一,能协同IL-1β的作用,在骨关节炎的发生过程中起着决定性的作用[12]。TNF-α可以与IL-6协同作用,影响关节软骨合成蛋白多糖组分、蛋白糖胺聚糖以及Ⅱ型胶原蛋白。TNF-α还能促进关节软骨组织分泌基质金属蛋白酶-1(MMP-1)、基质金属蛋白酶-3(MMP-3)、基质金属蛋白酶-13(MMP-13),以及解聚蛋白样金属蛋白酶(ADAMTS-4)[13],这些可以导致关节软骨细胞的凋亡以及软骨祖细胞迁移障碍,这些都剥夺了关节软骨再生的可能[14]。TNF-α能降低呼吸链的效率,使关节软骨细胞产生的ATP减少,线粒体的膜电位降低[15]。IL-1β是KOA发病的关键性的炎症因子之一,它对关节软细胞代谢以及细胞外基质有着显著影响[16]。许多研究证实IL-1β可以阻碍软骨细胞合成细胞外基质,干扰关键结构蛋白的比如蛋白糖胺聚糖以及Ⅱ型胶原蛋白的合成[17]。除开对这些关键物质合成的阻碍作用外,还能促进基质金属蛋白酶MMPs的分泌来破坏关节软骨成分[18]。实验结果显示,活血壮骨汤高、低剂量组大鼠血清当中的TNF-α、IL-1β含量均比模型组低,提示活血壮骨汤可能通过抑制TNF-α、IL-1β的分泌发挥抗炎作用,起到改善症状的作用。活血壮骨汤可以减轻KOA的疼痛,修复关节软骨损伤,抑制炎症因子的分泌,可以成为KOA治疗的潜在方向。
