枯草芽孢杆菌对草鱼肝脏脂质代谢的调节作用
2020-06-12罗燕儿郭道远陈孝煊吴志新
罗燕儿 赵 慧 郭道远, 王 欢 陈孝煊, 吴志新
(1. 华中农业大学水产学院, 武汉 430070; 2. 湖北省水生动物病害防控工程技术研究中心, 武汉 430070; 3. 华中农业大学池塘健康养殖湖北省工程实验室, 武汉 430070; 4. 华中农业大学水产养殖国家级实验教学示范中心, 武汉 430070)
草鱼(Ctenopharyngodon idella)是我国重要的淡水养殖鱼类之一[1,2], 随着集约化养殖的发展, 脂肪肝在养殖草鱼中发病率不断上升, 已成为水产养殖业关注的严重问题[3]。“二次打击”学说在脂肪肝病的发病机制中受到认可并得到深入研究, 学说表明氧化应激在脂肪肝病发生发展进程中起重要作用[4]。嗜水气单胞菌(Aeromonas hydrophila)广泛存在于养殖水体中, 是淡水鱼类养殖过程中的主要致病菌。本实验室研究表明, 感染嗜水气单胞菌可降低草鱼抗氧化能力, 诱发肝脏脂质过氧化[5]和肝脏脂质沉积[6]。研究表明, 益生菌可显著减轻哺乳动物肝脏脂肪肝等症状, 改善肝功能[7,8]。益生枯草芽孢杆菌(Bacillus subtilis)广泛应用于水产养殖, 可调节水质[9]、增强水产动物的免疫力和抗氧化能力[5,10]、调节肠道菌群及增强消化酶活性[11,12]等,但对其在鱼类肝脏脂质代谢方面研究甚少。
因此, 本研究分别在感染嗜水气单胞菌前后投喂含益生枯草芽孢杆菌的饲料, 探究枯草芽孢杆菌对肝脏脂质代谢的作用及可能机制, 为益生菌在草鱼“保肝护肝”方面的作用提供依据。
1 材料与方法
1.1 实验菌株
实验用嗜水气单胞菌Ah1菌株分离自细菌败血症银鲫; 枯草芽孢杆菌Ch9菌株分离自草鱼肠道。以上菌株均有由华中农业大学水产学院水产动物医学实验室提供和保存。
1.2 实验饲料
本实验两种饲料配方及营养成分实测值见表1,饲料原料购自湖北海大饲料有限公司。饲料原料经粉碎后过60目筛, 制作含枯草芽孢杆菌的饲料时将枯草芽孢杆菌菌液代替无菌水, 所有原料混合均匀后经小型制粒机加工成直径为2.0 mm的颗粒饲料, 风干后置于-20℃冰箱中保存。采用平板计数法测定饲料中枯草芽孢杆菌的含量约为1×107CFU/g。

表1 实验饲料配方及基本成分Tab. 1 Compositions of experimental diets
1.3 实验设计
实验用草鱼购自湖北省黄冈市团风县百容水产良种有限公司。暂养4周后选取外观健康、规格一致的草鱼(50.53±0.70) g随机分配到12个容量为300 L的养殖缸(一共4个组, 每组3个重复), 每个缸投放密度为25尾。
实验分为4个组, 具体分组情况如表2所示, 实验开始时对照组每尾鱼腹腔注射0.1 mL 0.01mol/L灭菌PBS, 其余各组每尾鱼腹腔注射0.1 mL 1.0×106CFU/mL 嗜水气单胞菌菌液。嗜水气单胞菌的浓度为LC50的10%(半致死浓度为1×106CFU/fish)。实验用鱼均在华中农业大学水产学院养殖实验基地进行循环水养殖, 整个实验期间水质条件: 水温(25±1)℃、pH 7.5±0.3、溶解氧(7±0.45) mg/L、氨氮含量(0.015±0.002) mg/L以及亚硝酸盐氮(0.05±0.008) mg/L, 光周期为自然光周期。养殖实验持续56d, 每天饱食投喂饲料2次(8:30和16:30), 未吃完的剩余饲料在投喂之后的2h使用虹吸管收集, 并将其在烘箱中以60℃干燥12h至恒重, 以确定各组实验鱼的实际摄食量。
1.4 样品采集
分别在感染嗜水气单胞菌后的第28和第56天,将草鱼饥饿24h。用MS-222(10 mg/L)麻醉后, 将每缸鱼计数并称重。每组随机选择24尾鱼, 其中6尾鱼测量个体的体长、体重、内脏重量和肝脏重量,及从尾静脉取血以获得血清; 6尾鱼用于总RNA提取及抗氧化酶的测定; 6尾鱼用于肝脏脂质含量的测定; 6尾鱼取得的肝脏放入多聚甲醛固定液固定以备后续冰冻切片。
1.5 样品分析
脂肪含量的测定及油红染色分析脂肪含量的测定: 将肝脏样品在-50℃冷冻干燥24h, 然后用索氏抽提法测定肝脏的粗脂肪含量。
油红O染色分析: 用于油红O染色的肝脏样本用多聚甲醛固定48h后, 进行脱水、包埋、切片(厚度8 μm)、染色和拍照。从每个样本中随机选取10个视野, 用Image-Pro Plus 6.0软件计算肝组织中染成红色的脂滴的相对面积, 采用双盲法统计各图,汇总得到结果。
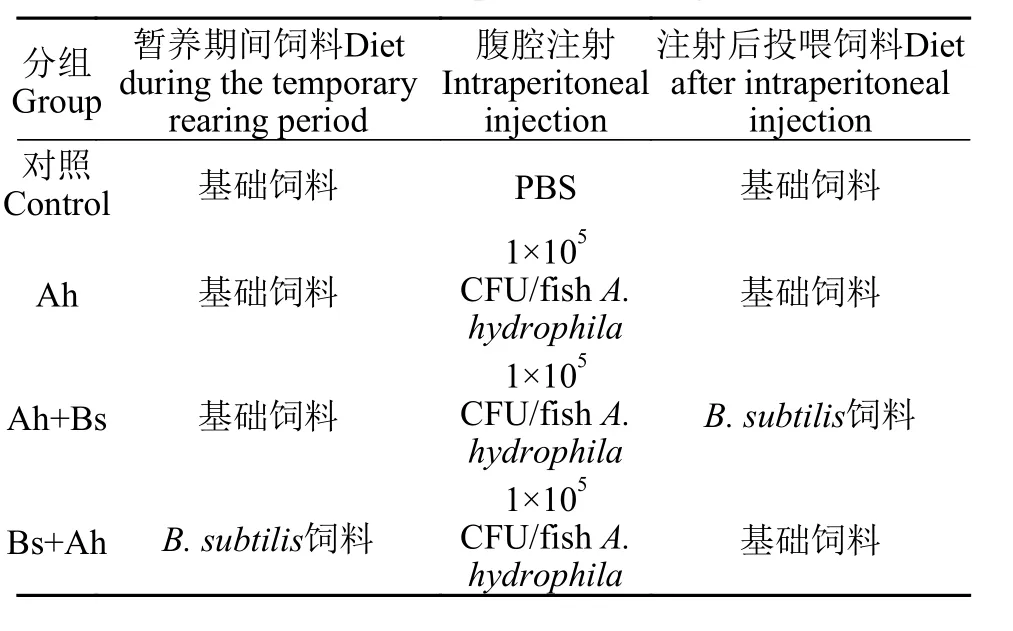
表2 实验分组设计Tab. 2 The experimental design
血清生化指标测定血清胆固醇(CHO)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)含量以及血清谷草转氨酶(AST)、谷丙转氨酶(ALT)活性采用荷兰威图全自动生化分析仪测定, 试剂盒均购自中生北控生物科技股份有限公司。
脂质代谢相关基因表达分析从草鱼肝脏中提取RNA, 然后反转录为cDNA, 以β-肌动蛋白(βactin)为内参, 使用Roche Light Cycler 480 real-time PCR仪进行实时荧光定量PCR, 引物见表3(由武汉天一辉远生物科技有限公司合成)。反应总体系为20 μL, 包括cDNA 2 μL、上下游引物各0.5 μL、焦碳酸二乙酯(Diethylpyrocarbonate, DEPC)水7 μL、2×SYBR Green qPCR Mix 10 μL(Aidlab, PC5902)。
抗氧化指标测定取得的肝脏样品在冰上解冻后, 制成匀浆液, 用于测定总抗氧化能力(TAOC)、超氧化物歧化酶(SOD)、氧化氢酶(CAT)、还原型谷胱甘肽(GSH)、丙二醛(MDA)、过氧化氢(H2O2), 以上指标均按照试剂盒说明书进行检测,试剂盒均购自南京建成生物工程研究所。
生长性能及形体指标数据计算成活率(Survival rate,SR, %)=100×(终尾数/初尾数)
体增重率(Weight gain rate,WGR, %)=100×(末体重-初体重)/初体重
特定生长率(Special growth rate,SGR, %/d)=100×(Ln末体重-Ln初体重)/饲养天数
摄食量(Feed intake,FI, g/fish)=饲料消耗量(g,干重)/鱼数量
饲料系数(Feed conversion rate,FCR)=每缸投喂饲料总量/每缸鱼体总增重量
肥满度(Condition factor,CF, g/cm3)=100×体重(g)/[体长(cm)]3
肝胰脏指数(Hepatosomatic index,HSI, %)=100×肝重(g)/体重(g)
内脏指数(Viscera index,VSI, %)=100×内脏重(g)/体重(g)

表3 RT-PCR引物序列Tab. 3 Primers used for real-time PCR
1.6 统计分析
实验数据用平均值±标准误(Mean±SEM)表示,采用SPSS 22.0软件进行处理, 相同取样天数的不同分组采用单因素方差分析, 差异显著时通过Duncan’s检验方法进行多重比较, 以P<0.05为差异显著性标准。比较同一分组的两个取样时间点之间的显著性采用独立样本T检验, 以P<0.05为差异显著性标准。
2 结果
2.1 枯草芽孢杆菌对草鱼生长性能、摄食量及形态学参数的影响
如表4所示, Ah+Bs组及Bs+Ah组WGR、SGR于第28d和第56天时, 均显著高于Ah组(P<0.05), 并于第56天时显著高于对照组(P<0.05), 且Ah+Bs组FCR显著低于Ah组(P<0.05)。在两个取样时间点,CF、HSI和VSI在各组之间无显著差异(P>0.05,表5)。
2.2 枯草芽孢杆菌对草鱼肝脏脂肪含量的影响
经染色后, 脂质呈红色, 细胞核呈蓝色。图1中油红O染色结果(A-H)及对油红O染色的脂滴所占相对面积统计结果(图1-I)显示, 28d时油红O染色的脂滴面积在Ah组显著增加(P<0.05), 而在Bs+Ah组及Ah+Bs组变化无统计学差异(P>0.05);第56天时各组脂滴面积无显著差异(P>0.05)。图1-J为肝脏脂肪含量测定结果: 第28天时, Ah组的脂肪含量显著高于对照组(P<0.05), Ah+Bs和Bs+Ah组脂肪含量与Ah组相比显著降低(P<0.05)。第56天时, 各组肝脏脂肪含量均无统计学差异(P>0.05)。对照组、Bs+Ah组及Ah+Bs组在第56天时的肝脏脂肪含量显著高于第28天时的脂肪含量(P<0.05)。

表4 益生枯草芽孢杆菌对草鱼生长性能及摄食量的影响Tab. 4 Effects of B. subtilis on growth performance and food intake of grass carps

表5 益生枯草芽孢杆菌对草鱼形态学参数的影响Tab. 5 Effects of B. subtilis on morphological parameters of grass carps
2.3 枯草芽孢杆菌对草鱼血清生化指标的影响
如表6所示, 第28天时, TG和HDL-C含量在Ah+Bs组较Ah组有升高的趋势, 在Bs+Ah组显著高于Ah组(P<0.05); AST活性在Ah+Bs组较Ah组显著降低(P<0.05); 此外, TG、HDL-C含量及AST活性在Ah+Bs及Bs+Ah组与对照组均无显著差异(P>0.05)。第56天时, CHO、HDL-C和LDL-C含量在Bs+Ah组较Ah组显著升高(P<0.05), 在Ah+Bs组有升高的趋势, 且均与对照组无显著差异(P>0.05)。AST和ALT活性在Ah组显著高于对照组(P<0.05),而在Ah+Bs和Bs+Ah组则与对照组无显著差异(P>0.05)。
2.4 枯草芽孢杆菌对草鱼肝脏脂代谢相关基因表达的影响
如图2所示, 第28天时, Ah组ACCα表达水平较对照组显著上调(P<0.05),LPL、ATGL、SREBP-1c、PPARγ表达水平显著下调(P<0.05), 但这些基因表达水平在Ah+Bs及Bs+Ah组较对照组无显著差异(P>0.05)。PPARα表达水平在Ah+Bs和Bs+Ah组均较Ah组显著上调(P<0.05)且与对照组比无显著差异(P>0.05)。第56天时,FAS、ACCα、CPTIα1a、HSL、SPEBP-1c、PPARγ、PPARα的表达水平在Ah组显著下调(P<0.05), 但在Ah+Bs和Bs+Ah组较Ah组显著上调或有上调的趋势。与对照组比,ATGL表达水平在Ah组有下调的趋势; 但在Ah+Bs组和Bs+Ah组较Ah组显著上调(P<0.05)。
2.5 枯草芽孢杆菌对草鱼肝脏抗氧化能力的影响
如图3所示, 第28天时CAT、SOD活性及第56天时T-AOC, 在Ah组较对照组显著降低(P<0.05), 在Ah+Bs组和Bs+Ah组较Ah组显著升高(P<0.05)。第28天时, GSH含量在Bs+Ah组较Ah组显著升高(P<0.05); H2O2含量在Ah组显著升高(P<0.05), 在Bs+Ah组显著低于Ah组(P<0.05)。Ah组MDA含量在两个取样时间点均显著高于对照组(P<0.05), 在Ah+Bs组和Bs+Ah组与对照组无显著差异(P>0.05)。
3 讨论
3.1 枯草芽孢杆菌对草鱼生长性能及形态学参数的影响
本研究表明, 感染嗜水气单胞菌28d后, 草鱼WGR、SGR有下降的趋势,FCR有增加的趋势。非洲鲶(Clarias gariepinus)在感染嗜水气单胞菌后, 其SGR显著下降,FCR显著增加[13], 与本研究结果一致。本研究投喂益生菌饲料的草鱼表现出更好的生长性能, 且在第56天时Ah+Bs组的FCR最小, 表明在饲料中添加枯草芽孢杆菌Ch9能促进草鱼生长,提高饲料的效率。在点带石斑鱼(Epinephelus coioides)[14]、里海鳟(Salmo caspius)[15]等鱼类也有类似的报道。这可能是与芽孢杆菌能够提高消化酶活性以及能产生酶, 减少抗营养因子, 提高动物对营养的利用等有关[11,16,17]。

图1 益生枯草芽孢杆菌对草鱼肝脏脂质沉积的影响Fig. 1 The effect of B. subtilis on hepatic lipid content in grass carp
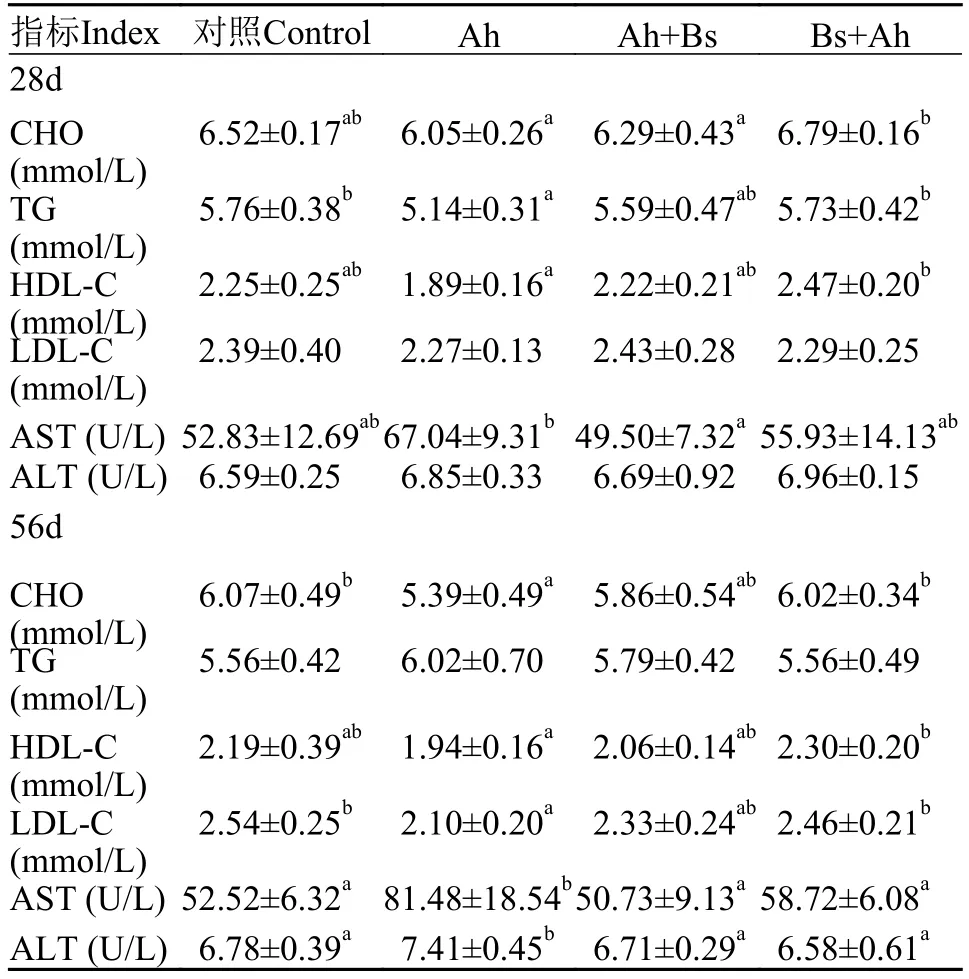
表6 益生枯草芽孢杆菌对草鱼血液生化参数的影响Tab. 6 Effects of B. subtilis on blood biochemical parameters of grass carps
3.2 枯草芽孢杆菌对草鱼肝脏脂肪含量的影响
肝脏的脂肪含量及油红染色结果表明, 嗜水气单胞菌能够造成草鱼肝脏的脂质积累, 而通过饲料中添加枯草芽孢杆菌可以改善这种状况, 减少脂质在草鱼肝脏中的积累。具体体现为第28天时, Ah+Bs和Bs+Ah组草鱼肝脏脂肪含量显著低于Ah组, 且与对照组肝脏脂肪含量处于同一水平。在哺乳动物中, 已经有许多文献表明一些益生菌能减少肝脏中脂质的积累, 治疗脂肪肝病[18—20]。在鱼类中,Shewanella属的两个益生菌菌株(Pdp11及Pdp13)及鼠李糖乳杆菌(Lactobacillus rhamnosus)在降低肝脏脂质方面也有很大潜力[21—24]。
3.3 枯草芽孢杆菌对草鱼血清生化指标的影响
肝脏在脂质代谢过程中具有许多作用(如摄取、转运、合成及分解等), 进入肝脏的脂肪酸, 能酯化成为TGs, 并能以脂滴的形式储存在肝细胞中,或者以富含TGs的脂蛋白的形式分泌到血液中[25];当肝细胞受到一定的损害时, 脂类代谢的平衡会被打破, 并影响血清中的血脂水平[26]。因此, 血脂水平等血清生化指标可以在一定程度上反映出肝脏的健康状态和机体脂质代谢等状况。本研究血清生化指标结果显示, 在注射嗜水气单胞菌后第28天,TG显著降低, 至第56天时CHO和LDL-C显著降低,HDL-C也有降低的趋势; 而投喂枯草芽孢杆菌饲料, 均能使血脂恢复到与对照组相同的水平。另外,在添加枯草芽孢杆菌后, 血清中AST和ALT活性较Ah组显著下降, 表明枯草芽孢杆菌Ch9可能减少了嗜水气单胞菌对肝脏的损害。已有研究表明, 鼠李糖乳杆菌、粪肠球菌(Enterococcus faecalis)能降低罗非鱼血清中AST和ALT的活性[27]。对尼罗罗非鱼(Oreochromis niloticus)饲喂含有枯草芽孢杆菌的饲料, 血清中AST和ALT活性显著下降[28]。因此,枯草芽孢杆菌在减少因嗜水气单胞菌的感染对肝脏的损伤及其对脂质代谢的影响, 改善因嗜水气单胞菌感染造成的血脂下降方面具有一定潜力。

图2 益生枯草芽孢杆菌对草鱼肝脏脂代谢基因表达的影响Fig. 2 Effects of B. subtilis on mRNA levels of lipid metabolism genes of grass carp
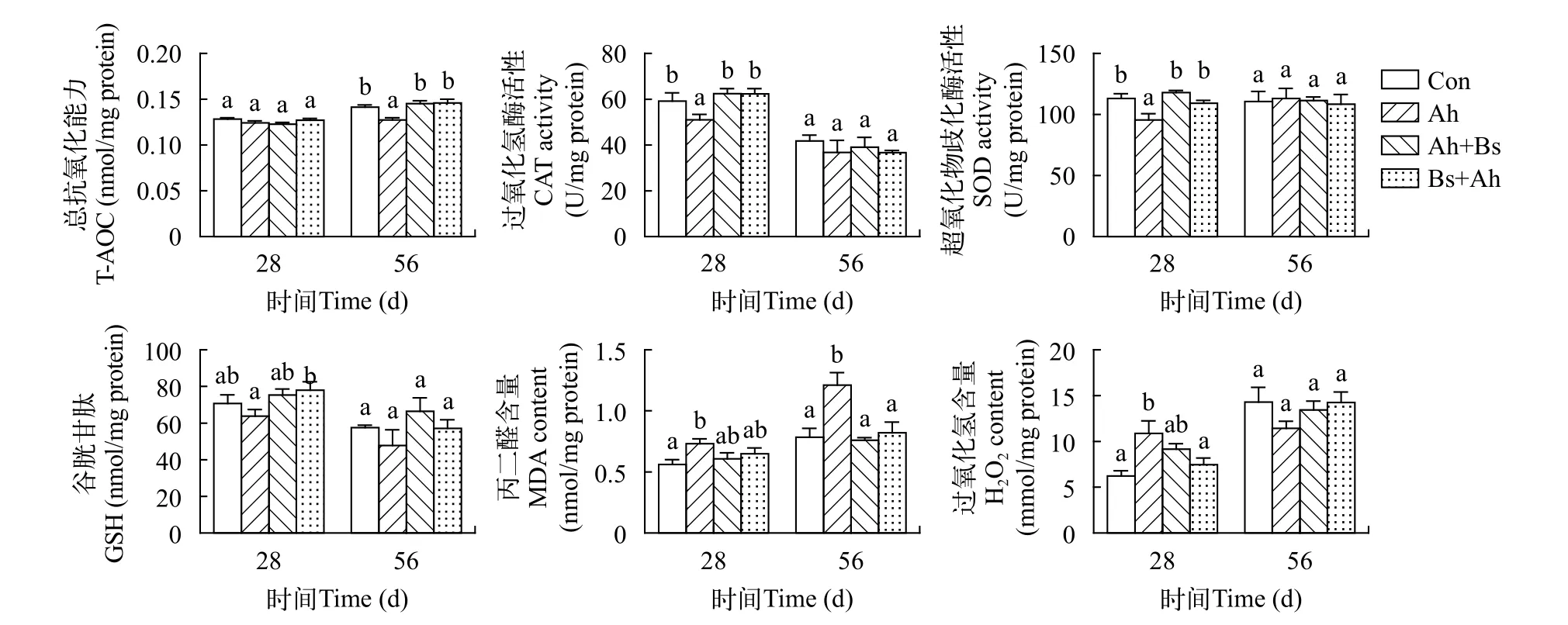
图3 益生枯草芽孢杆菌对草鱼肝脏抗氧化酶活性及MDA和H2O2含量的影响Fig. 3 Effects of B. subtilis on activities of antioxidant enzymes and content of MDA and H2O2 in grass carp
3.4 枯草芽孢杆菌对草鱼肝脏脂代谢相关基因表达的影响
为分析感染嗜水气单胞菌及投喂枯草芽孢杆菌饲料对草鱼肝脏脂肪合成、分解与调控相关基因mRNA表达水平的影响, 采用qPCR技术检测草鱼肝脏脂代谢相关基因mRNA表达水平。重要的脂肪生成相关酶, 如FAS、ACC, 以及重要的转录因子SREBP-1c和PPARγ可以促进肝脏脂质的合成;PPARα可诱导CPTI表达, 促进脂肪酸分解;HSL、ATGL、LPL均参与脂肪的水解[29—36],FAT/CD36除了与脂肪酸转运相关, 还在脂肪酸氧化代谢过程中发挥了重要作用[37—39]。本研究表明, 投喂枯草芽孢杆菌在维持肝脏正常脂质代谢方面具有一定作用。第28天时Ah组ACCα较对照组显著地上调,LPL、ATGL、FAT/CD36显著地下调, 血清TG在第28天显著降低, 表明感染嗜水气单胞菌诱导草鱼脂质合成增加、脂质分解及输出减少, 导致肝脏脂质积累; 在投喂枯草芽孢杆菌后,ACCα的mRNA表达水平较Ah组下调, 甘油三酯水解相关酶LPL及ATGLmRNA表达水平均上调, 并与对照无显著差异。因此脂肪酸合成的减少及脂质分解的增加造成了Bs+Ah组及Ah+Bs组脂肪含量低于Ah组且与对照无显著差异。相关研究表明, 高脂饲料诱导的脂肪肝罗非鱼LPL表达水平显著下调, 在高脂饲料中添加垂盆草提取物后则显著上调LPL表达水平[3];用咖啡因治疗斑马鱼(Danio rerio)的脂肪肝, 其肝脏ACC1表达水平显著地下调[40], 这些均与本研究相似。56d时Ah组FAS、ACCα、CPTIα1a、HSL、SPEBP-1c、PPARγ和PPARα表达水平较对照均显著地下调, 表明Ah组肝脏脂质合成和分解均减少,脂质代谢异常。在投喂Cu过量饲料后, 黄颡鱼ACCα和ATGL表达水平均显著下调, 而肝脏脂肪含量减少[41], 与本研究结果相似。在投喂枯草芽孢杆菌饲料后, 这些基因表达与对照无显著差异, 表明在感染嗜水气单胞菌前后投喂枯草芽孢杆菌饲料均能够减少因感染嗜水气单胞菌对草鱼脂质代谢的影响。
3.5 枯草芽孢杆菌对草鱼肝脏抗氧化能力的影响
许多外源因素能诱导体内形成过氧化环境, 导致自由基浓度升高, 进而干扰肝脏脂类代谢、破坏细胞功能, 最终形成肝脏脂质积累, 破坏肝脏功能[4]。因此, 氧化应激和氧化还原平衡的改变在肝脏脂肪变性的发病机制中起着至关重要的作用[42]。TAOC是评价机体抗氧化能力的重要指标[43]。SOD、CAT、GSH是一类重要的抗氧化酶, 在保护细胞免受氧化应激、预防或修复氧化损伤方面发挥着重要作用, 如SOD能催化转化为H2O2, 而CAT则能清除H2O2[44]。MDA是脂质氧化损伤的重要产物,可用于评估脂质过氧化程度[5,45]。实验结果表明,饲喂含有枯草芽孢杆菌的饲料后, 草鱼抗氧化能力显著提高, 主要反映在肝脏SOD、GSH、CAT、TAOC较Ah组显著提高; MDA及H2O2含量较Ah组低。已有的研究表明益生菌能够提高鱼类的抗氧化能力: 投喂含有枯草芽孢杆菌的饲料8周后, 团头鲂(Megalobrama amblycephala)幼鱼肝脏SOD、CAT、GSH-PX的活性显著升高, MDA含量显著降低[46]; 在饲料中补充德氏乳杆菌(Lactobacillus delbrueckii)投喂8周后, 黄河鲤(Cyprinus carpioHuanghe var)肝脏SOD、CAT、GPX活性及T-AOC显著升高, MDA含量显著降低[47]。因此, 枯草芽孢杆菌能提高草鱼肝脏的抗氧化能力, 减少组织氧化应激的发生, 降低感染嗜水气单胞菌对肝脏的损害。
4 结论
以上结果表明, 在饲料中添加枯草芽孢杆菌可减少嗜水气单胞菌感染对草鱼肝脏功能的损害, 有利于调节肝脏正常的脂质合成、分解、转运等功能, 减少脂质在肝脏中的积累, 并促进草鱼的生长及降低饲料系数。
