RU486通过Notch1/Hes-1信号通路对糖尿病大鼠视网膜神经节细胞的保护作用及机制研究*
2020-06-11刘文强刘学政左中夫
刘文强,刘学政,左中夫
锦州医科大学基础医学院解剖学教研室(锦州 121001)
体内糖皮质激素(Glucocorticoid,GC)含量增加为糖尿病的重要表现之一[1]。有学者报道,小剂量GC治疗糖尿病视网膜病变(Diabetic retinopathy,DR)具有明显的疗效,但过量或延长使用疗程会引起眼内并发症[2]。本研究前期研究发现,应用RU486对抗体内过多的GC可改善DR状态下视网膜神经节细胞(Retinal ganglion cell,RGC)损伤[3],但具体机制不清。Notch1与神经元受损后修复密切相关,与Mash-1基因、Hes-1基因联系密切[4]。因此,本研究在应用RU486的情况下加用Notch1通路抑制剂,进而探讨RU486治疗DR的具体机制。
材料与方法
1 实验动物与试剂仪器 雄性SD大鼠40只,体质量220~250g (购自锦州医科大学,0000455)。链脲佐菌素(Streptozotocin,STZ,Sigma);大鼠内源性GC试剂盒(上海信帆公司);HE 染色试剂盒(碧云天公司) ;Notch1、Hes-1、GAP-43抗体( Abcam公司);免疫荧光、Western 印迹二抗(PTG公司)。荧光倒置显微镜(日本Olympus公司);冰冻切片机(德国SLEE公司);水平电泳仪(美国BIO-RAD公司)。
2 研究方法
2.1 动物分组及模型制备:大鼠随机分成对照组(CON)、糖尿病组(DM)、RU486治疗组(RU486)及RU486+DAPT组四组,每组10只。后三组大鼠按50 mg/kg腹腔注射STZ,72 h后测血糖,将血糖浓度大于16.7 mmol/L的大鼠定为糖尿病模型。以二甲基亚砜 (Dimethyl sulfoxide,DMSO)溶解RU486,参照文献[5],RU486组及RU486+DAPT组大鼠腹腔注射RU486,注射剂量为20 mg/(kg·d),RU486+DAPT组给予DAPT 5 μl(10 μmol/L)玻璃体内注射给药(双侧眼球均给药)[6],CON组及DM组给予等剂量DMSO,12周后进行各项指标检测。实验遵循国家《实验动物管理条例》。
2.2 样本制备:12周后,在各组大鼠尾静脉取血3 ml,5000 r/min离心30 min后取上清,运用ELISA法,检测血清GC浓度,操作按试剂盒说明书执行。每组取5只大鼠,固定后取出眼球,石蜡包埋切片,厚度为5 μm,常温保存,用于免疫荧光及HE染色。每组另取5只大鼠取视网膜,裂解,冰上剪碎,冰上静置30 min 后4℃以2000 r/min离心25 min,留上清,-20℃保存用于Western 印迹。
2.3 免疫荧光检测大鼠视网膜Notch1表达:经2.2制备的脱蜡后切片浸于PBS洗涤3次,每次3 min;3%山羊血清+0.3% Triton-100室温孵育1 h;不洗,滴加兔抗大鼠Notch1(1∶500),4℃过夜;PBS洗涤4次,每次3 min;滴加荧光二抗,常温1 h;PBS洗涤4次,每次3 min;封片后荧光显微镜观察。
2.4 Western 印迹检测Notch1、Hes-1、GAP-43蛋白相对表达:取2.2制备的上清,BCA法测蛋白浓度并制样,电泳分离后转入PVDF膜,1%BSA室温封闭2 h。一抗(兔抗大鼠Notch1,1∶10000;兔抗大鼠Hes-1,1∶5000 ;小鼠抗大鼠GAP-43,1∶20000),4℃摇床杂交过夜。二抗室温2 h。ECL显色,以β-Tubulin为内参,Image J软件分析灰度值。
2.5 HE染色检测RGC密度:经2.2制备的切片浸于PBS洗涤3次,每次3 min;滴加苏木素,2 min;PBS中1 min,自来水冲洗;95%酒精1 min;伊红浸染,2 min,自来水冲洗;脱水透明后封片,拍照后应用Image J 软件计数RGC数量并转化成密度。
结 果
1 各组大鼠血清GC水平检测结果 四组血清GC相比,总体具有统计学差异(F=75.36,P< 0.05)。与CON组相比,DM组、RU486组及RU486+DAPT组血清GC浓度明显增加(P< 0.05),而DM组、RU486组及RU486+DAPT组之间比较无统计学差异(P> 0.05)。见表1。
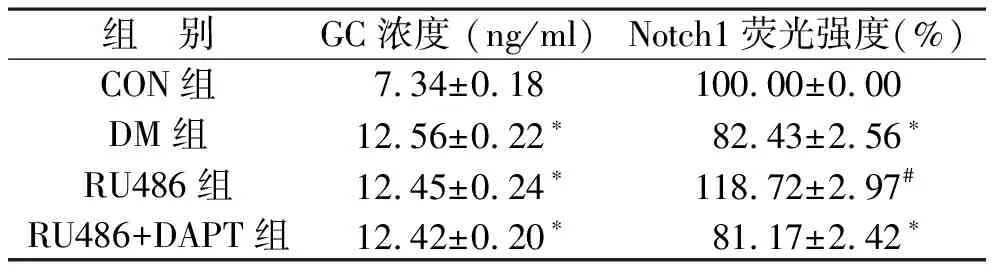
表1 各组大鼠血清GC和视网膜Notch1荧光强度
注:与CON组相比,*P<0.05;与DM组相比,#P<0.05
2 免疫荧光检测各组大鼠视网膜Notch1的表达 将CON组Notch1蛋白免疫荧光强度设定为100.00%,四组之间相比,总体具有统计学差异(F=245.73,P< 0.05)。与CON组相比,DM组及RU486+DAPT组Notch1表达明显降低,而与DM组相比,RU486组Notch1表达明显增加 (均P<0.05),而DM组与RU486+DAPT组之间比较无统计学差异(P> 0.05)(图1)。见表1。
3 Western 印迹检测视网膜Notch1、Hes-1、GAP-43蛋白相对表达量 与CON组相比,DM组及RU486+DAPT组GAP-43表达有所增加,Notch1和Hes-1表达明显降低(均P< 0.05)。与DM组相比,RU486组Notch1、Hes-1及GAP-43表达均明显增加(均P< 0.05)(图2),见表2。
4 HE染色检测视网膜RGC 四组之间相比总体具有统计学差异(F=1264.82,P< 0.05)。与CON组相比,DM组及RU486+DAPT组RGC密度明显降低(P< 0.05)。

A:CON组;B:DM组;C:RU486组;D:RU486+DAPT组;GCL:节细胞层;INL:内核层
图1 免疫荧光检测Notch1在视网膜的表达(×200)
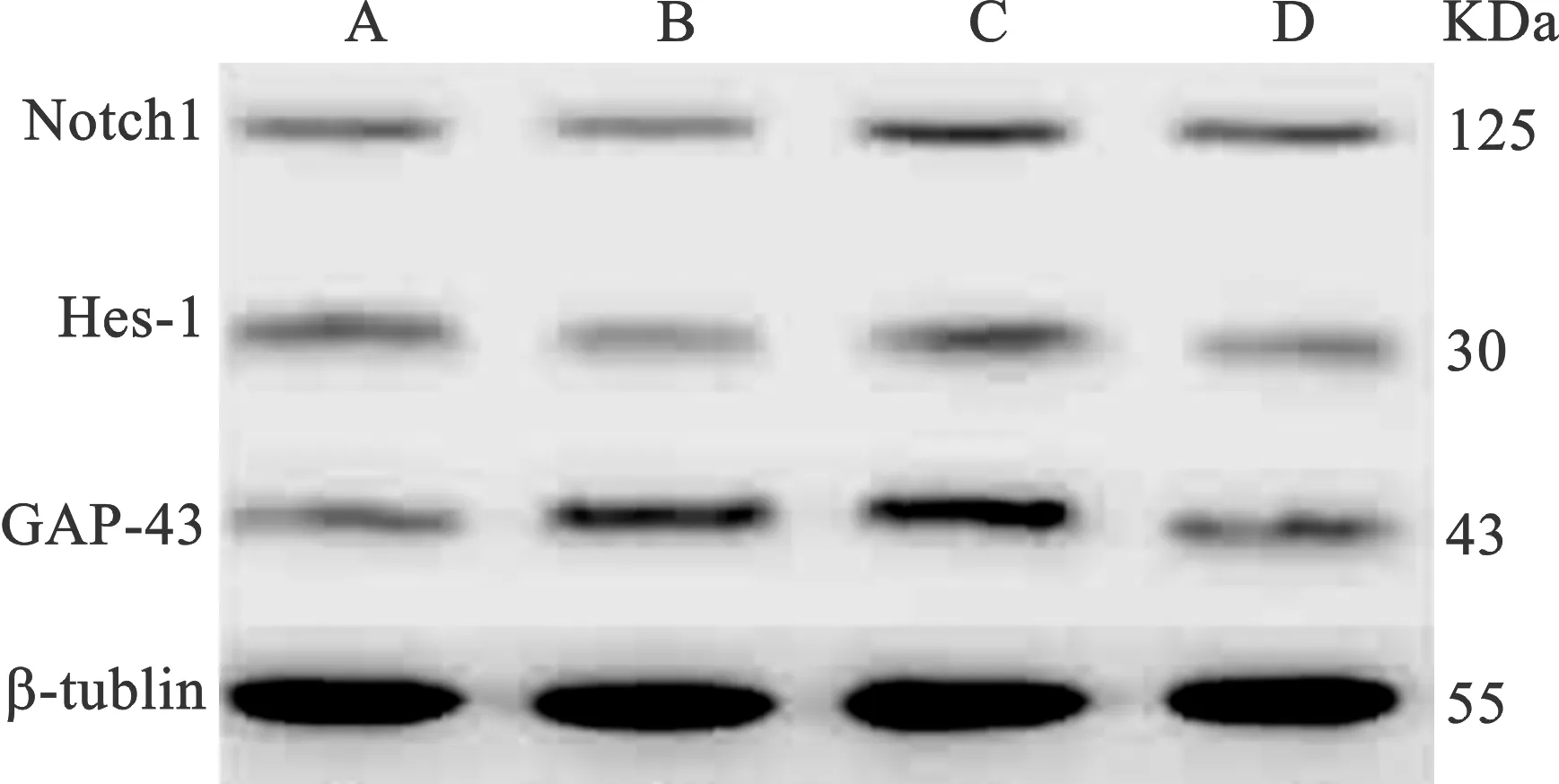
A:CON组;B:DM组;C:RU486组;D:RU486+DAPT组
图2 Western 印迹检测视网膜Notch1、Hes-1、GAP-43蛋白相对表达
与DM组相比,RU486组RGC密度明显增加(P< 0.05),而DM组与RU486+DAPT组之间比较无统计学差异(P> 0.05)。见表2、图3。
表2 各组大鼠视网膜Notch1、Hes-1、GAP-43蛋白相对表达和 RGC密度
注:与CON组相比,*P<0.05;与DM组相比,#P<0.05
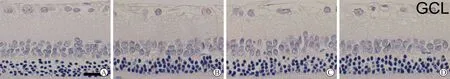
A:CON组;B:DM组;C:RU486组;D:RU486+DAPT组;GCL:节细胞层
讨 论
DR可引起RGC凋亡甚至死亡,表现为RGC数量的减少[7]。RGC轴突形成视神经,RGC损伤会影响患者的视力。因此,促进RGC再生增加其数量对防治DR尤为重要[8]。正常情况下,体内GC的增加会反馈于下丘脑、垂体,进而减少GC的释放。然而DR状态下,HPA轴反应性降低,GC对HPA轴负反馈作用减弱,促使GC浓度进一步增加[9]。RU486为GC的竞争性抑制剂,可阻碍GC与受体的结合,进而拮抗GC的作用。本研究发现,DR时血清GC浓度异常升高,RGC密度明显减少。RGC密度的降低可能由高血糖所致,亦可能由GC浓度的增加引起GC的慢性损伤所致。而RU486治疗后,RGC密度较DM组有所提高,提示针对GC的治疗对改善RGC损伤是有益的。有研究发现,针对STZ诱导的1型糖尿病大鼠给予RU486治疗9 d后,可明显改善糖尿病引起的认知功能障碍[10]。亦有研究证实RU486对抑制糖尿病引起的实验性牙周炎具有较好的缓解作用[11]。因此,RU486针对糖尿病引起的GC浓度诱导的多种并发症具有很好的疗效。GAP-43为神经元再生的首选标志物,在神经元受损时表达明显上调[12]。本研究发现,DR时GAP-43表达有所提高,这可能是RGC对损伤的反应,这可能为RGC再生提供了条件。而应用RU486治疗后,GAP-43表达明显增加,伴随着RGC密度亦明显增多,提示针对GC浓度的增加进行治疗,可能促进RGC的再生,进而增加RGC密度。
Notch1信号可调节神经元生长,与神经元受损后的修复及再生密切相关[4]。通过上调Notch1表达,有助于周围神经元再生。本课题组前期发现,DR状态下Notch1信号通路受到抑制,激活该通路可上调视网膜GAP-43表达,下调Caspase-3表达,进而提高RGC的存活。本研究发现,与CON组相比,DM组Notch1表达明显下降,同时Notch1下游的关键位点Hes-1表达亦下降,这提示DR损伤会造成Notch1通路的抑制。而应用Notch1通路的抑制剂DAPT后RU486的治疗作用被逆转。因此,可以证实,RU486主要通过激活Notch1信号通路保护受损的RGC。
综上所述,DR状态下,Notch1通路的抑制会引起RGC密度的降低,而应用RU486后,可明显改善DR时的RGC损伤。进一步在RU486基础上加用Notch1通路的抑制剂DAPT后可逆转RU486的作用。这提示RU486对DR状态下RGC的保护作用与激活Notch1/Hes-1信号通路有关。
