IL-33在小鼠皮肤创伤后损伤时间推断中的作用
2020-06-11姚艺黄俊杰金馨赵建新夏崇建童彦高原喻林升范琰琰
姚艺 ,黄俊杰 ,金馨 ,赵建新 ,夏崇建 ,童彦 ,高原 ,喻林升 ,范琰琰
(1.温州医科大学法医学系,浙江 温州 325035;2.温州医科大学司法鉴定中心,浙江 温州 325035;3.温州医科大学司法鉴定科学技术研究所,浙江 温州 325035)
皮肤是人体最大的器官,主要承担着保护机体的重要生理功能。在法医学研究中,皮肤损伤时间的准确推断能为案件性质的界定和侦破提供线索。近年来,积极寻找与皮肤损伤愈合进程相关的指标成为法医学领域研究的重要任务之一。
皮肤损伤愈合过程复杂,有多种细胞因子和转录因子参与,涉及炎症反应、成纤维细胞增殖及新生毛细血管的生成。在炎症阶段,中性粒细胞和单核细胞释放的炎症细胞因子起关键作用[1]。既往研究[2]结果表明,细胞因子如白细胞介素-1β(interleukin-1β,IL-1β)、IL-6和肿瘤坏死因子α(tumor necrosis factorα,TNF-α)在皮肤损伤愈合过程中呈现动态变化,可作为推断损伤时间的指标。IL-33是一种IL-1细胞因子超家族成员,在人类皮肤组织细胞高表达[3],是一种可被多种组织释放的前炎症因子[4]。同时,IL-33也是上皮组织修复的重要介质,通过促进上皮细胞增殖或迁移从而促进创口愈合[5],但其在皮肤创伤愈合过程中表达量的时间依赖性尚不明确。
在法医学实践中,除了皮肤擦伤和挫伤,缺损性皮肤损伤也较为常见,本研究采用皮肤打孔方式制作皮肤缺损性损伤模型,观察IL-33在小鼠皮肤损伤模型中的表达规律和分布特性,探讨IL-33在皮肤创口愈合过程中的作用及其在创口形成时间推断中的参考价值。
1 材料与方法
1.1 样本
成年普通ICR雄性小鼠50只,年龄8~10周,体质量25~30 g,由温州医科大学实验动物中心提供。本实验经温州医科大学伦理委员会审核通过,符合《实验动物 福利伦理审查指南》要求。
1.2 小鼠皮肤损伤模型的建立与实验分组
为了能够更加直观地观察小鼠皮肤创口愈合情况以及准确控制小鼠皮肤创口大小的一致性,本研究采用皮肤打孔方式制作皮肤缺损性损伤模型。将小鼠随机分为对照组和创伤后1h、3h、6h、12h、1d、3d、5d、7d、10d组,每组5只。
创伤组小鼠于腹腔注射1%戊巴比妥钠溶液(70mg/kg)麻醉后,将背部皮肤剃毛,75%乙醇溶液消毒处理,用圆形锉刀于背部中线两侧分别做一直径为5mm的皮肤全层圆形切口[6]后分笼饲养,给予充足的食物和水,保持环境清洁干燥,防止创口感染。分别于创口形成后1 h、3 h、6 h、12 h、1 d、3 d、5 d、7 d、10 d将小鼠注射戊巴比妥钠溶液过量麻醉处死,并以创口为中心取创口及周边区1.0~2.0 cm范围的皮肤。对照组小鼠过量麻醉处死后在与创伤组小鼠相同部位取同等大小的皮肤样本。将取下的皮肤组织分为大小相同的4份,分别用于制作石蜡切片和Western印迹法检测。
1.3 Western印迹法检测
冰浴上在每组皮肤样本中分别加入RIPA裂解液和苯甲基磺酰氟(体积比为50∶1)的混合液300 μL,用剪刀将组织剪碎,组织匀浆,静置30 min,4℃条件下以离心半径10 cm,12 000 r/min,离心20 min,吸取上清液使用BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司)检测蛋白浓度后将样品置于-80℃保存。于样品内加入5×蛋白上样缓冲液,100℃金属浴变性10min,上样总蛋白量为50μg,在分离胶浓度为12%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)上进行电泳分离蛋白后,将蛋白转印到聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜(德国Merck公司)上,转膜条件为200mA 45min。转膜完成后用含有吐温的Tris缓冲盐溶液(Tris-buffered saline tween,TBST)洗涤3次,用5%脱脂牛奶室温下封闭2h,用羊抗小鼠IL-33多克隆抗体(1∶1000,美国R & D Systems公司)孵育,4℃过夜。室温下TBST洗涤3次,辣根过氧化物酶标记兔抗山羊IgG二抗(1∶2000,北京中杉金桥生物技术有限公司)室温孵育2h,TBST洗涤3次后用增强化学发光(enhanced chemiluminescence,ECL)法显色。用ImageJ2x软件分析各条带的光密度值,以β微管蛋白(β-tubulin)作为内参,计算各组IL-33蛋白表达的相对水平。
1.4 切片制备及染色观察
将小鼠皮肤放入4%多聚甲醛溶液中固定12 h,流水冲洗,梯度乙醇脱水,二甲苯透明,石蜡包埋,制成5 μm厚连续石蜡切片,置于37℃烘箱中烘干后置于4℃冰箱保存。
1.4.1 苏木精-伊红(hematoxylin-eosin,HE)染色
切片置于65℃恒温箱烤片30 min,二甲苯脱蜡,梯度乙醇水化,苏木精染色7min,1%盐酸-乙醇分化3 s后流水返蓝30 min,1%伊红染色1.5 min,蒸馏水5 min洗去多余染液,梯度乙醇脱水,二甲苯透明,中性树脂封片。在光学显微镜下观察创口周围组织的形态学变化。
1.4.2 免疫组织化学染色
石蜡切片常规脱蜡及水化,在3%甲醇配制的H2O2溶液中孵育10min以去除内源性过氧化物酶,微波加热修复法修复抗原。按照ZLI-9018免疫组织化学染色试剂盒(北京中杉金桥生物技术有限公司)说明书进行操作,羊抗小鼠IL-33多克隆抗体(1∶200)作为一抗,二氨基联苯胺(diaminobenzidine,DAB)显色,苏木精复染细胞核。在正置显微镜(日本Nikon公司)下观察,每张切片在创口及其周边区随机选择10个视野,计算阳性细胞数与总细胞数的比值。
1.4.3 双重免疫荧光染色
为了明确IL-33是否被巨噬细胞(Mφ)和肌成纤维细胞(myofibroblast,MyFb)表达,对切片进行双重免疫荧光染色。切片常规脱蜡、水化、去酶、抗原修复后,用磷酸盐缓冲液(phosphate-buffered saline,PBS)配制的5%小牛血清溶液室温封闭2 h。用封闭液稀释作为一抗,滴加羊抗小鼠IL-33多克隆抗体(1∶200)和兔抗小鼠F4/80多克隆抗体(1∶100,英国Abcam公司),放在保湿盒中,置于4℃冰箱孵育12h,或滴加羊抗小鼠IL-33多克隆抗体(1∶200)和兔抗小鼠α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)多克隆抗体(1∶100,英国Abcam公司),放在保湿盒中,置于4℃冰箱孵育12h。用PBS洗涤3次。Alexa Fluor 488标记的驴抗羊IgG(1∶200)和Alexa Fluor 594标记的驴抗兔IgG(1∶200,美国Jackson ImmunoResearch公司)避光条件下室温孵育2 h,PBS洗涤3次。避光条件下用Hoechst 33258染色液(北京中杉金桥生物技术有限公司)复染细胞核,PBS洗涤3次,封片剂封片。以PBS代替一抗作为阴性对照。正置荧光显微镜(日本Nikon公司)下观察,每张切片在创口及其周边区随机选择10个视野进行观察、拍照、分析,统计IL-33阳性细胞中F4/80及α-SMA的阳性表达率。
1.5 统计分析
数据采用进行表示,使用SPSS 20.0软件对Western印迹法条带光密度值及细胞阳性率进行t检验及单因素方差分析。检验水准α=0.05。
2 结 果
2.1 Western印迹法检测结果
以β-tubulin为内参,对照组和创伤组均有IL-33阳性条带(图1)。
IL-33蛋白表达在伤后3 h与对照组相比稍有下降,6 h~3 d逐渐升高,3 d时达到峰值,之后逐渐下降。IL-33蛋白表达在伤后1d和3d均高于相邻上组及对照组(P<0.05),且伤后1~3 d IL-33蛋白相对表达强度高于0.8(表1)。
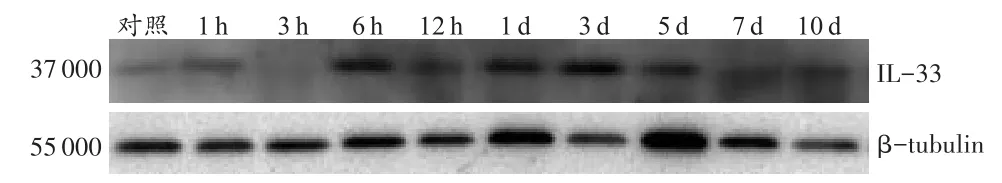
图1 小鼠皮肤创伤后不同时间点IL-33蛋白的表达Fig.1 Expression of IL-33 protein at different time points after skin wound in mice
表1 小鼠皮肤创伤后不同时间点IL-33蛋白的相对表达量Tab.1 Relative expression of IL-33 protein at different time points after skin wound in mice(n=5,±s)
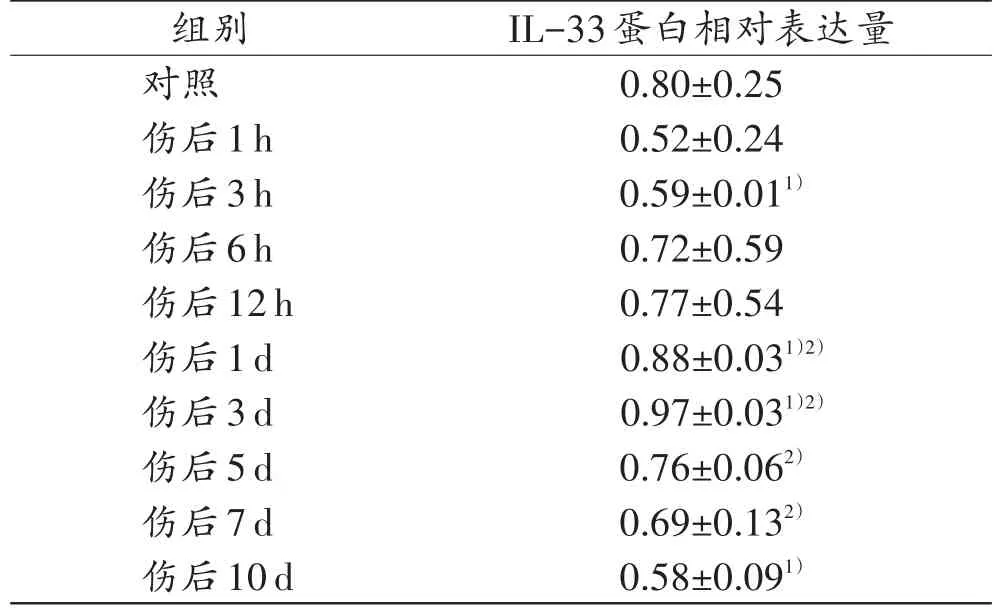
表1 小鼠皮肤创伤后不同时间点IL-33蛋白的相对表达量Tab.1 Relative expression of IL-33 protein at different time points after skin wound in mice(n=5,±s)
注:1)与对照组比较,P<0.05;2)与相邻上组比较,P<0.05。
组别对照伤后1h伤后3h伤后6h伤后12h伤后1d伤后3d伤后5d伤后7d伤后10d IL-33蛋白相对表达量0.80±0.25 0.52±0.24 0.59±0.011)0.72±0.59 0.77±0.54 0.88±0.031)2)0.97±0.031)2)0.76±0.062)0.69±0.132)0.58±0.091)
2.2 HE染色结果
与对照组相比,伤后1 h~3 d创口周围炎症细胞浸润逐渐增加,之后渐渐减少。成纤维细胞于伤后3 d开始出现在创口周围,伤后5 d数量增多,伤后7 d达到峰值。伤后5~7d创口周围肉芽组织形成。伤后10 d,新生表皮覆盖创口,肉芽组织开始向瘢痕组织转变(图2)。HE染色结果显示,该皮肤损伤模型的创口愈合过程正常,符合炎症的病理学发展规律。
2.3 免疫组织化学染色结果
对照组皮肤的表皮、毛囊、皮脂腺及真皮中固有细胞有少量IL-33阳性表达。创伤组的皮肤创口及周边区中,伤后6 h~3 d,IL-33的阳性染色主要出现在浸润的炎症细胞中,而在伤后5~7d,其阳性表达主要出现在成纤维细胞中。伤后10d,新生的表皮及成纤维细胞中仍有IL-33的阳性表达(图3)。
经细胞计数和统计,IL-33阳性细胞率于伤后3h开始增加(P<0.05),伤后6h~1d阳性细胞率超过10%,伤后3~7d阳性细胞率超过20%,且在伤后3d达到峰值,阳性细胞率超过30%(表2)。
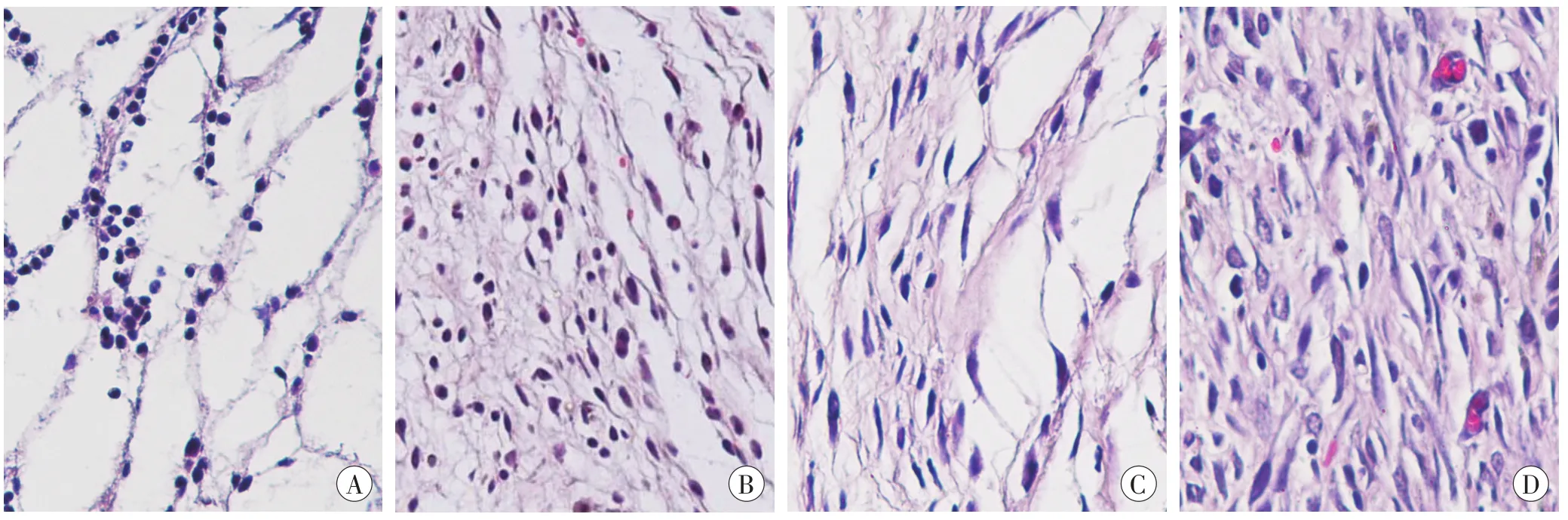
图2 小鼠皮肤创伤后不同时间点损伤区的组织形态学变化(HE×400)Fig.2 Histomorphological changes of damage zone at different time points after skin wound in mice(HE×400)

图3 小鼠皮肤创伤后不同时间点IL-33的免疫组织化学染色结果(×200)Fig.3 Immunohistochemical staining results of IL-33 at different time points after skin wound in mice(×200)
表2 小鼠皮肤创伤后不同时间点IL-33的阳性细胞率Tab.2 The positive cell rate of IL-33 at different time points after skin wound in mice(n=5,±s,%)
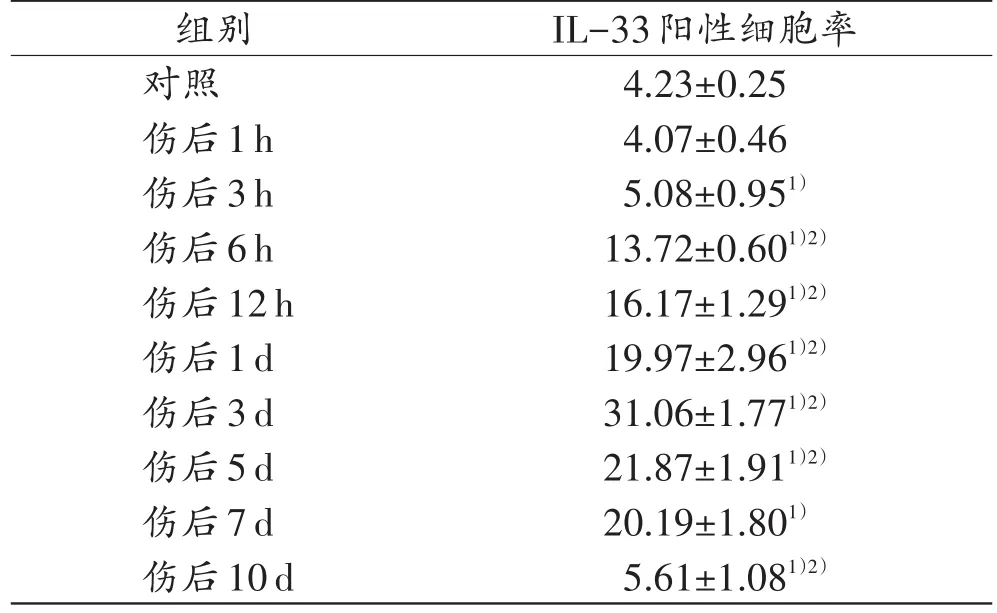
表2 小鼠皮肤创伤后不同时间点IL-33的阳性细胞率Tab.2 The positive cell rate of IL-33 at different time points after skin wound in mice(n=5,±s,%)
注:1)与对照组比较,P<0.05;2)与相邻上组比较,P<0.05。
组别对照伤后1h伤后3h伤后6h伤后12h伤后1d伤后3d伤后5d伤后7d伤后10d IL-33阳性细胞率4.23±0.25 4.07±0.46 5.08±0.951)13.72±0.601)2)16.17±1.291)2)19.97±2.961)2)31.06±1.771)2)21.87±1.911)2)20.19±1.801)5.61±1.081)2)
2.4 双重免疫荧光染色结果
创伤组的皮肤创口及周边区中,部分IL-33阳性的炎症细胞表达F4/80(Mφ的标记物),于伤后6 h开始呈增多趋势。伤后1 d,IL-33阳性的Mφ开始大量聚集在创口周围。伤后3 d,IL-33阳性细胞中F4/80的阳性表达率达到峰值(>60%,图4,表3)。此后,随着损伤时间的延长,IL-33阳性细胞中F4/80的阳性表达率逐渐降低。
伤后3d,创口区部分IL-33阳性细胞表达α-SMA(MyFb的标记物)。伤后5d,IL-33阳性细胞中α-SMA的阳性表达率达到峰值(>60%,图5,表4)。随着损伤时间的延长,IL-33阳性细胞中α-SMA的阳性表达率逐渐降低。
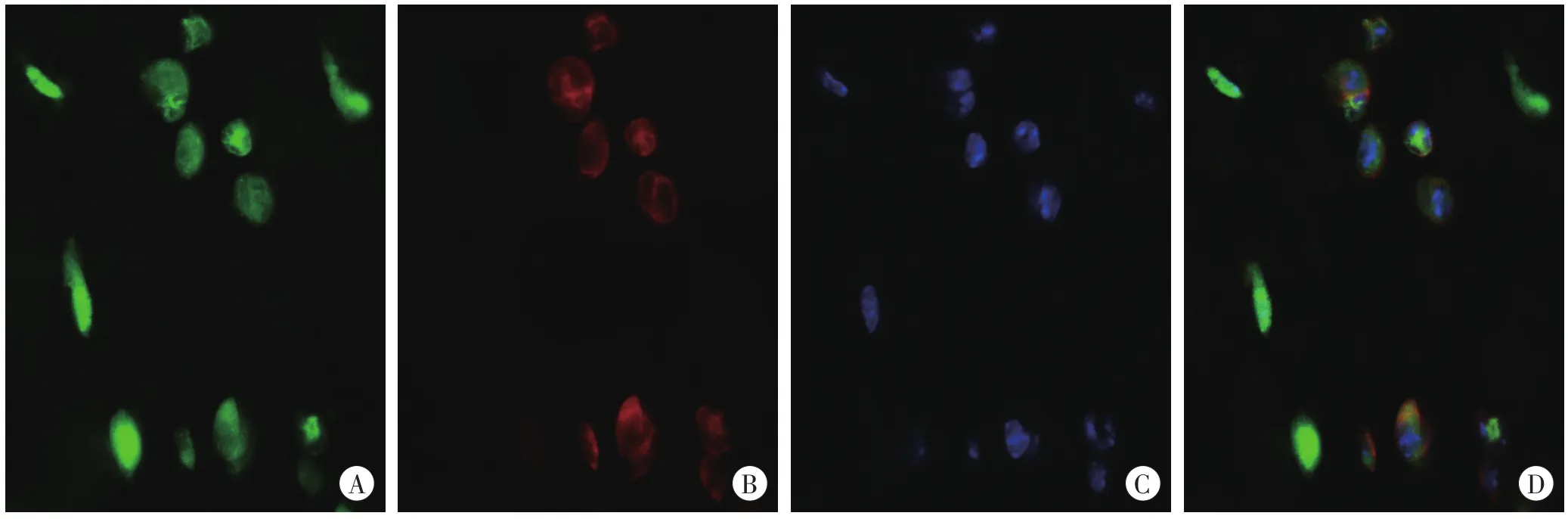
图4 伤后3d皮肤创口区F4/80和IL-33的免疫荧光染色结果(×400)Fig.4 Immunofluorescence staining of F4/80 and IL-33 in skin incision 3d after injury(×400)
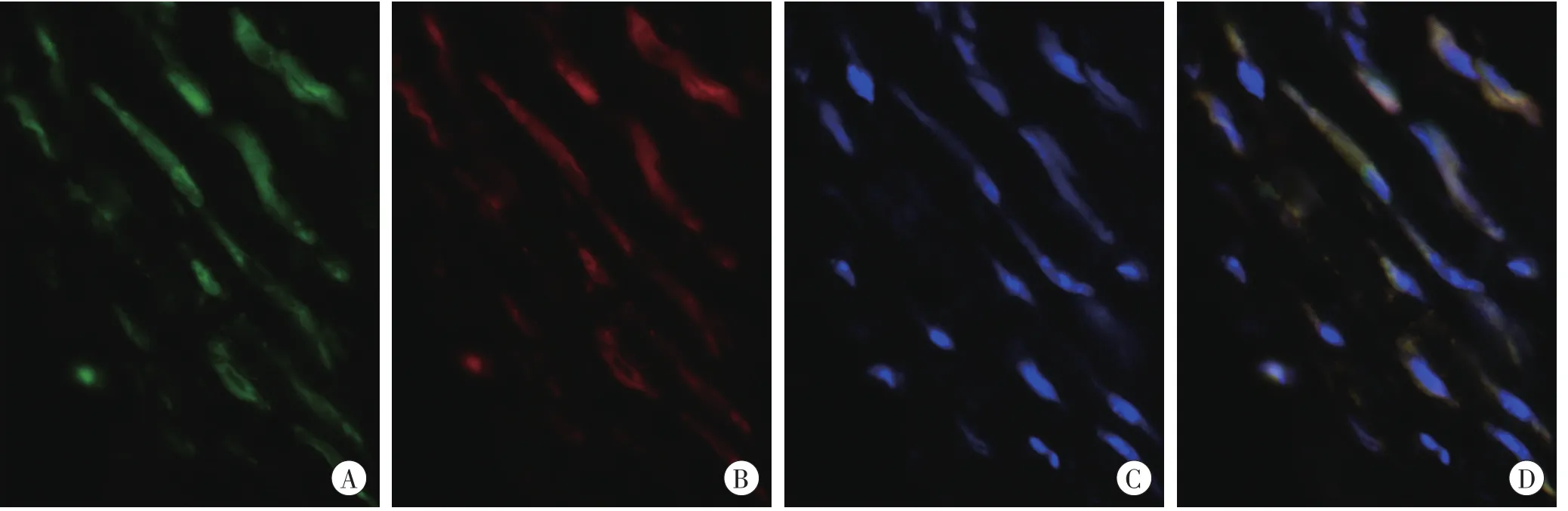
图5 伤后5d皮肤创口区α-SMA和IL-33的免疫荧光染色结果(×400)Fig.5 Immunofluorescence staining of α-SMA and IL-33 in skin incision 5d after injury(×400)
表3 皮肤创伤后IL-33阳性细胞中F4/80的阳性表达率Tab.3 The expression rate of F4/80 in IL-33 positive cells after skin wound(n=5,±s,%)
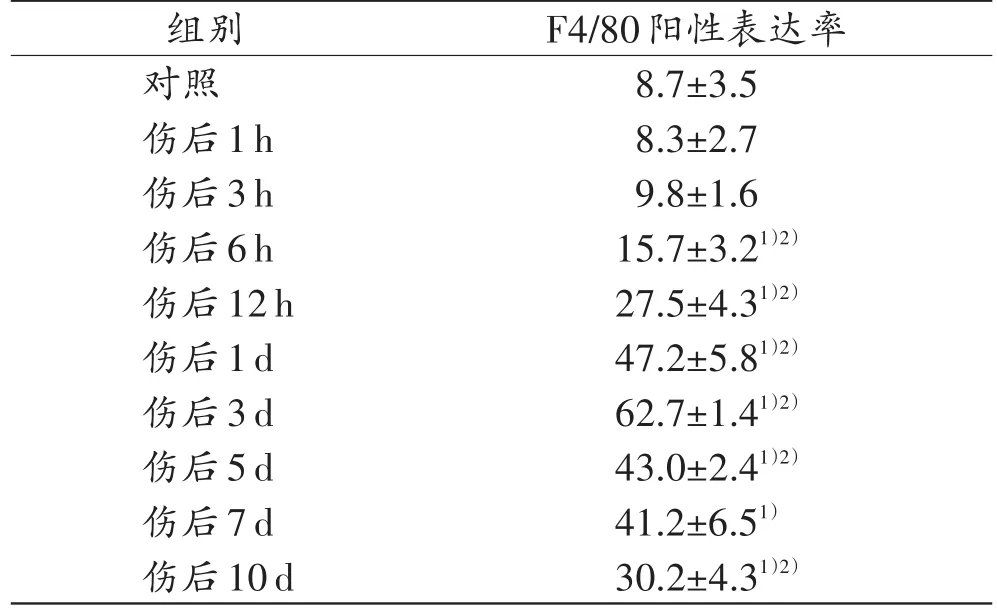
表3 皮肤创伤后IL-33阳性细胞中F4/80的阳性表达率Tab.3 The expression rate of F4/80 in IL-33 positive cells after skin wound(n=5,±s,%)
注:1)与对照组比较,P<0.05;2)与相邻上组比较,P<0.05。
组别对照伤后1h伤后3h伤后6h伤后12h伤后1d伤后3d伤后5d伤后7d伤后10d F4/80阳性表达率8.7±3.5 8.3±2.7 9.8±1.6 15.7±3.21)2)27.5±4.31)2)47.2±5.81)2)62.7±1.41)2)43.0±2.41)2)41.2±6.51)30.2±4.31)2)
表4 皮肤创伤后IL-33阳性细胞中α-SMA的阳性表达率Tab.4 The expression rate of α-SMA in IL-33 positive cells after skin wound(n=5,±s,%)

表4 皮肤创伤后IL-33阳性细胞中α-SMA的阳性表达率Tab.4 The expression rate of α-SMA in IL-33 positive cells after skin wound(n=5,±s,%)
注:1)与对照组比较,P<0.05;2)与相邻上组比较,P<0.05。
组别对照伤后1h伤后3h伤后6h伤后12h伤后1d伤后3d伤后5d伤后7d伤后10d α-SMA阳性表达率5.4±0.9 4.8±1.9 5.2±2.2 5.4±1.5 6.6±1.9 8.2±3.4 41.4±3.91)2)64.8±5.71)2)49.5±4.51)2)24.1±2.41)2)
3 讨 论
在皮肤创伤愈合过程中,某些生物学指标的规律性变化可以为损伤时间推断提供良好的参考依据[7-8]。研究[9]结果显示,参与皮肤创伤愈合的一些细胞因子,如IL-1α、IL-8、单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)、巨噬细胞炎症蛋白-1α(macrophage inflammatory protein-1α,MIP-1α)等的表达随着愈合过程的进展呈动态变化,但这些指标的动态变化无明确的时间分界且相互重叠,因此,皮肤损伤时间的推断仅靠单一的生物学指标是不够的,需要综合检测多种细胞因子的表达以及运用不同的检测手段如形态学、分子生物学等,可以增加皮肤损伤时间推断的准确性,减少单一指标推断的误差。
IL-33是新型IL-1家族成员,主要在皮肤角质形成细胞和内皮细胞中表达为核蛋白[10],在组织损伤或遭受物理刺激时释放[11],在适宜的刺激下,免疫细胞、巨噬细胞、肥大细胞、树突状细胞、内皮细胞及上皮细胞均可产生IL-33[12]。研究[13-14]结果表明,IL-33不仅是一种前炎症因子,也是一种双功能细胞因子,其中全长IL-33(full-length IL-33,flIL-33)为核内基因调节因子,成熟IL-33(mature IL-33,mIL-33)为细胞外细胞因子,从受损或坏死细胞中释放后起作用。核IL-33可能通过抑制核因子-κB(nuclear factor-κB,NF-κB)抑制过度炎症和维持细胞增殖或迁移进而促进上皮形成[15],这表明IL-33可能通过抑制炎症反应促进上皮细胞增殖或迁移从而促进创伤愈合。研究表明,生长刺激表达基因2(growth stimulation expressed gene 2,ST2)蛋白是IL-33的特异性受体,是白细胞介素1受体/Toll样受体(interleukin-1 receptor/Toll-like receptor,IL-1R/TLR)超家族的一员,IL-33可通过与其特异性结合诱导Th2型细胞因子基因表达,促进Th2介导的免疫反应[3,16-17],在感染、炎症性疾病、结缔组织重塑和纤维化中发挥重要作用[18-19]。当炎症开始后,中性粒细胞和单核细胞相继进入炎症区域,释放促炎因子并激活抗炎症反应[20],提示IL-33可能参与了皮肤创伤愈合炎症反应的调控。
为了确定IL-33是否能够用于皮肤损伤时间的推断,本研究通过建立小鼠皮肤损伤模型检测了损伤后不同时间IL-33的表达变化。Western印迹法检测结果显示,IL-33蛋白表达在伤后3 h稍有下降,随后在6h~3d逐渐升高,于伤后3d达到峰值,之后逐渐下降,IL-33蛋白在伤后1~3 d的表达强度高于对照组(P<0.05),且在伤后 1~3 d蛋白相对表达强度高于0.8。免疫组织化学染色结果显示,IL-33的阳性细胞率于伤后3 h开始增加,伤后6 h~1 d超过10%,伤后3~7 d超过20%,且在伤后3 d达到峰值,阳性细胞率超过30%。伤后6 h~3 d损伤区周围可见较多炎症细胞表达IL-33,伤后5~7d IL-33主要表达于成纤维细胞。为了明确在小鼠皮肤损伤愈合过程中是何种细胞表达IL-33,本研究应用双重免疫荧光染色对IL-33表达阳性的细胞进行了细胞种类鉴定。结果显示,IL-33阳性表达的细胞主要是Mφ和MyFb。除了增加应用双重免疫荧光染色结果对IL-33表达阳性的细胞进行细胞种类鉴定,本研究还分别统计了损伤后不同时间F4/80(Mφ的标记物)和α-SMA(MyFb的标记物)在IL-33阳性细胞中的阳性表达率。IL-33和F4/80双重免疫荧光染色结果显示,伤后1d,IL-33阳性的Mφ开始大量聚集在创口周围,伤后3d,IL-33阳性细胞中F4/80的表达率达到峰值(>60%),随着损伤时间的延长表达率逐渐降低。IL-33和α-SMA双重免疫荧光染色结果显示,IL-33阳性的MyFb于伤后3d开始出现在创口区,伤后5d,IL-33阳性细胞中α-SMA的表达率达到峰值(>60%),随着损伤时间的延长表达率逐渐降低。HE染色结果显示,皮肤创口愈合正常。从法医病理学的角度分析,IL-33在创口愈合中的表达呈现一定的时间规律性,可用于损伤时间的推断。
有研究结果显示,IL-33/ST2信号通路参与炎症和组织再生之间的平衡调节[21-22],能够促进新的细胞外基质(extracellular matrix,ECM)沉积和血管生成[23],在基质合成和新血管形成中发挥重要作用。这说明IL-33作为一种炎症细胞因子,通过IL-33/ST2信号通路调控皮肤损伤愈合的发展。本研究初步证实了IL-33参与皮肤损伤愈合的过程并随着愈合过程的进展呈时间依赖性变化,可用于动物创口形成时间的推断。联合形态学、免疫组织化学、细胞种类鉴定等实验技术方法检测IL-33在皮肤损伤愈合过程中的表达,综合分析IL-33作为生物学指标在皮肤损伤时间推断中的应用价值,可以使实验分析结果更加客观。研究[3]结果显示,编码人类IL-33的基因位于9号染色体(9p24.1),编码了270个多肽组成的氨基酸,其中54%的氨基酸序列与小鼠具有同源性,提示IL-33可能为人类皮肤损伤时间推断提供重要参考,但是IL-33表达并未在人体标本中进行验证,而且其表达是否受皮肤损伤严重程度的影响也需要进一步通过实验进行验证。
