不同浓度人源性抗菌肽LL-37/PLGA/β-TCP复合支架对兔骨髓间充质干细胞增殖、分化的影响
2020-06-08罗万荣易伟宏胡广询
罗万荣 易伟宏 胡广询
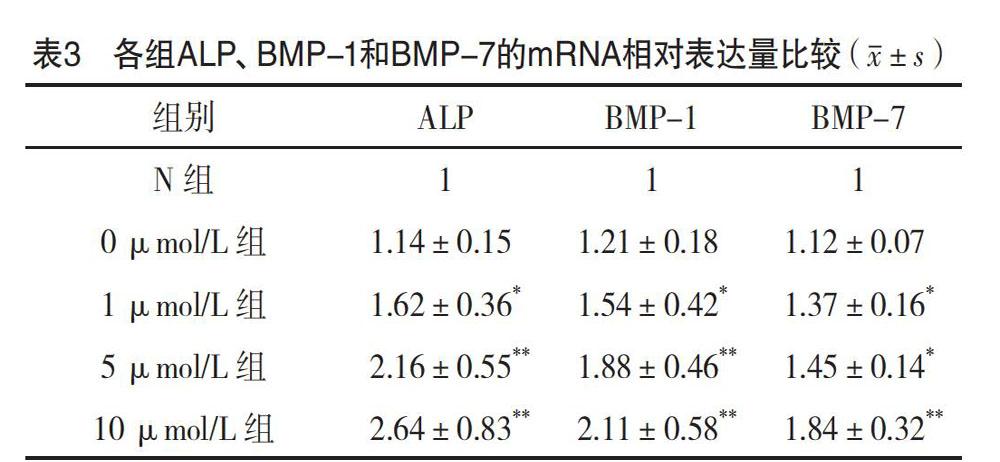
【摘要】 目的:研究不同濃度人源性抗菌肽LL-37/聚乳酸聚乙醇酸共聚物(PLGA)/β-磷酸三钙(β-TCP)复合支架对于兔骨髓间充质干细胞(rBMSCs)增殖、分化的影响。方法:制备LL-37/PLGA/β-TCP复合支架材料,按LL-37浓度分为0、1、5、10 μmol/L组,另设置空白rBMSCs培养基为N组,每组三个培养皿,细胞密度为5×105个/皿。扫描电镜下观察不同浓度LL-37/PLGA/β-TCP复合支架形态。采用CCK-8检查方法检测各组干预rBMSCs 0、24、48、72、96、120 h后rBMSCs细胞增殖活力。干预rBMSCs 24 h后,采用荧光定量聚合酶链反应(qPCR)检测各组成骨相关基因碱性磷酸酶(ALP)、骨形态发生蛋白-1(BMP-1)及骨形态发生蛋白-7(BMP-7)的mRNA相对表达量。干预rBMSCs 24 h后,采用ELISA检测各组ALP、BMP-1及BMP-7的蛋白水平。每个实验独立重复三次。结果:LL-37/PLGA/β-TCP复合支架材料随着LL-37浓度增加而呈现多孔、细胞吸附增多的趋势,促进细胞贴附生长。干预24 h后,10 μmol/L组细胞增殖能力明显高于N组(P<0.05);随着干预时间延长,1、5、10 μmol/L组均对rBMSCs有促进增殖作用,且呈浓度依赖作用。1、5、10 μmol/L组ALP、BMP-1及BMP-7的mRNA相对表达量与蛋白表达水平均高于N组(P<0.05);1、5、10 μmol/L组ALP、BMP-1及BMP-7的mRNA相对表达量与蛋白表达水平均呈高表达,且呈浓度依赖。结论:LL-37/PLGA/β-TCP复合支架可以显著促进rBMSCs增殖与分化,是一种潜在的骨组织工程支架。
【关键词】 人源性抗菌肽 PLGA/β-TCP复合支架 兔骨髓间充质干细胞 碱性磷酸酶 骨形态发生蛋白
[Abstract] Objective: To investigate the effects of concentrations of human antimicrobial peptide LL-37/polylactic acid-polyglycolic acid copolymer (PLGA)/β-tricalcium phosphate (β-TCP) composite scaffolds on proliferation and differentiation of rabbit bone marrow mesenchymal stem cells (rBMSCs). Method: LL-37/PLGA/β-TCP composite scaffolds were prepared. The scaffolds were divided into 0, 1, 5, 10 μmol/L group according to the concentration of LL-37. In addition, the blank rBMSCs medium was set as group N, three plates in each group and cell density of 5×105/plates. The morphology of LL-37/PLGA/β-TCP composite scaffolds with different concentrations were observed under scanning electron microscope. The proliferation activity of rBMSCs was detected by CCK-8 after 0, 24, 48, 72, 96 and 120 h of rBMSCs intervention. After 24 h of rBMSCs intervention, the relative mRNA expression of osteogenesis-related genes alkaline phosphatase (ALP), bone morphogenetic protein-1 (BMP-1) and bone morphogenetic protein-7 (BMP-7) were detected by fluorescence quantitative polymerase chain reaction (qPCR). After 24 h of rBMSCs intervention, the protein levels of ALP, BMP-1 and BMP-7 were detected by ELISA. Each experiment was repeated three times independently. Result: With the increase of LL-37 concentration, LL-37/PLGA/β-TCP composite scaffolds showed a trend of porous and cell adsorption, which promoted cell adhesion and growth. After 24 h of intervention, the proliferation ability of 10 μmol/L group was significantly higher than that of N group (P<0.05). With the extension of intervention time, the 1, 5 and 10 moL/L group all had the effect of promoting rBMSCs proliferation, and the effect was concentration dependent. The relative mRNA expression and protein expression level of ALP, BMP-1 and BMP-7 in 5, 10 μmol/L group were higher than those in N group (P<0.05). The relative mRNA expression and protein expression level of ALP, BMP-1 and BMP-7 in 1, 5, 10 μmol/L group were all highly expressed and concentration dependent. Conclusion: The LL-37/PLGA/β-TCP composite scaffold can significantly promote rBMSCs proliferation and differentiation. It is a potential bone tissue engineering scaffold.
慢性骨髓炎、开放性骨折重度污染等一直是骨科的常见病、疑难病,尤其清创后常出现的大块骨缺损和创面感染,更是棘手的两大难题[1-2]。一般认为骨质缺损长度超过2 cm或骨周径缺损超过50%即为大段骨缺损[3]。目前对于大段骨缺损的治疗方式主要有牵引成骨、自体或异体植骨和组织工程技术等[1,4-5]。牵引成骨治疗周期长,手术复杂,有学习曲线长、并发症多等缺点[4-5]。自体骨移植被认为是治疗骨缺损的金方法,然而此方法额外增加患者创伤,且骨来源不足,容易受到限制[6]。异体骨移植移植费用昂贵,存在术后感染、恢复缓慢等缺点[7]。随着近年来骨组织工程技术的发展,因其具有创伤小、来源不受限制等优点,逐渐受到大家重视[1,8]。聚乳酸聚乙醇酸共聚物(PLGA)和β-磷酸三钙(β-TCP)是一种被食品和药物管理局批准能用于人体内的医用材料。因其具有良好的生物安全性、生物相容性以及低毒性,不易表现出抗原性或免疫原性,已被广泛使用[6,9]。LL-37是一种人源性抗菌肽(AMPs),广泛存在于骨髓、睾丸、中性粒细胞、单核细胞以及多处鳞状上皮细胞中,具有抗菌活性的碱性多肽物质,因其优越的广谱抗菌活性及免疫调节作用而逐渐受到临床学者关注[10]。本研究选用PLGA/β-TCP为支架,复合不同浓度的LL-37,观察不同浓度的LL-37/PLGA/β-TCP复合支架对兔骨髓间充质干细胞(rabbit bone marrow mesenchymal stem cells,rBMSCs)增殖和分化的影响,为LL-37/PLGA/β-TCP复合支架作为新的骨组织工程技术材料治疗骨缺损提供实验学依据,现报道如下。
1 材料与方法
1.1 材料 rBMSCs购买于中国广州赛业生物科技有限公司,PLGA/β-TCP购置于购自上海麦克林生化科技有限公司;LL-37、PBS、DMEM高糖培养基购买于美国sigma公司、胎牛血清(FBS)及0.25%胰蛋白酶买自于中国索莱宝科技有限公司;RNA提取试剂盒、逆转录试剂盒、Mix买自中国南京诺唯赞生物科技有限公司;CCK-8试剂盒买自日本Dojindo有限公司;碱性磷酸酶(ALP)、骨形态发生蛋白-1(BMP-1)及骨形态发生蛋白-7(BMP-7)ELISA试剂盒买自美国Proteintech公司。
1.2 方法
1.2.1 rBMSCs的培养、传代与LL-37/PLGA/β-TCP复合支架的制备 rBMSCs的培养、传代:将rBMSCs放入恒溫培养箱孵育过夜后进行换液,每2天换液1次,待其铺满瓶底80%~90%体积时使用0.25%胰酶消化,并以1︰3比例传代。LL-37/PLGA/β-TCP复合支架的制备与分组:向PLGA/β-TCP支架材料中加入LL-37,配成终浓度为1 mmol/L的母液。随后向rBMSCs培养基中加入不同体积的LL-37/PLGA/β-TCP复合支架母液,使最终浓度为1、5、10 μmol/L,即为1、5、10 μmol/L组。另设仅加入PLGA/β-TCP复合支架材料,LL-37浓度为0 μmol/L为0 μmol/L组与空白rBMSCs培养基为N组,每组细胞密度为5×105个/皿,各3个培养皿。所有实验独立重复3次。
1.2.2 扫描电镜下观察不同浓度LL-37/PLGA/β-TCP复合支架形态 rBMSCs 孵育24 h后置于电镜下观察0、1、5、10 μmol/L复合支架形态。
1.2.3 CCK-8检测各组rBMSCs增殖的情况 将rBMSCs以1×105个/mL的密度接种于96孔板,每孔100 μL,放入培养箱中过夜,待细胞贴壁后同上述分组方法处理,再次将其放入恒温培养箱中,孵育0、24、48、72、96、120 h后吸弃上清。PBS清洗后加入含10 μL CCK-8溶液的培养基,放入恒温培养箱孵育3 h后用酶标仪中检测各孔在450 nm的吸光度。
1.2.4 qPCR检测各组成骨相关基因碱性磷酸酶(ALP)、骨形态发生蛋白-1(BMP-1)及骨形态发生蛋白-7(BMP-7)的mRNA相对表达量 rBMSCs 孵育24 h后使用Trizol提取各组细胞中RNA,然后根据说明书逆转录合成cDNA,上机检测ALP、BMP-1及BMP-7的mRNA相对表达量。选用β-Actin为对照基因,对目标检测基因进行标准化。试验所需引物见表1。
1.2.5 采用ELISA法检测各组ALP、BMP-1、BMP-7的蛋白表达水平 rBMSCs 孵育24 h后分别各组收集细胞上清液,严格按照试剂盒说明检测各组ALP、BMP-1、BMP-7含量。
1.3 统计学处理 采用SPSS 23.0软件对所得数据进行统计分析,所有实验均独立重复三次,计量资料用(x±s)表示,比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度LL-37/PLGA/β-TCP复合支架下电镜形态 LL-37/PLGA/β-TCP复合支架材料随着LL-37浓度增加而呈现多孔、细胞吸附增多的趋势,促进细胞贴附生长,见图1。
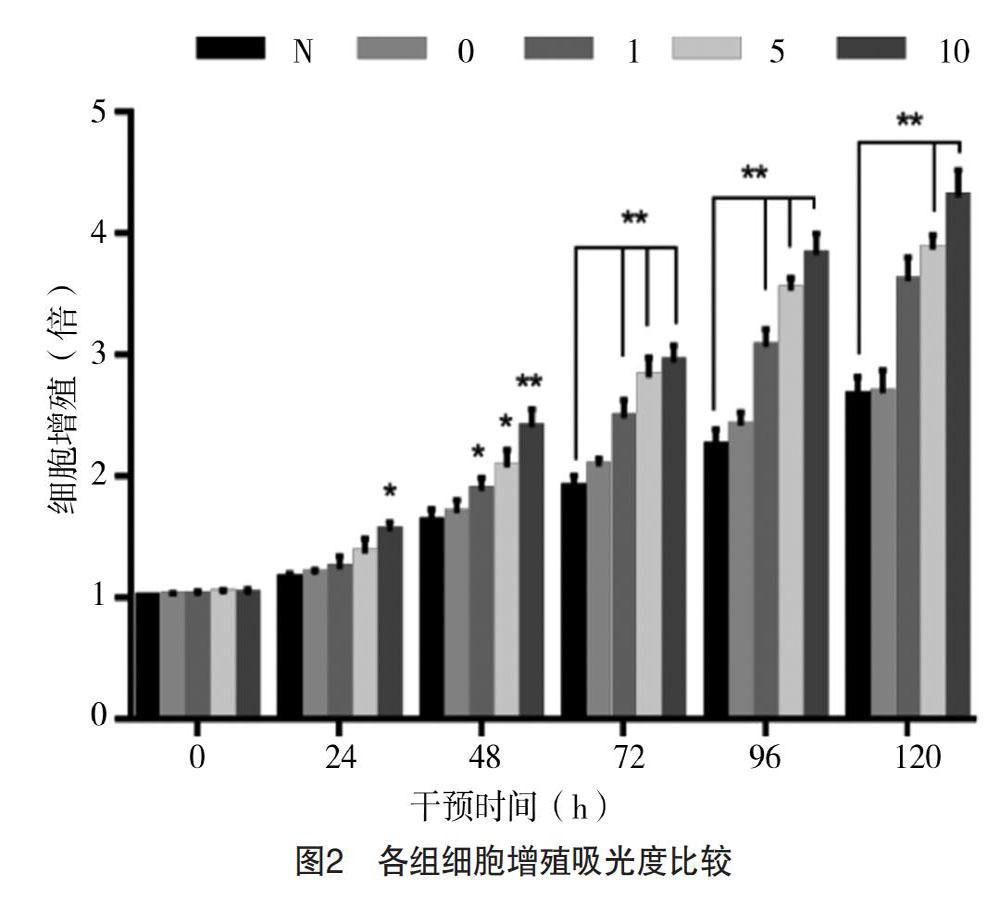
2.2 各组rBMSCs增殖情况 干预24 h,0、1及5 μmol/L组rBMSCs增殖与N组比较,差异均无统计学意义(P>0.05),而10 μmol/L组rBMSCs增殖明显高于N组,差异有统计学意义(P<0.05)。干预48 h,1、5、10 μmol/L组rBMSCs增殖能力均明显高于N组(P<0.01);随着干预时间延长,1、5、10 μmol/L组均对rBMSCs有促进增殖作用,且呈浓度依赖作用。见表2和图2。
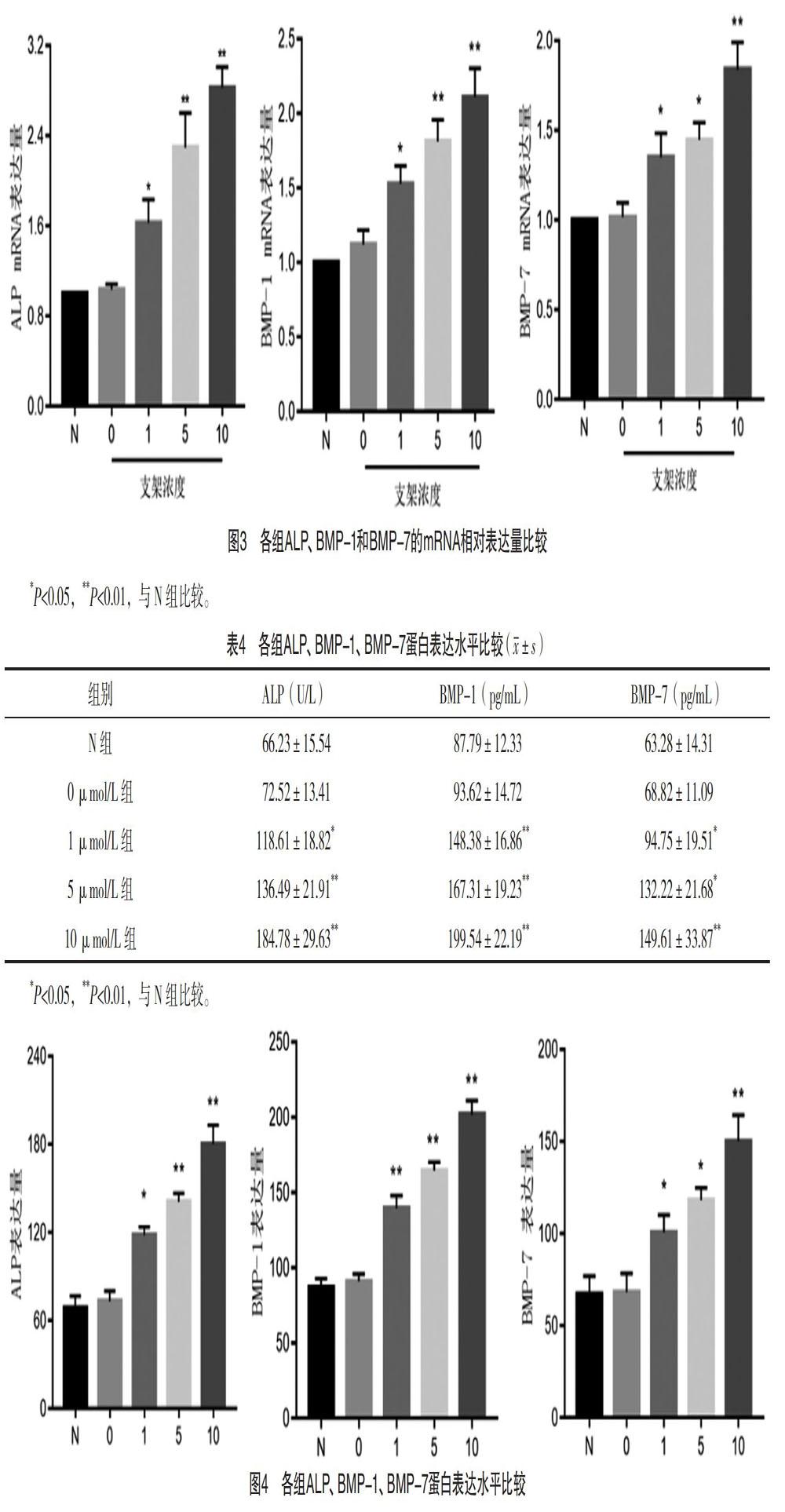
2.3 各组ALP、BMP-1、BMP-7的mRNA相对表达量比较 1、5、10 μmol/L组ALP、BMP-1和BMP-7的mRNA表达量均明显高于N组,差异均有统计学意义(P<0.05)。1、5、10 μmol/L组ALP、BMP-1、BMP-7的mRNA均呈高表达,且呈浓度依赖性(P<0.05)。见表3和图3。
2.4 各组ALP、BMP-1、BMP-7的蛋白表达水平比较 1、5、10 μmol/L组ALP、BMP-1和BMP-7的蛋白表达水平均明显高于N组,差异均有统计学意义(P<0.05)。1、5、10 μmol/L组ALP、BMP-1、BMP-7蛋白均呈高表达,且呈濃度依赖性(P<0.05)。见表4和图4。
3 讨论
大段骨缺损一直都是骨科临床的治疗难点,随着骨组织工程技术的进展,应用骨组织工程技术治疗骨或软骨缺损逐渐成了研究的热点。骨组织工程具有三大关键要素,即种子细胞、支架材料和生长因子。骨髓间充质干细胞(BMSC)是一种在骨髓基质中具有多种分化潜能的细胞亚群,其在特定刺激下可以分化为多种细胞,如成骨细胞、软骨细胞、成纤维细胞以及神经细胞等[11]。因其具有方便获取、可多次传代以及较低的排斥反应,是一种骨组织工程技术的优选种子细胞,现已广泛应用于骨或软骨缺损的实验研究及临床[12-14]。
PLGA是一种国际公认的可降解、具有良好生物相容性的材料,被广泛认为是骨组织良好替代支架[15-16]。然PLGA因不具备成骨诱导性且亲水性差,不利于细胞的黏附和分化,因此多应用于与其他材料组成复合材料,以同时具备生物相容性、生物安全性、低毒性以及良好的与细胞黏附能力[16]。β-TCP因其化学性质及晶体结构与骨骼矿物非常相似,同时可以具备可吸收性、生物相容性,但其存在脆性大、韧性差等缺陷,限制了其在骨科方面的临床应用[17]。通过结合PLGA与β-TCP,运用3D打印技术按质量比为4︰1的比例制备了PLGA/β-TCP支架,同时具有了多孔仿生结构、良好的生物相容性、骨导电性和生物降解性,在体外和体内的实验中取得了良好的成骨效果[18-19]。
外源性的生长因子是骨组织工程技术治疗骨缺损的过程中起到决定性作用的另一关键因素。抗菌肽因其具有广谱抗菌特性,同时具有免疫调节能力,对机体固有免疫及获得性免疫均有显著增强作用,是近年来成为研究的热点[20-21]。有研究显示,LL-37具有显著的抗细菌、趋化、免疫调节及抗肿瘤等作用[10]。笔者发现目前尚未有文章报道联合使用LL-37及PLGA/β-TCP支架对于骨缺损的治疗。因此本研究以rBMSCs为种子细胞,以PLGA/β-TCP支架为支架材料,同时加入LL-37作为外源性生长因子,观察不同浓度的LL-37/PLGA/β-TCP复合支架对于rBMSCs增殖和成骨分化的影响。结果发现证明LL-37/PLGA/β-TCP具有良好的生物相容性及细胞黏附能力,能有效促进rBMSCs增殖,促进rBMSCs成骨相关基因(ALP、BMP-1和BMP-7)高表达。
综上所述,LL-37/PLGA/β-TCP具有良好的作为骨组织工程支架的替代材料的潜能,可有效促进rBMSCs增殖和分化。在下一步研究工作中,笔者将通过动物实验进一步探索该复合支架在生物体内的成骨作用机理,为治疗大段骨缺损骨组织工程治疗实验学依据。
参考文献
[1]周思佳,姜文学,尤佳.骨缺损修复材料:现状与需求和未来[J].中国组织工程研究,2018,22(14):2251-2258.
[2]唐俊杰,李文杰,李根,等.骨组织工程诱导性支架材料修复骨缺损[J].中国组织工程研究,2015,19(3):340-346.
[3] Fernandez D G G,Keller L,Idoux-Gillet Y,et al.Bone substitutes:a review of their characteristics,clinical use,and perspectives for large bone defects management[J].J Tissue Eng,2018,9(3):2041731418776819.
[4] Morelli I,Drago L,George D A,et al.Managing large bone defects in children[J].J Pediatr Orthop B,2018,27(5):443-455.
[5] Lesensky J,Prince D E.Distraction osteogenesis reconstruction of large segmental bone defects after primary tumor resection:pitfalls and benefits[J].Eur J Orthop Surg Traumatol,2017,27(6):715-727.
[6]郑奥,曹玲燕,刘阳,等.石墨烯/PLGA复合支架对骨髓间充质干细胞增殖和分化能力的影响[J].口腔生物医学,2018,9(2):58-62.
[7]邓子文,黄东.同种异体骨移植修复骨缺损的应用进展[J].山东医药,2017,57(32):98-100.
[8] Sadeghi-Avalshahr A,Nokhasteh S,Molavi A M,et al.
Synthesis and characterization of collagen/PLGA biodegradable skin scaffold fibers[J].Regen Biomater,2017,4(5):309-314.
[9] Wang Z,Guo Z,Bai H,et al.Clinical evaluation of beta-TCP in the treatment of lacunar bone defects:a prospective,randomized controlled study[J].Mater Sci Eng C Mater Biol Appl,2013,33(4):1894-1899.
[10] Fabisiak A,Murawska N,Fichna J.LL-37:Cathelicidin-related antimicrobial peptide with pleiotropic activity[J].Pharmacol Rep,2016,68(4):802-808.
[11]李喬乔,吴振强,张丽君.骨髓间充质干细胞的定向分化潜能[J].中国组织工程研究,2017,21(25):4082-4087.
[12]华臻,杨俊锋,潘娅岚,等.补肾中药促进骨髓间充质干细胞成骨分化的研究进展[J].中华中医药杂志,2015,30(9):3222-3226.
[13]张善强,李永涛,包鑫,等.复合神经营养因子-3的静电纺丝高分子材料促进兔骨髓间充质干细胞增殖与分化[J].中外医疗,2018,37(4):9-12,19.
[14]余华.骨髓间充质干细胞miRNA-196a异常表达与激素性股骨头坏死关联的临床研究[J].安徽医药,2018,22(1):68-71.
[15] Zhao W,Li J,Jin K,et al.Fabrication of functional PLGA-based electrospun scaffolds and their applications in biomedical engineering[J].Mater Sci Eng C Mater Biol Appl,2016,59:1181-1194.
[16] Del C T,Ortega-Oller I,Padial-Molina M,et al.Formulation,Colloidal Characterization,and In Vitro Biological Effect of BMP-2 Loaded PLGA Nanoparticles for Bone Regeneration[J].Pharmaceutics,2019,11(8):388.
[17]许秀娟.聚L-乳酸(PLLA)/β-磷酸三钙(β-TCP)复合多孔骨支架材料的制备及性能研究[D].成都:四川大学,2007.
[18] Chen S H,Wang X L,Xie X H,et al.Comparative study of osteogenic potential of a composite scaffold incorporating either endogenous bone morphogenetic protein-2 or exogenous phytomolecule icaritin:an in vitro efficacy study[J].Acta Biomater,2012,8(8):3128-3137.
[19] Li X,Min S,Zhao X,et al.Optimization of entrapping conditions to improve the release of BMP-2 from PELA carriers by response surface methodology[J].Biomed Mater,2014,10(1):15002.
[20] Deng Q,Pu Y,Sun L,et al.Antimicrobial peptide AMPNT-6 from Bacillus subtilis inhibits biofilm formation by Shewanella putrefaciens and disrupts its preformed biofilms on both abiotic and shrimp shell surfaces[J].Food Res Int,2017,102:8-13.
[21] Gong G L,Wei Y,Wang Z Z.Functional expression,purification,and antimicrobial activity of a novel antimicrobial peptide MLH in Escherichia coli[J].Prep Biochem Biotechnol,2018,48(2):57-63.
(收稿日期:2020-01-06) (本文编辑:田婧)
