白藜芦醇对人结肠癌细胞上皮间质转化的抑制作用
2020-06-08闫立凯王卫东周厚民周少飞
王 超,陈 尚,闫立凯,王卫东,周厚民,刘 璞,周少飞*
0 引言
结肠癌是常见的消化道恶性肿瘤之一,发病率呈逐年递增的趋势,在世界癌症中其死亡率位居第4位,严重威胁人类的生命健康[1-2]。目前结肠癌主要采用手术切除治疗,患者术后易发生远处转移,需要给予放化疗、中草药物治疗和分子靶向等辅助性治疗。中草药在减少肿瘤发生转移和减轻患者术后不良反应等方面有着至关重要的作用。因此,研发不良反应低且高效的抗肿瘤转移的药物成为该领域的研究热点。白藜芦醇(Resveratrol,Res)是一种非黄酮类多酚的天然药物,存在于多种天然植物中,其中以葡萄皮中的含量最高[3]。研究表明,Res具有结构简单和毒性小的特点,在抗炎症、抗肿瘤、抗氧化等多种生物活性方面具有一定的调节作用[4]。在肝癌、前列腺癌、胃癌等多种肿瘤中,Res对肿瘤细胞的生长和转移有着明显的抑制作用[5-6]。研究表明,不同浓度Res可以抑制结肠癌细胞的增殖活性[7]。但是有关Res对结肠癌侵袭的作用机制尚不清楚,本研究采用不同浓度的Res干预结肠癌HCT-8细胞,观察细胞迁移和侵袭能力的变化,并初步探讨其可能的机制,为进一步的临床研究提供理论依据。
1 材料和方法
1.1 材料与仪器 人结肠癌HCT-8细胞(中国科学院上海细胞库),SYBR Green实时荧光定量PCR预混液和qRT-PCR引物(美国Invitrogen公司),RNA提取试剂盒和逆转录试剂盒(日本TaKaRa公司),Transwell小室(美国Corning公司),抗体E-cadherin、Vimentin和N-cadherin(美国CST公司),二抗、内参(GAPDH)、MTT试剂盒和苏木素(上海碧云天公司),二甲基亚砜(DMSO)和Matrigel(北京索莱宝科技公司),胰酶、DMEM培养基和胎牛血清(美国Gibco公司),白藜芦醇(美国Sigma公司),DMSO溶解白藜芦醇,浓度的配制采用无血清的DMEM。酶标仪(美国BioTek公司),qRT-PCR仪器(中国香港Gene Company Limited公司),高分辨率相差显微镜(日本奥林巴斯公司)。
1.2 方法
1.2.1 细胞培养 处于对数生长期的人结肠癌HCT-8细胞采用10%胎牛血清的DMEM培养基培养,于37 ℃、5%CO2细胞孵箱中胰酶消化传代培养。
1.2.2 筛选Res对HCT-8细胞增殖活性影响的最佳浓度和时间 采用MTT法。首先调整细胞生长状态使其处于对数生长期,然后将细胞消化制备成单细胞悬液(密度调整为3×104/ml),取100 μl细胞悬液均匀接种于96孔板中,每组设置6个复孔,在孔板边缘加入等量的PBS,于37 ℃、5%CO2细胞孵育箱中常规培养,待细胞贴壁后进行细胞同步化。按照白藜芦醇说明书进行配制,将不同浓度的白藜芦醇(终浓度分别为0、40、80、120 μmol/L)加入各孔中分别培养24、48、72 h后,加入10 μl的MTT溶液(5 g/L)继续置于培养基中4~5 h。去除孔板内的培养基,加入100 μl的DMSO溶液(终浓度<0.1%),摇匀后振荡反应10~15 min。将96孔板放入酶标仪中,于490 nm波长处检测各孔细胞的吸光度值(即OD值)。OD值代表细胞增殖能力的变化。结果取6孔的平均值,重复实验3次;根据结果筛选出最佳的浓度和时间。
1.2.3 Res对HCT-8细胞同种黏附能力的影响 取加药处理且生长状态良好的细胞,胰酶消化制备成细胞悬液(3.5×104/ml),取1 ml细胞悬液均匀接种于24孔板中,常规培养24 h。PBS冲洗3次,取1 ml 0.02%胰酶加入到各孔中,于水平摇床上摇晃10 min和20 min;收集脱落的细胞并计数,其余孔内的细胞用0.25%胰蛋白酶消化并计数。细胞分离率=脱落细胞/细胞总数×100%。
1.2.4 Res对HCT-8细胞异种黏附能力的影响 首先取100 μl纤维蛋白黏连蛋白(5 μg/ml)平铺于96孔板中,室温放置4 h后,采用2%BSA封闭1 h,于4 ℃冰箱中保持备用。取处于对数生长期的K1细胞悬液(密度为4×104/ml)100 μl均匀接种于96孔板,继续培养1 h。弃培养基,将10 μl MTT溶液加入各孔中继续反应4 h。弃除液体,将100 μl的DMSO加入孔中震荡反应15 min。用酶标仪检测并计算其OD值。细胞黏附率=处理组的OD值/空白对照组的OD值×100%。
1.2.5 Res对HCT-8细胞迁移能力的影响 采用Transwell小室试验。取处于对数生长期的细胞,将不同浓度的RES与HCT-8细胞共同培养,用胰酶消化制备成密度为5×105/ml细胞悬液,取200 μl细胞悬液均匀接种24孔Transwell小室的上室,在下室中加入600~700 μl培养基(10%FBS的DMEM培养基),于细胞培养箱中继续培养24 h,每组设置3个复孔。清洁上室,采用4%多聚甲醛固定下室膜表面穿透的细胞至少50 min以上。苏木素染色各组细胞,在倒置显微镜下(100×)随机选取5个视野并计数。实验重复3次。
1.2.6 Res对HCT-8细胞侵袭能力的影响 采用Transwell小室试验。首先按照Matrigel基质胶说明书将Matrigel胶与无血清的DMEM培养基(比例1∶3)混合均匀,取40 μl混合液均匀加入到小室膜的上表面,在紫外线灯下照射4 h以上备用。按照细胞迁移试验进行剩余步骤,每组设置3个复孔,穿膜的细胞数表示细胞侵袭能力的变化。实验重复3次。
1.2.7 Res对HCT-8细胞中E-cadherin、N-cadherin、Vimentin mRNA的影响 采用qRT-PCR方法。RES干预HCT-8细胞后,按trizol法操作提取细胞总RNA,合成cDNA进行PCR扩增。引物E-cadherin:上游引物5′-AGGCTTCCCTCTTTCAT CTCA-3′,下游引物5′-CCATAGTTCCGCTCTGTCTTTGG-3′;引物N-cadherin:上游引物5′-ATTGAAGGTTTGCCAGTGTGC-3′,下游引物5′-TATGGCGTTCTTTATCCGA-3′;引物Vimentin:上游引物5′-GCAATGTTAAGATGGCCCTCA-3′,下游引物5′-ATAGTGGGTATCAACCAGACC-3′;内参引物GAPDH:上游引物5′-AGTGGAAGATGGTGATGGGAGT-3′,下游引物5′-CGTGAAGGTCGGAGTCAACCT-3′。PCR反应条件:预变性95 ℃ 15 s,变性95 ℃ 10 s,60 ℃ 30 s,72 ℃延伸40 s,共40个循环。每组设置3个复孔,利用2-ΔΔCT法计算mRNA的相对表达水平。重复实验3次。
1.2.8 Res对HCT-8细胞中E-cadherin、N-cadherin、Vimentin蛋白的影响 采用蛋白免疫印迹法。首先提取细胞总蛋白,然后BCA法蛋白定量后变性,与蛋白上样缓冲等比例混合,放置-80 ℃保存。按照说明书配制浓缩胶和分离胶,放置30 min,每孔30 μg蛋白上样量,90 V恒压下电泳,完成后转膜(90 V,60~120 min)。封闭1 h,加入一抗,于4 ℃冰箱过夜。次日取出PVDF膜洗净后,加入二抗,37 ℃恒温下孵育1 h。再次洗膜,荧光显色并拍照。以GAPDH为内参,Image J软件分析并计算各组蛋白条带的相对表达量。
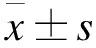
2 结果
2.1 Res对HCT-8细胞增殖活性的影响 Res(0、40、80、120 μmol/L)分别处理HCT-8细胞24、48、72 h后,MTT结果见表1。结果显示,随着Res浓度的提高和作用时间的延长,对细胞增殖活性的抑制能力增强(P<0.05)。与空白对照组相比,Res 120 μmol/L在48 h可以明显抑制细胞的增殖活性(P<0.05)。因此,选择Res 120 μmol/L为最佳浓度用于后续细胞部分实验。
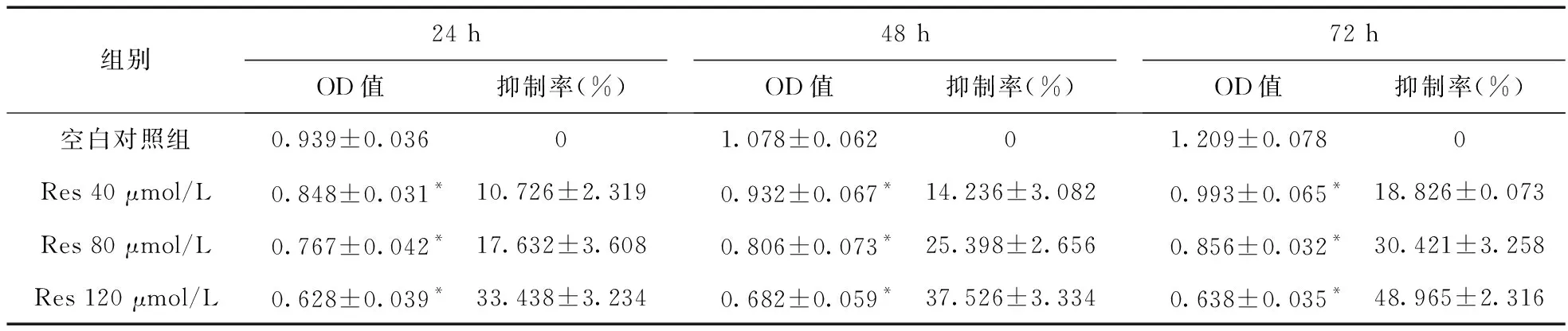
表1 各组HCT-8细胞的OD值
注:与空白对照组相比,*P<0.05
2.2 Res对HCT-8细胞黏附能力的影响 细胞分离试验结果显示,各组细胞处理10 min和20 min时,随着Res浓度的升高,在不同的时间段,细胞的分离率逐渐降低,差异有统计学意义(P<0.01)。异种细胞的黏附试验显示,RES干扰HCT-8细胞48 h后,随着浓度的增加,细胞的异种黏附能力受到抑制,且具有剂量依赖性,差异有统计学意义(P<0.05)。见表2。
2.3 Res对HCT-8细胞侵袭、迁移能力的影响 HCT-8细胞迁移试验如图1所示,空白对照组和Res 120 μmol/L穿膜的细胞数分别为:129.39±5.68和76.46±6.35,两组比较差异有统计学意义(P<0.05)。细胞的侵袭试验结果表明,空白对照组和Res 120 μmol/L穿膜的细胞数分别为:98.52±6.62和65.36±5.53,两组比较差异有统计学意义(P<0.05)。表明Res 120 μmol/L可以明显抑制HCT-8细胞的迁移和侵袭能力。
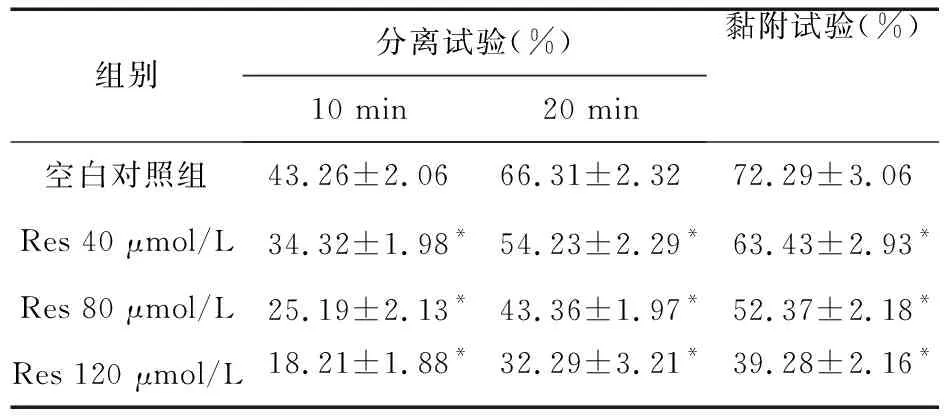
表2 细胞黏附能力的变化(n=3,%)
注:与空白对照组相比,*P<0.05
图1 Res对细胞迁移、侵袭能力的影响
2.4 Res对细胞E-cadherin、N-cadherin、Vimentin mRNA表达的影响 Res 120 μmol/L干预细胞后提取mRNA,qRT-PCR结果显示,与空白对照组相比,Res 120 μmol/L可以上调细胞中E-cadherin mRNA的表达水平(P<0.05),抑制细胞中N-cadherin、Vimentin mRNA的相对表达水平(P<0.05);表明Res可以通过逆转EMT来抑制细胞的侵袭迁移能力。见图2。
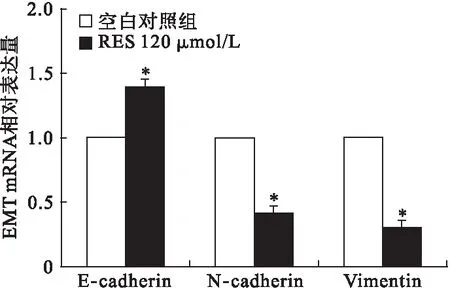
图2 Res对细胞中E-cadherin、N-cadherin、Vimentin mRNA表达的影响(n=3)
2.5 Res对细胞中AKT、P-AKT、E-cadherin、N-cadherin、Vimentin蛋白的影响 Res 120 μmol/L干预细胞48 h,蛋白免疫印迹法结果显示,与空白对照组相比,Res 120 μmol/L可上调细胞中E-cadherin蛋白的表达(P<0.05),抑制细胞中N-cadherin、Vimentin蛋白的相对表达量(P<0.05)。见图3。
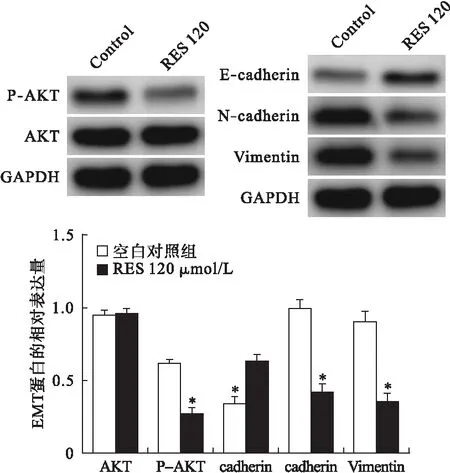
图3 Res对细胞中P-AKT、AKT、E-cadherin、N-cadherin、Vimentin蛋白表达的影响(n=3)
3 讨论
Res(分子式为C14H12O3)是许多植物中常见的多酚类天然化合物,最早在葡萄皮中发现该种物质,随着研究的深入,发现该种化合物广泛存在于藜芦、花生、桑树等多种植物中[8]。研究表明,Res可以通过多种细胞信号通路阻断肿瘤细胞的黏附、侵袭和转移能力,从而达到一定的抗癌能力。在前列腺癌、肝癌、肺癌、乳腺癌等多种肿瘤中,Res通过多种不同的形式参与肿瘤的生长、发生和发展的过程,对肿瘤细胞的增殖活性和浸润能力具有明显的抑制作用[9]。
在消化道肿瘤中,结肠癌的发病率仅次于肝癌和胃癌[10],其发生发展是一个极其复杂的过程,是由多种因素(例如饮食习惯和基因)突变共同造成的结果[11]。中草药在结肠癌的辅助治疗中发挥重要作用。研究表明,在结肠癌的治疗中,Res可能通过改变PTEN的表达水平从而抑制结肠肿瘤细胞增殖活性[12]。本研究前期通过MTT实验发现,随着Res浓度的提高和作用时间的延长,其对HCT-8细胞的增殖活性的抑制能力逐渐增强,与Res可以抑制人结肠癌LoVo细胞的增殖能力的研究结果相一致[7]。
上皮-间质转化(Epithelial-mesenchymal transitions,EMT)是上皮细胞失去极性向间质表型转变的过程,从而使肿瘤细胞获得向周围组织浸润和转移的能力,EMT在肿瘤的发生发展过程中具有重要意义[13-14]。侵袭和转移能力在肿瘤发生发展过程发挥重要作用。EMT作为一种驱动力,使肿瘤细胞发生极性和黏附性的改变,并且促进肿瘤发生侵袭和转移[15-16]。研究表明,在胰腺癌中,Res可以通过阻断肿瘤细胞EMT的发生从而抑制细胞的侵袭和转移能力[17]。在结肠癌中,PAK1通过AKT依赖性途径促进结肠癌细胞增殖和迁移侵袭能力[18]。本研究发现,Res可以增加同种细胞的黏附能力和降低异种细胞的黏附力。在前期筛选出有效的Res 120 μmol/L浓度后,Res 120 μmol/L与结肠癌HCT-8细胞共同培养结果显示,Res 120 μmol/L可以有效地抑制人结肠癌细胞的侵袭和迁移能力。该结果与卵巢癌中Res可以抑制肿瘤细胞的侵袭转移能力的结果一致[19]。进一步蛋白免疫印迹法和qRT-PCR结果表明,Res 120 μmol/L可以使PI3K/AKT信号通路的关键因子P-AKT蛋白降低,EMT上皮细胞标志性E-钙黏蛋白(E-cadherin)表达升高,间质细胞标志性蛋白N-钙黏蛋白(N-cadherin)和波形蛋白(Vimentin)的表达水平下调,而AKT蛋白无明显变化,这与在胃癌中Res可以有效地阻断肿瘤细胞EMT的结果一致[20]。
总之,本研究进一步验证了不同浓度Res对人结肠癌HCT-8细胞的增殖活性和黏附均有抑制作用,Res通过逆转EMT抑制人结肠癌HCT-8细胞的迁移和侵袭能力,其作用机制可能受PI3K/AKT信号通路的调控,这为Res在结肠癌的临床用药研究提供理论依据。
