人工智能在甲状腺癌精准化诊疗中的研究进展*
2020-06-05李铃睿杜博综述陈创审校
李铃睿 杜博 综述 陈创 审校
甲状腺结节是常见的外科疾病之一,B超辅助下监测结节的患病率为19.00%~68.00%[1]。近年来甲状腺癌发病人数不断增加,位居中国恶性肿瘤第7位,女性恶性肿瘤的第4位[2]。中国甲状腺癌5年生存率约为84.30%[3],与美国等发达国家约98.00%[4]的5年生存率仍有较大差距。精准医疗时代,患者独特性和结节多样性决定肿瘤的异质性,必然要求个体化治疗[5]。面对卫生资源不足、医疗水平参差不齐以及诊治不规范等问题,快速准确作出诊断,推进诊治标准化是所有研究者的共同目标。在人工智能(artificial intelligence,AI)飞速发展和医疗资源数据化的推动下,二者联合研究具有较好的应用前景,将逐步运用于临床实践以改进医疗决策方式。本文就AI在甲状腺癌精准化诊疗领域的最新研究进行综述。
1 AI和精准化医学
AI是机器通过不断学习,更新运算来真切地模拟人类反应的科学,其关键是深度学习,包括传统的人工神经网络(artificial neural network,ANN)、支持向量机(support vector machine,SVM)和k 近邻法(k-nearest neighbor,k-NN)等。20世纪60年代,人们受到猫视觉反应网络的启示开发了ANN[6]。其能够从图像、声音和文本等原始资料中识别感兴趣区域(regions of interest,ROIs),发现潜在数据和复杂关系,最终生成决策输出,是一种灵活高效的数学计算模型。AI模型的应用通常需经过训练和验证两个步骤。训练就是模型对ROIs不断学习并进行自我调整的过程,因此训练集越大,越容易学习,模型的可信度越高[6]。卷积神经网络(convolutional neural network,CNN)是卷积理念和ANN的结合。2012年ImageNet大型视觉识别大赛上[7],CNN成功地识别了1 000个类别的100万张图像,与第2名相比错误率降低了10.90%,自此CNN成为AI研究最活跃的领域之一。
甲状腺癌细胞快速但有限的生长后大多停止生长,但部分癌可快速无限生长表现出致死性[8]。此外,高分化甲状腺癌可通过去分化、基因变异和黏附障碍等向致死性肿瘤发展,其中部分亚型无去分化表现却具有侵袭性[9]。甲状腺癌发生发展极其复杂,目前诊疗方法对结节认识有限,过度治疗和治疗不足从远期来看难以界定。因此,只有诊断和预后预测过程的精准化,才能有助于在正确的时间选择正确的患者给予正确的治疗[10]。由于CNN出色的图像信息分析能力,在图像的目标识别、定位和分割等任务中具有明显优势,为解决甲状腺癌精准化诊疗问题提供了新思路。超声图像、细胞涂片及病理切片等二维图像,可为深度学习提供大量数据,使得AI在甲状腺癌领域得到广泛应用,并推进其精准化诊疗的进程。
2 AI在甲状腺癌诊断中的应用
随着网络构架、算法的发展和医疗数据的积累,AI在甲状腺癌诊断中的应用不断深入。其研究主要集中在两个方面:1)精准诊断:良恶性的分类,病理类型的鉴别;2)病灶量化:自动分割、提取病变特征。迄今为止,部分研究已实现产品化。
2.1 超声诊断
超声检查是高频超声照射至软组织,因组织反射能力产生不同的反射波形成图像,具有无放射性、无创、易重复等特点,是甲状腺结节首选的影像学检查。AI在甲状腺超声诊断领域发展最为迅速,主要集中在结节良恶性的分类上。Ma等[11]首次尝试训练两种不同深度的CNN获得融合的特征图对甲状腺结节进行分类。Song 等[12]以金字塔状方式从整体到局部定位并分析结节特征,在分类中与超声医师表现出相似的敏感性和更高的特异性。Li 等[13]在多中心大样本研究中获得相同结果。上述研究开发了计算机辅助诊断(computer-aided diagnosis,CAD)系统的临床应用潜能,但临床知识未得到充分利用[14-15],图像的整体输入和良恶性结果的单一输出、结节的异质性未得到可视的量化分析,缺乏充分解释[16],临床推广受到限制。
多项研究对不同输入量下ANN模型的分类性能进行了探讨。Choi 等[17]以钙化灶的数量、距离比、最大密度和偏斜度4个不同特征及其组合作为输入量;Ardakani等[18]从270个统计纹理特征中选出10个最有效的特征输入;Nguyen 等[19]联合空间和频率方面特征进行分类;上述研究准确率分别为82.80%、97.14%和90.88%。从验证过程看,Liu等[15]构建了以临床知识为向导的卷积神经网络(clinica-knowledgeguided convolutional neural networks,CKG-CNN),该模型在结节不同大小、边缘、形态、纵横比、囊实性和有无钙化等不同群组中诊断的准确性均高于超声医师。Thomas等[16]以输出具有相似特征的图像辅助诊断,而非直接得出良恶性结论。上述研究的主要特点见表1。
由此可见,AI模型可减少超声医生的工作负荷,有效避免不必要的有创检查,且从传统超声特征和数字化结构方面为充分认识结节做出解释。目前已有AI与甲状腺超声联合的商用CAD系统如S-Detect系列,与S-Detect1相比,S-Detect2已能检测到钙化,并分为有无钙化、微钙化、粗大钙化或边缘钙化4类[20]。在临床实践中,多项研究表明此CAD 系统诊断性能与超声医师相比,前者敏感性略高,而特异性和受试者工作曲线下面积(area under the curve,AUC)稍低[20-22]。

表1 AI在超声鉴别良恶性甲状腺结节中的应用
2.2 细针穿刺细胞学诊断
当甲状腺超声图像提示结节有恶性征象时,可考虑行细针穿刺活检(fine needle aspiration biopsy,FNAB)进一步明确结节的性质[1]。FNAB常用外径22~27 G的穿刺针对结节进行穿刺,从中提取细胞成分,通过细胞学特征对病灶进行判断。AI在FNAB中的应用也趋向于甲状腺癌的病理分类和癌细胞的特征分析。
Sanyal等[23]利用CNN在放大倍数(×10和×40)下获取不同特征进行甲状腺乳头状癌(papillary thyroid carcinoma,PTC)和non-PTC分类,准确率为85.06%。Guan等[24]应用VGG-16和Inception-v3模型区分PTC和良性结节获得更优的结果,准确率分别为95.00%和87.50%。但滤泡细胞对PTC识别的干扰均为上述研究的局限之处。滤泡腺瘤(follicular carcinoma,FC)和滤泡癌(follicular adenoma,FA)区别在于是否侵犯包膜或血管,常规FNAB 难以区分。Savala 等[25]在获得滤泡细胞的细胞学特征(滤泡数、细胞数及核特性等)和形态数据(面积、直径、周边及核面积等)的基础上建立了ANN模型,成功地区分了FNAB 涂片中的FC和FA,但此研究纳入样本较少。超过90.00%的甲状腺癌来源于滤泡上皮细胞[1],提高正常滤泡上皮细胞的识别能力可能是未来AI在细胞学中应用研究的重点。
FNAB诊断在细胞病理学TBSRTC报告系统中可分为6级,Ⅲ、Ⅳ级不确定结节存在14.00%~25.00%的恶性风险,临床管理中可选择手术治疗[1],但患者必然承担手术带来的身心负担和术后并发症的风险。Zoulias 等[26]联合ANN、SVM和k-NN 对2 036 张穿刺涂片进行良恶性分类准确率达98.60%,在对FNAB 不确定的结节(73 张)检验时,与FNAB(50.00%)相比,该模型(84.60%)在整体准确率上有显著提高。Alexander等[27]和Patel等[28]均从基因层面对同一组不确定结节良恶性鉴别获得相似的敏感性,前者利用167种相关基因表达分类特异性为52.00%;后者利用RNA 基因测序分类器(genomic sequencing classifier,GSC)特异性为68.00%;嗜酸性细胞肿瘤是Ⅲ、Ⅳ级定性的难点,两者对其分类时特异性分别为11.80%和58.80%。上述两种模型均已实现产品化。AI在不确定结节中的应用将有效减少不必要甲状腺的切除。上述研究主要特点见表2。
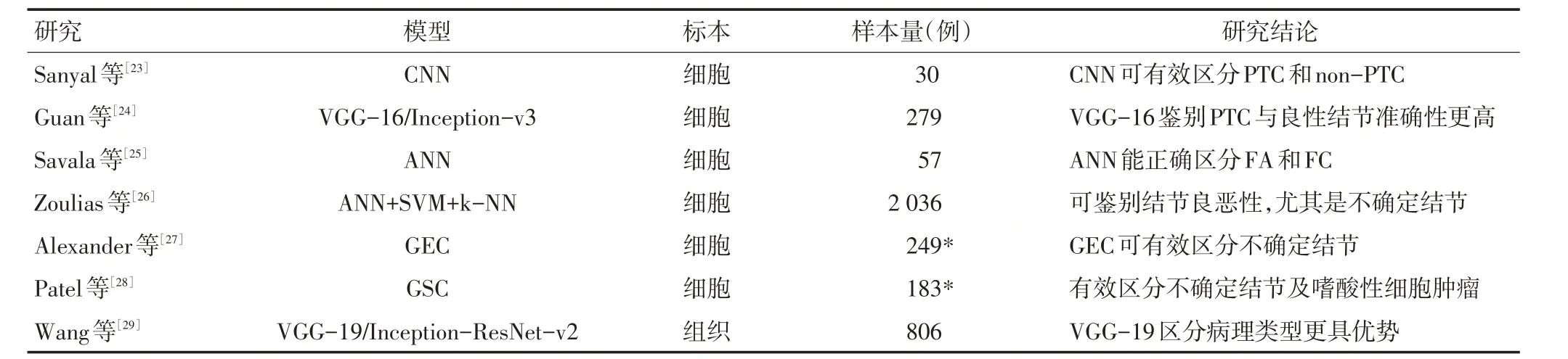
表2 AI在甲状腺病理学中的应用
2.3 组织病理学诊断
组织病理检查是将标本制成切片,辅以免疫分子及基因表达测定,观察细胞和组织的形态结构,识别其来源及变化,最终作出病理诊断,是肿瘤诊断的金标准。Wang等[29]在甲状腺结节病理分类中进行了初步研究。该研究在组织学图像中评价VGG-19和Inception-ResNet-v2 对7个病理类型(正常组织、ATC、FTC、MTC、PTC、结节性甲状腺肿和腺瘤)的诊断性能,结果表明前者平均准确率高于后者(分别为97.34%和94.42%)。VGG-19在所有恶性病理类型中表现出良好的识别能力,值得注意的是MTC 中达到100%,而在正常组织和腺瘤中分别为88.33%和92.44%。可见,AI在组织病理学中识别甲状腺正常组织及良性肿瘤仍具有挑战性。
PTC是甲状腺癌最常见的病理类型,约占85.00%[1],世界卫生组织(WHO)根据肿瘤细胞形状、比例、结构及细胞核特征等将PTC分为含经典型(classical variant,CV)在内的15种亚型,其中高细胞亚型(tall cell variant,TCV)、实性/梁状亚型(solid variant,SV)、鞋钉样亚型(hobnail variant,HV)、弥漫硬化亚型(diffuse sclerosing variant,DSV)及柱状细胞亚型常被认为是侵袭性亚型(aggressive variant of PTC,AVPTC)[30-31]。PTC 总体预后良好,但长期随访后发现复发率可达25.00%,主要与腺外侵犯、淋巴及远处转移等浸润性特征有关[32],AVPTC 常表现出上述特征,是复发独立的中等危险因素[1,33]。在无浸润性表现时AVPTC与CV总体生存相当,当合并任一浸润性特征时二者差异具有统计学意义[33]。各亚型间细胞形态可重叠且有两种及以上亚型并存现象,根据细胞形态特征难以高效鉴别,因此需要更精准的方法对PTC亚型分类。上皮性钙黏附蛋白及β-连环素在AVPTC和部分非侵袭性亚型中差异表达[34]。此外,基因在PTC 进展中起重要作用,如BRAF 突变在TCV和HV表达可达80.00%以上[30],RET/PTC重排与DSV[30]及具有辐射暴露史的SV[31,35]变异相关。有研究表明,免疫细胞浸润与组织分型相关,特别树突状细胞与TCV形态呈正相关[36]。而Yamamoto等[37]根据乳腺肌上皮细胞特征运用SVM模型区分正常组织、导管增生和低/高等级的导管原位癌4种病理类型,准确率为90.90%。可见形态特征、基因分子信息和肿瘤微环境等数据均有利于精准化AI分类模型的构建。
3 AI在甲状腺癌预后预测中的应用
目前,美国甲状腺协会(ATA)风险分层以及美国癌症联合委员会制定的TNM分期和MACIS评分系统在甲状腺癌死亡和复发风险评估中应用广泛,主要根据年龄、肿瘤情况及淋巴结状态等临床病理指标进行评估。2015年ATA 指南已提及BRAF 或TERT状态可辅助临床医生进行危险评估但未常规推荐[1]。上述评估体系正整合临床病理和基因等数据不断完善,但人工评估差异较大,AI技术的应用可加快预后评估的精准化,但目前甲状腺预后AI模型报道有限。
3.1 传统病理参数模型
Jajroudi等[38]利用多层感知器神经网络(multilayer prediction,MLP)和Logistic模型对7 706个样本的16个特征(包括肿瘤位置、大小、分级及病理分期等)进行数据分析,比较了二者在甲状腺癌患者中1、3、5年生存时间的预测性能。结果表明,MLP仅预测1年生存时间的准确性、敏感性及特异性优于Logistic模型(分别为92.90%、92.80%、93.00%和81.20%、88.90%、72.50%)。虽然Faradmal 等[39]在乳腺癌中应用基于病理参数的MLP模型在预测1、2、3年的无病生存时间均优于Log-Logistic模型(平均AUC为0.845和0.744),但是两个模型的预测性随时间推移均有所下降。可见传统病理参数虽有助于甲状腺AI模型进行短期预后预测,但对于远期预后评估的价值有限。
3.2 基因变异通路模型
Zhao 等[40]从甲状腺癌高危组(T2、N1、M1及以上)和低危组(T0、T1、N0和M0期)差异表达的190种基因中筛选出10条基因变异通路为输入量,构建ANN 风险预测模型,两组生存时间差异具有统计学意义。该模型在独立的数据集中验证,识别高低风险组的准确率分别为86.00%和77.50%。AI 基因模型均在乳腺癌[39]、胃癌[41]及卵巢癌[42]的复发生存评估中表现出良好性能,基于基因大数据的甲状腺癌精准化预测有广阔的应用前景(图1)。

图1 AI在甲状腺癌诊断和预后预测中的应用
病理图像是对病变组织的直接反应,切除标本可获得完整的癌巢信息,了解癌巢与周围组织的关系,可为患者的个体化治疗提供预后相关表型和分子信息。Veta 等[43]通过有丝分裂和基因表达量化肿瘤增殖情况评估乳腺癌患者预后。Yuan等[44]联合病理图像和基因表达分析发现间质的空间分布和淋巴细胞浸润是影响生存独立的预后因素,且此联合模型的预测性能优于单一的图像或基因分析。病理图像为深度学习提供形态特征的结构化数据和基因分子等标准化数据,在预后评估中具有明显优势。但基于病理图像的甲状腺癌AI 预后预测模型尚未建立。
4 结语
随着甲状腺癌发病率的升高,诊断和预后评估的精准化需求越来越大。AI在甲状腺癌诊疗中有许多可能性(图1),可提高诊断的准确性和客观性,结合统计数据与现有临床知识充分认识甲状腺结节,量化信息,更有效地进行预后分析,这些方法将有助于临床医生根据患者需要提供从诊断到术后动态的精准化管理。然而目前甲状腺癌AI对医疗数据的运用有限,对滤泡细胞的识别仍具有挑战性,亚型分类和预后预测还有待于深入研究。未来甲状腺癌AI研究可在现有参数基础上,深度分析肿瘤及其微环境,发现高效能指标,对结节精准分类,实现个体化预后预测以指导早期精确治疗。
