油菜细胞质雄性不育系1193A恢复基因SNP位点的TSP分析
2020-06-04胡燕尹明智冶飞碟
胡燕 尹明智 冶飞碟

摘 要:油菜细胞质雄性不育杂种是当前油菜杂种优势利用的主要途径,而恢复基因的连锁标记研究对于恢复系的选育和改良至关重要。本研究基于前期研究结果设计引物对与油菜细胞质雄性不育系1193A恢复基因连锁的2个SNP位点进行TSP标记分析,以期建立一种简单高效易行的油菜雄性不育系1193A恢复基因的SNP分析方法。结果表明,设计的2对TSP标记引物扩增效果较好,可用来进行后续的研究分析。
关键词:油菜;不育系;恢复基因;SNP;TSP
中图分类号:S-3 文献标识码:A
DOI:10.19754/j.nyyjs.20200530007
油菜是我国主要的油料作物之一,具有明显的杂种优势,油菜细胞质雄性不育系统(Cytoplasmic Male Sterility,CMS)是当前油菜杂种优势利用的主要途径,也是最重要的传粉控制系统之一。油菜CMS系统一般包含不育系、保持系和恢复系,而不育系的应用需选育强优势恢复系用来配制强优势杂交种,这对油菜杂种优势的利用是至关重要的[1]。常规的育种方式需大量杂交,育种周期长,工作量大。随着测序技术以及生物技术的发展,分子育种手段也随之发展,其中分子标记技术在分子育种中应用最为广泛。分子标记方法不受外界环境因素的影响,对基因定位及分子育种有重要作用。SNP(Single Nucleotide Polymorphism,单核苷酸多态性)作为第3代分子标记,目前已广泛应用于遗传分析,是一种便于分析,遗传稳定性强的分子标记[2]。SNP的检测方法众多,但有些技术方法较难掌握,且应用成本较大。TSP(Temperature Switch PCR)方法,是由Tabone等[3]提出,优点是只需经过一轮PCR,就可以直接通过琼脂糖凝胶电泳检测SNP位点,方法简便易行。目前TSP方法在大麦[4]、小麦[5]、葡萄[6]等物种的SNP位点检测分析中都有了成功的应用。
前期研究中通过属间杂交获得了油菜新型胞质雄性不育系1193A[7],并通过大量的测交发现了其恢复系。通过油菜60K SNP芯片,结合BSA法将恢复基因初步定位在C09染色体上,并发现了2个连锁的SNP位点[8],本研究将对这2个SNP位点进行TSP标记分析,以期建立一种简单高效易行的油菜雄性不育系1193A恢复基因的SNP分析方法。
1 材料与方法
1.1 实验材料
不育系1193A与恢复系1193R2的种子均由国家油料改良中心湖南分中心提供。
1.2 油菜基因组DNA的提取
利用CTAB法提取基因组总DNA。
1.3 TSP标记检测SNP位点
根据前期油菜60K SNP芯片分析的研究结果[8],本研究对Bn-scaff_ 17487_ 1-p1890044和Bn-scaff_ 22835_ 1-p525830 2个SNP位点进行TSP标记的引物设计,其引物设计原则参照Tabone等提出的原则进行设计[3]。设计2个位点特异性引物和1个等位基因特异性引物,其中,位点特异性引物是在SNP位点的两侧,引物退火温度为63℃,等位基因特异性引物在SNP位点上游,退火温度为45℃,然后在5′端人工添加2~3bp的核苷酸序列[6]。
PCR反应体系为20μL,其中包括:ddH2O 10.6μL,10×缓冲液2μL,每个引物0.2μmol/L,dNTPs 0.2μmol/L,Taq酶1U,DNA 50ng。PCR扩增程序为:95℃预变性5min;先94℃40s,60℃40s,72℃40s,15个循环;然后94℃10s,45℃30s,5个循环;最后94℃40s,54℃40s,72℃10s,15个循环。采用1.5%的琼脂糖凝胶电泳检测扩增结果。
2 结果与分析
2.1 SNP位点及引物设计
针对SNP标记分析时TSP方法设计引物的要求,对前期研究开发的位于C09染色体上的,与恢复基因连锁的SNP位点Bn-scaff_ 17487_ 1-p1890044和Bn-scaff_ 22835_ 1-p525830进行了分析,并设计TSP标记引物用于后续的检测分析。
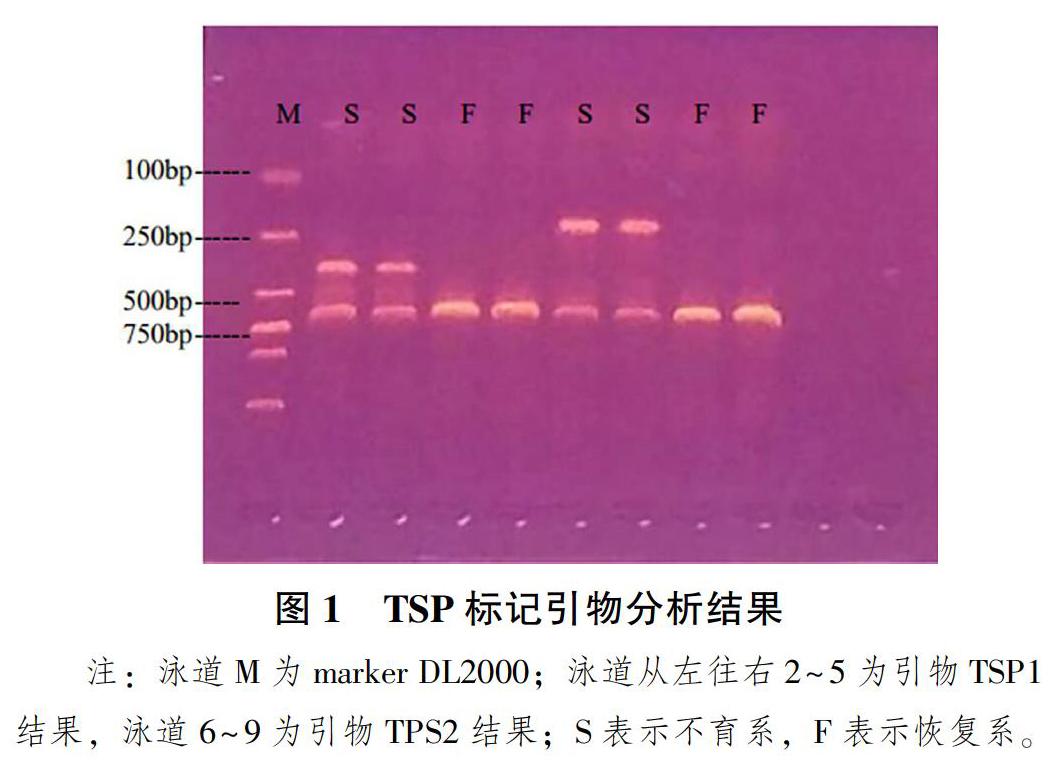
2.2 SNP位点TSP标记分析结果
用3对TSP标记引物对2个SNP位点进行PCR扩增检测,结果显示:有2对TSP标记引物能扩增出与预期长度相吻合的PCR产物,电泳条带较清晰。如图1所示,利用引物TSP1和TSP2对候选SNP位点A/G进行TSP标记分型,从电泳条带可得出,引物TSP1檢测不育系1193A在720bp和380bp左右各有1条带,引物TSP2检测不育系1193A在720bp和200bp左右各有1条带,而恢复系1193R2均是在720bp左右的1条带,说明通过TSP1和TSP2标记能够检测Bn-scaff_ 17487_ 1-p1890044所在的SNP位点差异。而设计的TSP3标记引物对Bn-scaff_ 22835_ 1-p525830处的SNP位点进行检测没有获得预期的结果,可能是引物设计不合理,或PCR条件不佳造成的。
3 讨论
油菜CMS系统有同源胞质不育系和异源胞质不育系。不育系1193A为属间杂交后代选育而来的异源胞质不育系,而这种不育系往往存在恢复源较窄的问题。为了有利于发现更多的恢复源材料,选育出恢复系,人们常常会将不育系与大量的材料进行广泛杂交,再观察杂交后代的育性表现,但这样工作量大,时间较长。分子标记辅助育种技术能缩短育种周期,近几年在作物品种育种中发挥了重要作用,日渐受到育种家的喜爱。对恢复系进行分子标记研究,找到与恢复基因紧密连锁的标记,可为恢复系的选育提供技术支撑,提高选择效率和准确性。TSP标记引物检测方便,成本较低,结果的可靠度也较高,只需进行一轮PCR即可直接从电泳结果分析SNP位点,是AS-PCR的升级版[9],适用于一般实验室开展SNP检测。本研究设计了TSP标记引物3对,用于检测不育系1193A恢复基因的SNP位点差异,结果表明,其中2对扩增效果较好,可用来进行后续的研究分析。这为通过简单易行的方式选育恢复源材料提供了技术支撑。
参考文献
[1] 程计华,李云昌,梅德圣,等.几种农作物细胞质雄性不育恢复基因的定位和分子标记研究进展[J].植物学通报,2006,23(6):613-624.
[2]Kim S,Misra A. SNP genotyping:Technologies and biomedical applications[J]. Annual Review of Biomedical Engineering,2007(9):289-320.
[3] Tabone T,Mather D,Hayden M. Temperature Switch PCR(TSP):Robust assay design for reliable amplification and genotyping of SNPs[J]. BMC Genomics,2009,10 (1):580.
[4] Hayden M J,Tabone T,Mather D E.Development and assessment of simple PCR markers for SNP genotyping in barley[J]. Theoretical and Applied Genetics,2009,119 (5):939-951.
[5] Huang X Q,Brlé-Babel A. Sequence diversity,haplotype analysis,association mapping and functional marker development in the waxy and starch synthase IIa genes for grain-yield-related traits in hexaploid wheat(Triticum aestivum L.)[J]. Mol Breeding,2012(30):627-645.
[6]郭大龍,李猛,张国海,等.葡萄SNP标记的CAPS和TSP分析[J].园艺学报,2013,40(11):2307-2315.
[7]尹明智,官春云.甘蓝型油菜细胞质雄性不育系1193A的选育及分析[J].西南农业学报,2017,30(9):1947-1953.
[8]尹明智.野油胞质雄性不育系1193A的研究[D].长沙:湖南农业大学,2014.
[9]雷天刚,何永睿,彭爱红,等.柑橘CAPS标记和AS-PCR引物的开发[J].园艺学报,2012,39(6):1027-1034.
(责任编辑 贾灿)
