食欲素B增强视皮层第2/3层传入到第6b层锥体神经细胞的突触传递
2020-06-02黄梦瑶
黄梦瑶,童 昕,蒋 斌
(中山大学中山医学院广东省脑功能与脑疾病研究重点实验室,广东广州 510080)
食欲素(orexin 或hypocetin)是由下丘脑外侧区食欲素神经细胞合成和分泌的兴奋性神经肽,分为Orexin A 和Orexin B(hypocretin-1 and hypocretin-2),主要参与睡眠觉醒、能量代谢、奖赏与药物成瘾等重要生理功能的调节[1-5]。食欲素结合食欲素1 型受体(orexin 1 receptor,OX1R)或食欲素2 型受体(orexin 2 receptor,OX2R)后发挥生物学作用,在大脑皮层中以OX2R 的分布为主[6-8]。而在皮质下,除了蓝斑神经元以OX1R 为主,OX2R 也占较大比例,食欲素与受体相结合后,通过降低钾通道电导、激活钠钙离子交换体和非选择性阳离子通道,提高神经元兴奋性,以及调节突触传递等作用[6]。Orexin 神经元胞体位于下丘脑外侧区,以及穹隆周围核,但其神经纤维广泛的投射至整个大脑皮质区域,包括视皮层[9-11]。在小鼠的初级感觉皮层包括视皮层、体感皮层、运动皮层的第6b 层(layer 6b,L6b)中均发现有一些神经元可以被OX2R 的激动剂所激活产生高频发放的动作电位,称之为Orexin 敏感的神经元[12]。然而皮层L6b 层的细胞种类繁多,根据神经元的形态和电生理特性分为以下5 种类型:锥体神经元(pyramidal neuron)、多极神经元(multipolar spiny neuron)、水平朝向神经元(“horizontally”oriented neuron)、倒置朝向神经元(“inverted”neuron)、以及不定朝向神经元(“tangentially”oriented neuron)[13]。为了明确小鼠视皮层L6b 中的Orexin敏感的神经元的具体细胞类型,我们首先用细胞生物素(biocytin)标记视皮层中L6b 对Orexin 敏感的细胞、外膝体注射逆行标记荧光染料(CTB555)标记L6b 反馈投射到外膝体的神经元,再研究食欲素是否调控这些反馈投射到外膝体的神经元接受第2/3 层的传入的突触传递及其机制。结果表明小鼠视皮层L6b 层中,Orexin B 敏感的神经元主要是锥体神经元和多极神经元。外源Orexin B 受体的激动剂,显著增强反馈投射到外膝体的神经元接受2/3 层的神经传入的突触传递。Orexin B通过增强第2/3 到L6b 锥体细胞的突触传递和直接兴奋L6b 层的锥体神经元两个途径来强化L6b层细胞的活动,加强到外膝体的反馈控制。
1 材料与方法
1.1 实验动物
本实验所涉及的动物实验获得中山大学实验动物伦理委员会批准[中山医动伦(2018)第156号],并严格遵循动物伦理要求进行动物实验操作。本实验采用P19-P28 的雌雄C57BL/6J 小鼠(SPF 级,购于中山大学动物实验中心)。分笼饲养,自由摄入水食,室温控制在(22±1)℃,12-12 h昼夜循环光照。实验动物严格遵守《中山大学实验动物管理条例》,实验后,动物尸体按照中山大学实验动物管理办法进行处理。
1.2 脑立体定位注射逆行标记荧光染料CTB555
选择P19-P21 左右的C57 小鼠,称重,按剂量1 mL/20 kg 体质量,腹腔注射0.5%戊巴比妥钠溶液使之麻醉。根据小鼠大脑立体定位图谱确定外侧膝状体(lateral geniculate nucleus,LGN)的坐标,将Bregma 定为零点(0,0,0),Bregma 后2.3 mm,中线左右(2.0~2.1)mm,用颅骨钻打磨颅骨,钻出合适大小的骨窗。注射浓度为2 mg/mL 的CTB555(Cholera Toxin Subunit B,Alexa FluroTM555 Conjugate,Invitrogen,USA)0.2 μL,注射速度控制在0.02 μL/min。为了保证足够的注射量和扩散面积,在相应位置上注射两个点。注射完毕后留针5~10 min。动物苏醒后,正常条件下饲养。整个实验过程中将小鼠置于恒温37 ℃的电热毯上,并涂上眼膏防止小鼠眼睛干燥。
1.3 视皮层脑片制备
选用P22-28 的健康C57BL/6J 小鼠,异氟烷麻醉,快速断头,打开颅骨,取出大脑放入氧饱和的冰冷切片液中,1 min 后转移至预冷的装有冰冷切片液的平板中修块,去除小脑组织,切下大脑枕叶,以横断面为底座用瞬间粘合胶固定到振动切片机平台上,随后立即倒入冰冷切片液浸没脑组织,通以体积分数95%O2和5%的CO2混合气体。调整切片机速度为3,振幅7~8,将脑组织切成8~10 片300 μm 厚度的含有视皮层的冠状脑片,后随即转移至氧饱和的人工脑脊液(artificial cerebrospinal fluid,ACSF)中,34 ℃孵育30 min,后转移至室温使用。
1.4 脑片上记录细胞的自发兴奋性突触后电位
用装有电流钳内液的玻璃电极(内含0.2%Biocytin,Sigma,USA),电流钳方式钳住皮层第6b层(L6b)中的神经细胞,记录L6b 中各种细胞上的自发兴奋性突触后电位(spontaneous excitatory postsynaptic potential,sEPSP;图1、2)。待细胞稳定下来后(约3 min),置换成含有100 nmol/L Orexin B(Tocris Bioscience,UK)的ACSF(其中含有兴奋性和抑制性突触受体的阻断剂),给药灌流3 min 后,再用普通ACSF 进行洗脱,观察被记录的细胞是否能被Orexin B 的激动剂所兴奋。本实验通过PClamp 软件可以实现封接电阻,串联电阻和输入电阻的读取,并在实验全程对串联电阻进行实时监控,对于串联电阻前后变化不超过20%的数据才进行统计分析。
1.5 标记L6b 神经细胞类型
细胞载入Biocytin 后(至少持续记录sEPSP 5 min),缓慢移出电极,保持细胞活性状态,即刻将脑片转移至40 g/L 多聚甲醛溶液中固定,避光保存于4 ℃冰箱。24 h 后,取出脑片盛放在12 孔板的小孔里,用0.01 mol/L PBS 溶液漂洗3~5 次。再将脑片放入体积分数0.3% Triton-100 的PBS 中2 h。按1∶200 稀释度加入Avidin 555(Streptavidin,Alexa Fluro 555 conjugate,Invitrogen corporation,USA),混匀后,用锡纸包裹,放置4℃冰箱过夜。后再用0.01 mol/L PBS 溶液漂洗,双光子显微镜扫描拍照,观察细胞的形态(图1、2)。
1.6 自发兴奋性突触后电流和微小兴奋性突触后电流的记录
外膝体注射CTB555 一周后的小鼠,异氟烷使之麻醉,断头,制作视皮层脑切片。电压钳模式下,钳住经CTB555 标记的、反馈投射到外膝体的L6b 中的神经元(图3),将膜电位钳制于-70 mv,记录细胞的自发兴奋性突触后电流(spontaneous excitatory post synaptic current,sEPSC;图4A),先用普通的ACSF 记录3 min,然后换成含有100 nmol/L Orexin B(Tocris Bioscience,UK)的ACSF(其中含有兴奋性和抑制性突触受体的阻断剂),给药灌流3 min 后,再用普通ACSF 进行洗脱。观察外源Orexin B 给药后,由LGN 逆行标记的视皮层L6b 细胞是否产生内向电流。
微小兴奋性突触后电流(miniature excitatory post synaptic current,mEPSC)与sEPSC 一样,只是在灌流液ASCF 中分别加入Tetrodotoxin(TTX,1 μmol/L)、Picrotoxin(50 μmol/L)、CNQX(20 μmol/L)以及APV(100 μmol/L)阻断所有突触传递(图4C)。通过比较Orexin B 加药前后的振幅和频率,判断Orexin B 对Orexin B 敏感神经元的作用是突触前作用还是突触后作用。
1.7 Evoked EPSC(eEPSC)的记录
外膝体CTB555 注射一周后的小鼠,异氟烷使之麻醉,断头,制作视皮层脑切片。电压钳模式下,钳住被经CTB555 标记的、反馈投射到外膝体的L6b 中的神经元,将电极尖端直径为125 μmol/L的双极同心圆电极放置于视皮层的第5 层(L5),刺激来自L2/3 的传入到该细胞的神经传入,记录由电刺激L2/3 引起的AMPAR-EPSC(图5、6)。实验通过PClamp 软件可以实现封接电阻,串联电阻和输入电阻的读取,并在实验全程对串联电阻进行实时监控,对于串联电阻前后变化不超过20%的数据才进行统计分析。
1.8 数据的统计与分析
本实验所以的电生理数据均由PClamp 软件记录并分析处理,mEPSC 数据由Minianalysis software 软件分析,最后用GraphPad software 对数据进行t检验或方差分析。
2 结果
2.1 Orexin B 直接兴奋小鼠视皮层第6b 层中的神经元
为了探究小鼠视皮层L6b 中的神经元细胞类型以及是否存在对Orexin B 敏感的神经元,我们在P19-P28 C57BL/6J 小鼠视皮层离体脑片上,在电流钳模式下,用含有0.2% biocytin 的记录电极随机钳住细胞,记录神经元的兴奋性突触后电位(sEPSP)。由于哺乳动物神经元的静息电位离阈电位之间有一定的差值,因此我们通过改变灌流液ACSF 中的K+浓度,适当降低神经元的膜电位水平使细胞的膜电位接近阈电位水平。观察Orexin B 灌流给药3 min 后,记录电位的变化。为了减少药物干扰,所有实验每个脑片只记录一个细胞,实验结束后立即将脑片转移至40 g/L 的多聚甲醛中固定,后续通过免疫染色后,在双光子显微镜下对细胞进行形态分析。结果显示,小鼠视皮层L6b 中细胞的形态主要有锥体神经元、多极神经元、水平朝向神经元、倒置朝向神经元、以及不定朝向神经元(图1 A、D 和图2A、D、G),结果与文献报道的一致[13]。分析每种细胞对应的电生理数据(图1B、E 和图2B、E、H)发现,小鼠视皮层中确实存在Orexin B 敏感的神经元(图1B、E)。通过外源激活Orexin B 受体可以直接对Orexin B敏感细胞产生兴奋性调节效应。其中大部分锥体细胞(58.1%)和多极细胞(52.9%;图1 C、F)为Orexin B 敏感的神经元。在Orexin B(100 nmol/L)作用3 min 后,细胞膜发生去极化并伴有成串的动作电位,且随着正常的ACSF 洗脱,动作电位的频率降低。然而水平朝向神经元、不定朝向神经元和倒置朝向神经元在Orexin B(100 nmol/L)作用前后膜电位水平无明显变化(图2B、E、H)。说明水平朝向神经元、不定朝向神经元和倒置朝向神经元为Orexin B 不敏感神经元。
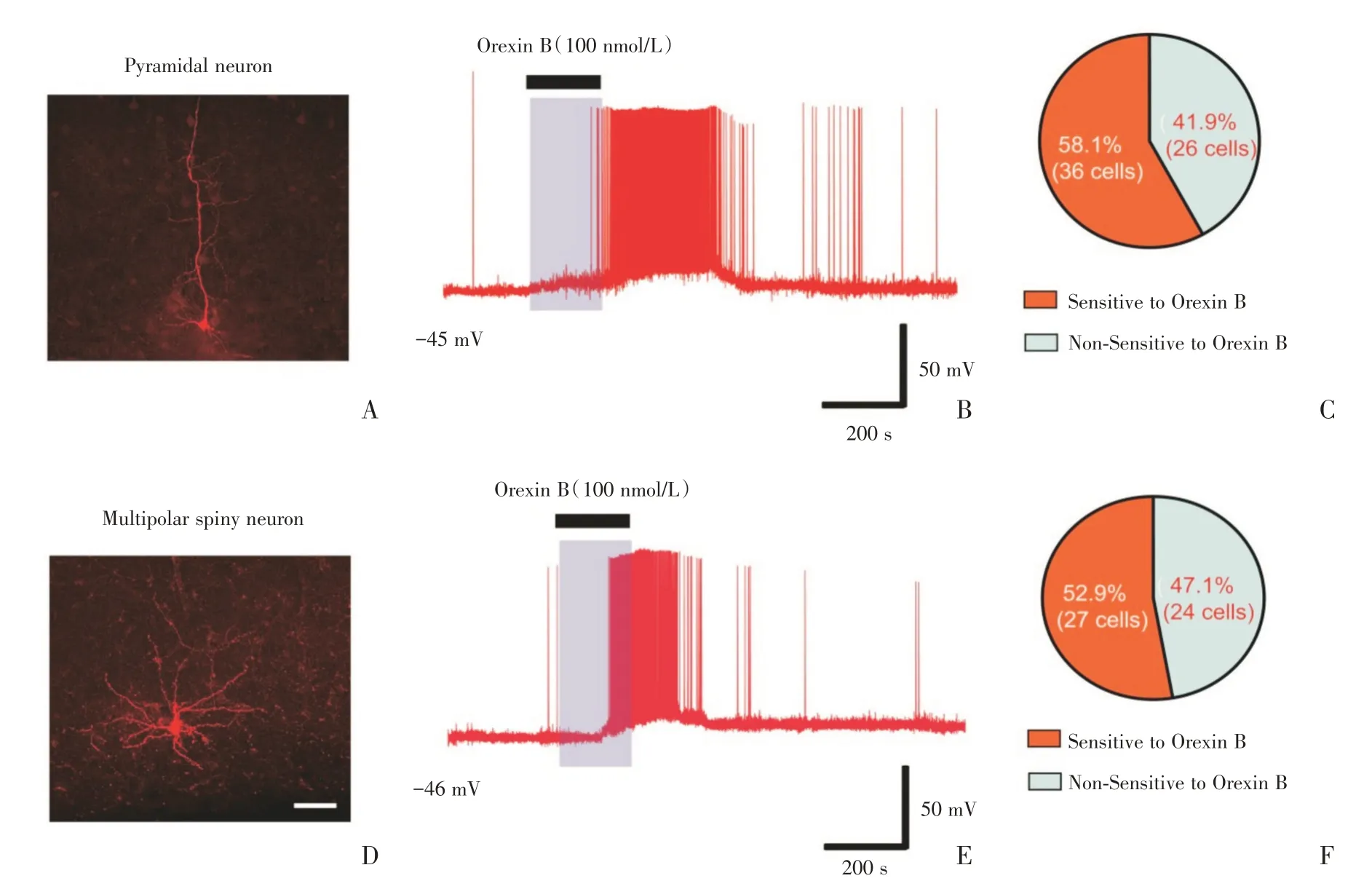
图1 Orexin B 直接兴奋小鼠视皮层第6b 层中的锥体神经元和多极神经元Fig.1 Orexin B directly excited the pyramidal neuron and multipolar spiny neuron in layer 6b of visual cortex

图2 小鼠视皮层第6b 层中水平朝向神经元、不定朝向神经元和倒置朝向神经元为食欲素不敏感神经元Fig.2 Horizontally oriented neurons,inverted neurons and tangentially oriented neurons were Orexin B-insensitive neurons in layer 6b of visual cortex
2.2 逆行标记荧光染料CTB555标记视皮层第6b层中的神经元
视皮层L6b 同时接收来自第2/3 层纤维自上而下的传入,同时也接受来自外膝体纤维自下而上的传入。因此视皮层中L6b 也是一个重要的输出层,反馈投射到LGN 以及其它间脑核团。为了标记视皮层第6b 中的神经元,我们在小鼠两侧的LGN 中注射逆行病毒标记物CTB555(图3A),7~10 d 后切脑片在双光子显微镜下观察病毒标记情况。结果(图3B)所示,病毒染料CTB555 成功标记了视皮层L6b 中的神经元,即第6b 层中反馈投射至LGN 的神经元。
2.3 Orexin B 增大视皮层第6b 层中投射到外侧膝状体的神经细胞的兴奋性突触后电流的振幅
为了研究Orexin B 对视皮层L6b 层中投射至LGN 的神经元的兴奋性突触后电流(sEPSC)的作用,我们在电压钳模式下,采用全细胞记录模式,记录被CTB555 标记的红色荧光细胞的sEPSC(图4),在被CTB555标记的红色荧光细胞上,直接激活Orexin B受体可以记录到去极化电流(图4A)。为了研究Orexin B 的浓度与去极化电流之间的关系。采用10、20、50、100 和200 nmol/L 进行浓度梯度灌流,相关系数为0.7168,P=0.0212,发现两者之间为正相关关系,且100 nmol/L时引起的去极化电流已达到最大值[10 nmol/L:(24.78±2.03)pA,n=13 cells,8 mice;20 nmol/L:(53.12±2.24)pA,n=13 cells,6 mice;50 nmol/L:(74.56±2.66)pA,n=17 cells,8 mice;100 nmol/L:(79.5±2.41)pA,n=12 cells,7 mice;200 nmol/L:(83.56±2.36)pA,n=12 cells,7 mice;图4B;F=99.69,P<0.000 1]。
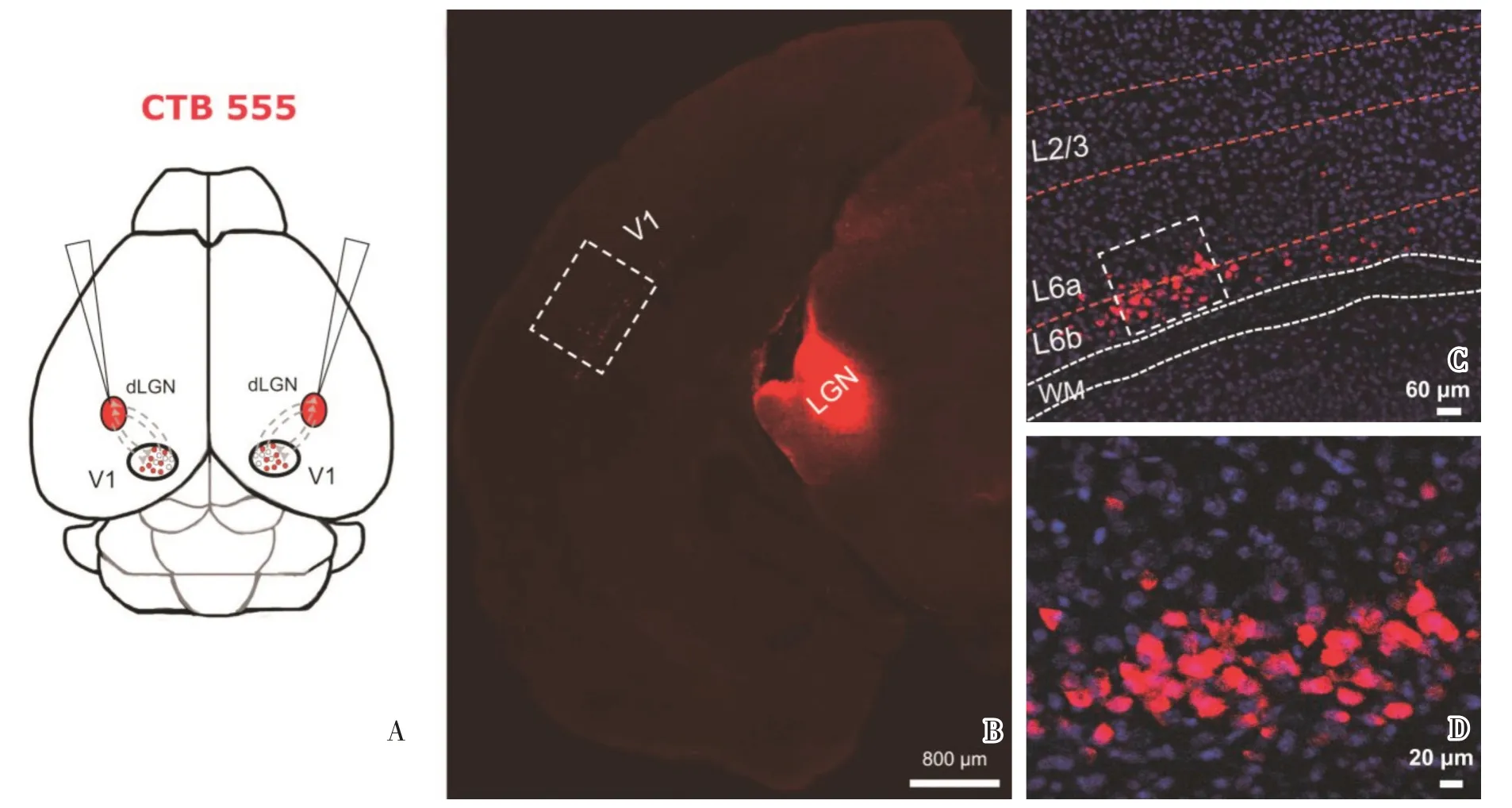
图3 标记小鼠视皮层第6b 层中投射至外侧膝状体的神经元Fig.3 Neurons in L6b of visual cortex projecting to the dorsal lateral geniculate nucleus labeled by CTB555
为了进一步研究Orexin B 引起的去极化效应是源于突触前还是突触后,我们在ACSF 中分别加入Tetrodotoxin(TTX,1 μmol/L),Picrotoxin(50 μmol/L)、CNQX(20 μmol/L)以及APV(100 μmol/L)阻断所有突触传递并记录微小兴奋性突触后电流(mEPSC),将细胞钳制于-70 mv,稳定记录3~5 min,后切换含Orexin B 的灌流液,记录5~8 min,用mini-analaysis 分析统计mEPSC 的振幅和频率(图4C)。发现Orexin B 增加了mEPSC 的振幅[Ctr:(9.36±0.034)pA,Orexin B:(11.51±0.036)pAn=19 cell from 7 mice,pairedt-test,P=0.03]但其频率没有变化[Ctr:(1.48±0.08)Hz,Orexin B:(1.55±0.09)Hz,n=19 cell from 7 mice,pairedt-test,P=0.67],该结果说明Orexin 增强突触传递是通过突触后效应(图4D)。
2.4 Orexin B 增强视皮层第6b 层中投射到LGN的神经细胞接受第2/3 层神经传入的突触传递
为了探究Orexin B 是否调节L6b 的Orexin B敏感神经元接受第2/3 神经传入的突触传递,用金属电极刺激来自第2/3 的神经传入,电压钳钳住L6b 中被CTB555 标记的荧光细胞,记录兴奋性突触后电流(eEPSC)。将细胞膜电阻变化前后不超过10%,系列电阻变化不超过15%的记录细胞数据纳入分析(图5A)。Orexin B 加入后,EPSC 逐渐增大,到药物开始洗脱时EPSC 达到最大值,随着洗脱减小,最后趋于平缓(图5A、C)。EPSCs的记录为每15 s 给予一对刺激,刺激时间间隔为0.1 s(图5A),通过对配对脉冲比率(paired-pulse ratio,PPR)的值(PPR=P2/P1,P1 和P2 分别为第1个刺激和第2 个刺激诱发EPSC 的振幅大小)。
Orexin B 加药之前PPR 为1.21±0.05,加药后PPR 为1.17±0.05(n=20 cells,pairedt-test,P=0.64;图5B),加药前后PPR 无显著变化,因此Orexin B 对L6b 中其敏感神经元上来自第2/3 层的输入纤维突触传递的增强作用是突触后效应。为了探究Orexin B 对L6b 层中来自2/3 层传入纤维的突触传递的增强是否也存在剂量依赖性效应,我们分别用不同浓度的Orexin B 20、50 和100 nmol/L 的Orexin B 重复上述实验。发现Orexin B浓度越大,加药后突触后电流(EPSC)增大越明显[加入Orexin B并洗脱后20~25 min,100 nmol/L:(130±2.5)%,n=19 cells,8 mice;50 nmol/L:(117±2.7)%,n=10 cells,5 mice;20 nmol/L:(105±1.8)%,n=9 cells,5 mice;图5D,F=19.86,P<0.000 1]。

图4 Oreixn B 在视皮层第6b 层中投射至LGN 的Orexin B 敏感神经元的sEPSC 和mEPSC 的效应Fig.4 The effects of Orexin B on the sEPSC and mEPSC in Orexin-sensitive neurons in layer 6b of visual cortex
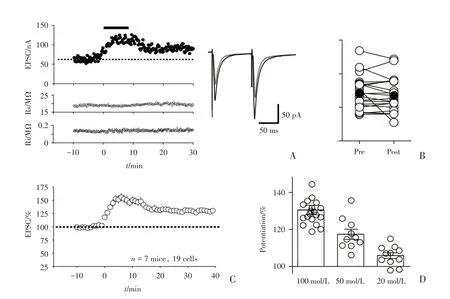
图5 Orexin B 增强视皮层L6b 层中Orexin 敏感神经元上接受第2/3 层神经传入通路的突触传递Fig.5 Orexin B enhanced the synaptic transmission onto Orexin B-sensitive neurons in layer 6b from layer 2/3 input
2.5 Orexin B 的突触传递增强效应由ORX2 介导,mGluR5 的参与,并激活PLC 引起胞内Ca2+上调而产生
为探索Orexin B 增强第2/3 层传递到Orexin B敏感神经元的突触传递的具体机制,我们首先加入OX2R 受体的阻断剂TCS OX2R 29(10 μmol/L),发现增强现象被阻断[加入Orexin B 并洗脱后20~25 min,(Ctr:(119.33±2.51)%,n=15 cells,7 mice;TCS OX229:(103.17±2.75)%,n=30 cells,10 mice);图6A;unpairedt-test,P=0.000)]。为了研究OX2R 受体激活后引起的细胞内分子机理,我们加入磷脂酶C(phospholipases C,PLC)的阻断剂U173332 后,Orexin B 的增强作用也被阻断[Ctr:(125.51±1.4)%,n=11 cells,5 mice;U173332:(103.89±1.04)%,n=10 cells,5 mice;图6B,unpairedt-test,P=0.000],表明OX2R 受体激活后,导致细胞内的PLC 活性上调。在电极内液中加入BAPTA(胞内Ca2+的螯合剂10 mmol/L),细胞破膜形成全细胞模式5 min 后开始记录,以使BAPTA 扩散进入细胞。在BAPTA 存在的情况下,Orexin B 的增强效应也完全被阻断[Ctr:(125.54±1.53)%,n=11 cells,5 mice;BAPTA:(102.86±1.7)%,n=9 cells,4 mice;图6C;unpairedt-test,P=0.000)]。因此,Orexin B 的增强作用需要胞内Ca2+水平升高。加入受体mGluR5 的拮抗剂,MPEP(10 μmol/L),Orexin B 的增强效应也被阻断[Ctr:(126.14±3.87)%,12 cells,5 mice;MPEP:(106.32±2.65)%,n=12 cells,6 mice,unpairedttest,P=0.000],表明Orexin B 调控第2/3 层传入到L6b 中的orexin 敏感神经元的突触增强效应是由ORX2 介导,mGluR5 的参与,并激活PLC 引起胞内Ca2+上调而引起。

图6 Orexin B 增强食欲素敏感神经元接受第2/3 层神经传入的突触传递的机制Fig.6 The mechanisms of Orexin B to enhance synaptic transmission onto Orexin B-sensitive neurons from layer2/3 inputs
3 讨论
大脑皮层由6层组成,各层中呈现出不同的神经细胞类型以及不同的神经连接。作为多形细胞层的第6 层又分为位于浅部的第6a 层(L6a)和深部临近白质(white matter,WM)的6b 层(L6b)[14-16]。尽管有报道[12]发现视皮层L6b 亚层中的一些细胞对Orexin 敏感,即激活Orexin B 可以直接兴奋L6b中的一些神经元。但没有明确具体的神经细胞类型。本研究发现Orexin B 能直接兴奋第6 层中的大部分的锥体神经元和多极神经元,但Orexin B不直接兴奋L6b 中的水平朝向神经元,倒置朝向神经元和不定朝向神经元。我们还发现在L6b 中由CTB555 标记的、反馈投射到外膝体的神经元92.5%为锥体神经元,且这些锥体神经元中有63.3%对Orexin 敏感[17],因此,Orexin B 除了直接兴奋由外膝体逆行标记的锥体神经元和多极神经元外,还增强第2/3 层传入到位于L6b 中由CTB 555 标记的,反馈投射到外膝体的锥体神经元之间的突触传递。
探索L6b 中Orexin 敏感细胞的形态和神经连接以及Orexin 在视皮层内部突触传递中的效应对理解Orexin 在视觉处理中的作用至关重要。视觉信号由视网膜传送到丘脑的外膝体,信号经处理后主要传递到视皮层第4 层,少量传至到第2/3 层以及第5/6 层[18-19],而视皮层的第6 层也将接受视皮层第2/3 层的信号反馈传递给丘脑背侧外膝体(dLGN)和丘脑侧后核群(LP),从而形成重要的反馈环路[20-21]。第6 层到外膝体的反馈环路在视觉信息的筛选和精练中起重要作用。第6 层细胞的活动加强,即加强了L6b 细胞到外膝体的反馈控制可以锐化LGN 的视觉信息并传到第4 层,因此,第6 层细胞是外膝体信息传入的监控器,放大或减弱LGN 到视皮层的信息输入[22]。研究结果提示:Orexin B 通过增强第2/3 到第6 层锥体细胞的突触传递和直接兴奋第6 层的锥体神经元两个途径来强化第6 层细胞的活动,加强到外膝体的反馈控制。由于Orexin 的主要作用是维持动物的觉醒状态[1-2],据此推测动物在清醒的状态,投射到视皮层的Orexin 系统激活后强化第6 层细胞的活动,可使动物在清醒、警觉的状态下更为有效地对视觉信息有效的筛选,增强视皮层对视觉信息的分辨率。
食欲素直接兴奋大脑中的某些神经元,特别是在感觉皮层的机制已有详细的报道[12],Orexin使神经元产生缓慢而持久的去极化,这种变化足以使神经元爆发动作电位,若神经元已经爆发动作电位,Orexin 则可以提高其放电频率。概括起来,Orexin 对神经元的去极化可归因于三个机制:①在静息电位时关闭钾离子通道[23];②Na+/Ca2+交换器的激活[24-25];③非选择性阳离子通道(NSCCS)的激活[26-27]。我们的结果表明在视皮层,Orexin B 选择性地作用于L6b 中的锥体神经元。Orexin B 增加了mEPSC 的振幅,但频率却不受影响,表明Orexin B 对L6b 中的锥体神经元的作用是通过直接的突触后作用。第6 层锥体细胞膜上的OX2R 在Orexin B 的激活下发挥作用。
尽管已有研究表明初级视皮层第6b 是对Orexin有反应的唯一亚层[12]。然而Orexin B参与对第6b层其敏感的神经元接受的传入纤维的突触传递的调控至今未见报道。本文研究了Orexin B 调节小鼠视皮层L6b 层锥体神经元接受来自L2/3 信息传入的突触传递的效应以及生理学机制,发现Orexin B 增强L6b 的锥体神经元接受第2/3 层传入纤维的突触传递,这种突触增强效应由ORX2 介导,mGluR5 的参与,并激活PLC 引起胞内Ca2+上调而引起。在视觉信息传递过程中,通过接收L2/3的前馈传入,从而增强第6b 锥体细胞的兴奋性。
