阿帕替尼与5-氟尿嘧啶联合应用对人胃癌细胞AGS 增殖、凋亡及迁移的影响Δ
2020-05-28赵鹏飞甄洪超曹邦伟1首都医科大学附属北京友谊医院放疗科北京100050首都医科大学附属北京友谊医院肿瘤科北京100050
赵鹏飞,甄洪超,赵 磊,王 婧,曹邦伟1,#(1.首都医科大学附属北京友谊医院放疗科,北京 100050;.首都医科大学附属北京友谊医院肿瘤科,北京 100050)
胃癌是常见的恶性肿瘤之一,最新统计报告显示,2018 年度全球胃癌新发病例超过103 万例,在所有恶性肿瘤中居第6位,其中新发死亡病例超过78 万例,在所有恶性肿瘤中居第2位[1]。 我国最新数据评估结果显示,2014 年胃癌新发病例在所有恶性肿瘤中居第2 位,死亡率居第3 位,仅次于肺癌和肝癌[2]。 胃癌治疗手段包括手术、放疗、化疗和靶向治疗[3]。 手术治疗是早期胃癌首选治疗方式,但由于早期症状不典型,绝大多数胃癌患者确诊时已处于局部晚期或远处转移。 此时,全身化疗成为胃癌患者最主要的治疗方式。 目前,铂类药物+氟尿嘧啶类药物联合应用是晚期胃癌一线治疗的首选方案,对于体力状态评分较高者可考虑应用铂类药物+氟尿嘧啶类药物+蒽环类/紫杉类药物的三联用药方案。 晚期胃癌患者单纯化疗预后极差,5 年生存率<10%,中位总生存时间<12 个月[4]。 近年来,以抗血管生成为靶点的药物(如阿帕替尼)已成为晚期胃癌三线治疗的重要手段之一,并取得了一定疗效。本研究拟探讨阿帕替尼联合5-氟尿嘧啶(5-fluorouracil,5-FU)对于人胃癌细胞AGS 增殖、调亡及迁移的影响,以期在临床上为体力状态较好的胃癌患者应用上述两药联合治疗提供理论支持。
1 材料与方法
1.1 材料
1.1.1 细胞株:人胃癌细胞系AGS、MKN-45 及SGC-7901 由消化系统疾病国家临床医学研究中心北京友谊医院消化内科实验室提供;人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVEC)购自美国ScienCell 公司,培养传代于含10%胎牛血清及1%青链霉素混合液的DMEM 培养基,置于5% CO2的37°培养箱,取对数期细胞进行实验。
1.1.2 药品与试剂:5-FU 注射液(0.25 g/10 ml,上海旭东海普公司),使用前以培养液稀释为25、50 和100 μg/ml 的质量浓度;阿帕替尼(0.425 g,江苏恒瑞公司),用二甲基亚砜(dimethyl sulfoxide,DMSO)溶解,避光保存,使用前以培养液稀释为15、30 和60 μg/ml 的质量浓度;DMEM 培养基(美国康宁公司);胎牛血清(BI 公司);胰蛋白酶、青链霉素混合液、Annexin V-FITC/PI 细胞凋亡试剂盒(南京凯基生物公司);MTS试剂(美国Promega 公司);抗血管内皮生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR2)抗体(美国Abcam公司);抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GADPH)抗体、羊抗兔二抗(美国SAB 公司);蛋白酶抑制剂(美国AMRESCO 公司);BCA 蛋白定量试剂盒(北京CWBIO 公司);RIPA 裂解液(北京普利莱基因公司)。
1.2 MTS 法检测细胞活力
取对数生长期的人胃癌细胞AGS 接种于96 孔板,每孔细胞悬液+培养基100 μl(1×104个细胞/孔),24 h 待细胞完全贴壁后,空白对照组添加同样体积DMSO(药物溶剂),换液后继续加用DMEM 完全培养基;5-FU 单药组分别以25、50 和100 μg/ml 质量浓度的5-FU 干预;阿帕替尼单药组分别以15、30 和60 μg/ml 质量浓度的阿帕替尼干预;每组3 个负孔。 培养24 或48 h 后,每孔加入MTS 试剂20 μl,置于5% CO2的37°培养箱中孵育1 h,用酶标仪检测490 nm 的光密度(optical density,OD)。 各组结果两两对比,所有实验均重复3 次。 5-FU选取100 μg/ml、阿帕替尼选取30 μg/ml 作为2 药联合应用的浓度。 由公式计算抑制率,抑制率(%)=(对照组OD 490 nm-实验组OD 490 nm)/对照组OD 490 nm×100%。
1.3 Annexin V-FITC/PI 双染法流式细胞学检测细胞凋亡
取对数生长期的人胃癌细胞AGS 接种于6 孔板中,培养24 h 贴壁后,空白对照组处理方法同MTS 法;实验组分别加入5-FU 100 μg/ml、阿帕替尼30 μg/ml 及5-FU 100μg/ml+阿帕替尼30 μg/ml 联 合。 培 养24 h 后, 将 悬 浮 细 胞 离 心(2 000 转/min,离心5 min)收集;贴壁细胞用不含EDTA 的胰酶消化收集,用冰PBS 洗涤2 次离心后(2 000 转/min,离心5 min)收集细胞;加入500 μl 的Binding Buffer 悬浮细胞;加入5 μl 的Annexin V-FITC 混匀后,加入5 μl 的碘化丙啶(PI),混匀;室温(15~25 ℃)下避光,反应5~15 min;在30 min 内用流式细胞仪检测。
1.4 划痕试验测定细胞迁移能力
取对数生长期的人胃癌细胞AGS 接种于6 孔板中,孔中加入约5×105个细胞,过夜铺满后以不含血清的不完全培养基处理12 h,后用无菌枪头比着直尺,在板底垂直向画十字,用PBS 清洗2 次去除划下的细胞,细胞的药物处理同“1.3”项下方法,以无血清培养基稀释药物。 置于5% CO2的37°培养箱内培养,分别于0 和24 h 显微镜下取样,拍照,记录细胞迁移情况。 细胞迁移速率=(0 h 边缘距离-24 h 后边缘距离)/24 h。 实验重复3 次。
1.5 Western Blot 法检测蛋白表达
取对数生长期的AGS 及HUVEC 接种于培养皿内,待细胞贴壁生长24 h 后,用RIPA 裂解液+PMSF+PhosSTOP 磷酸酶抑制剂提取总蛋白,进行BCA 蛋白定量。 经SDS-PAGE 凝胶电泳、PVDF 膜转膜、BSA 封闭、一抗4°孵育过夜、TBST 清洗、二抗孵育、TBST 洗膜和PhototopeTM-HRP 化学发光试剂封闭后,在暗室压片后以自动X-光胶片机曝光,观察记录结果。
1.6 统计学方法
不同组间差异通过方差分析方法进行检查,采用SPSS 17.0 及GraphPad Prism 5.0 统计学软件处理。P<0.05 为差异有统计学意义。
2 结果
2.1 人胃癌细胞AGS 系中VEGFR2 蛋白表达情况
Western Blot 法检测结果显示,GADPH 作为内参,阳性对照HUVEC 细胞内可见VEGFR2 蛋白表达,人胃癌细胞系AGS中可见VEGFR2 蛋白表达,而人胃癌细胞系MKN-45 及SGC-7901 并无VEGFR2 蛋白表达;后续实验选取表达VEGFR2 的人胃癌细胞AGS 进行,见图1。
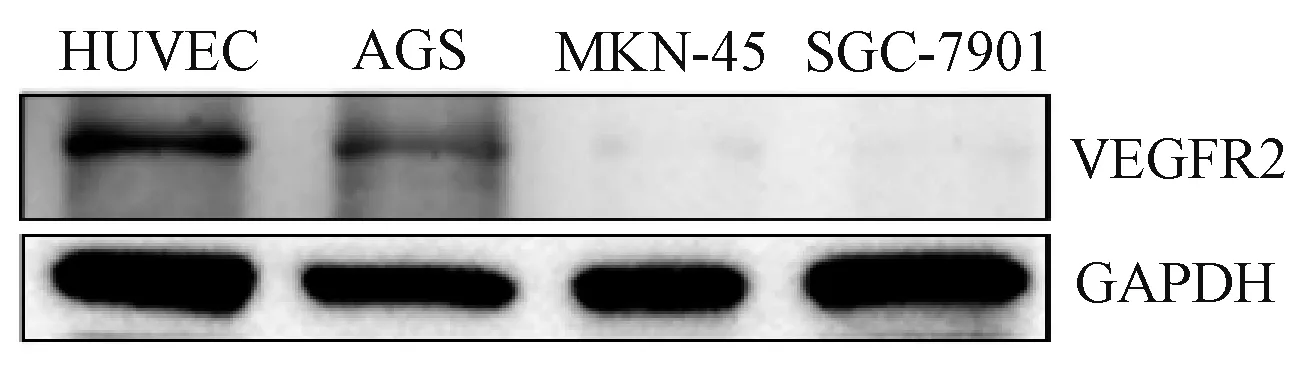
图1 Western Blot 法检测HUVEC、AGS、MKN-45 和SGC-7901 中VEGFR2 的表达Fig 1 Expression of VEGFR2 in HUVEC, AGS, MKN-45 and SGC-7901 detected by Western Blot
2.2 MTS 法测定5-FU、阿帕替尼和联合用药对人胃癌细胞AGS 增殖的影响
人胃癌细胞AGS 经不同浓度5-FU 及阿帕替尼处理24 及48 h 后,25、50 和100 μg/ml 的5-FU 单药以及15、30 和60 μg/ml的阿帕替尼单药均可抑制人胃癌细胞AGS 增殖,并具有时间依赖性和剂量依赖性,见图2(A、B)。 5-FU 质量浓度为100 μg/ml时对人胃癌细胞AGS 增殖的抑制程度,与空白对照组的差异有统计学意义(P<0.05);阿帕替尼质量浓度为30 μg/ml 时对人胃癌细胞AGS 增殖的抑制程度,与空白对照组的差异有统计学意义(P<0.05);阿帕替尼30 μg/ml 与5-FU 100 μg/ml 联合应用时,对人胃癌细胞AGS 增殖的抑制作用明显增强,与各单药组比较,差异均有统计学意义(P<0.05);结果提示,5-FU与阿帕替尼联合应用可增强对人胃癌细胞AGS 生长的抑制作用,且具有协同效应,图2(A、B)。 光学显微镜观察对照组、阿帕替尼30 μg/ml、5-FU 100 μg/ml 以及阿帕替尼30 μg/ml 与5-FU 100 μg/ml 联合处理24、48 h 后细胞形态变化,结果显示,空白对照组细胞生长状态良好,结构紧凑,形态正常;阿帕替尼单药组、5-FU 单药组细胞生长稀疏,部分细胞死亡,48 h后上述2 组细胞生长严重稀疏,大部分细胞死亡,以5-FU 组更甚;阿帕替尼与5-FU 联合组细胞状态差,生长更稀疏,死亡细胞明显增多,形态变圆或各异,图2(C、D)。
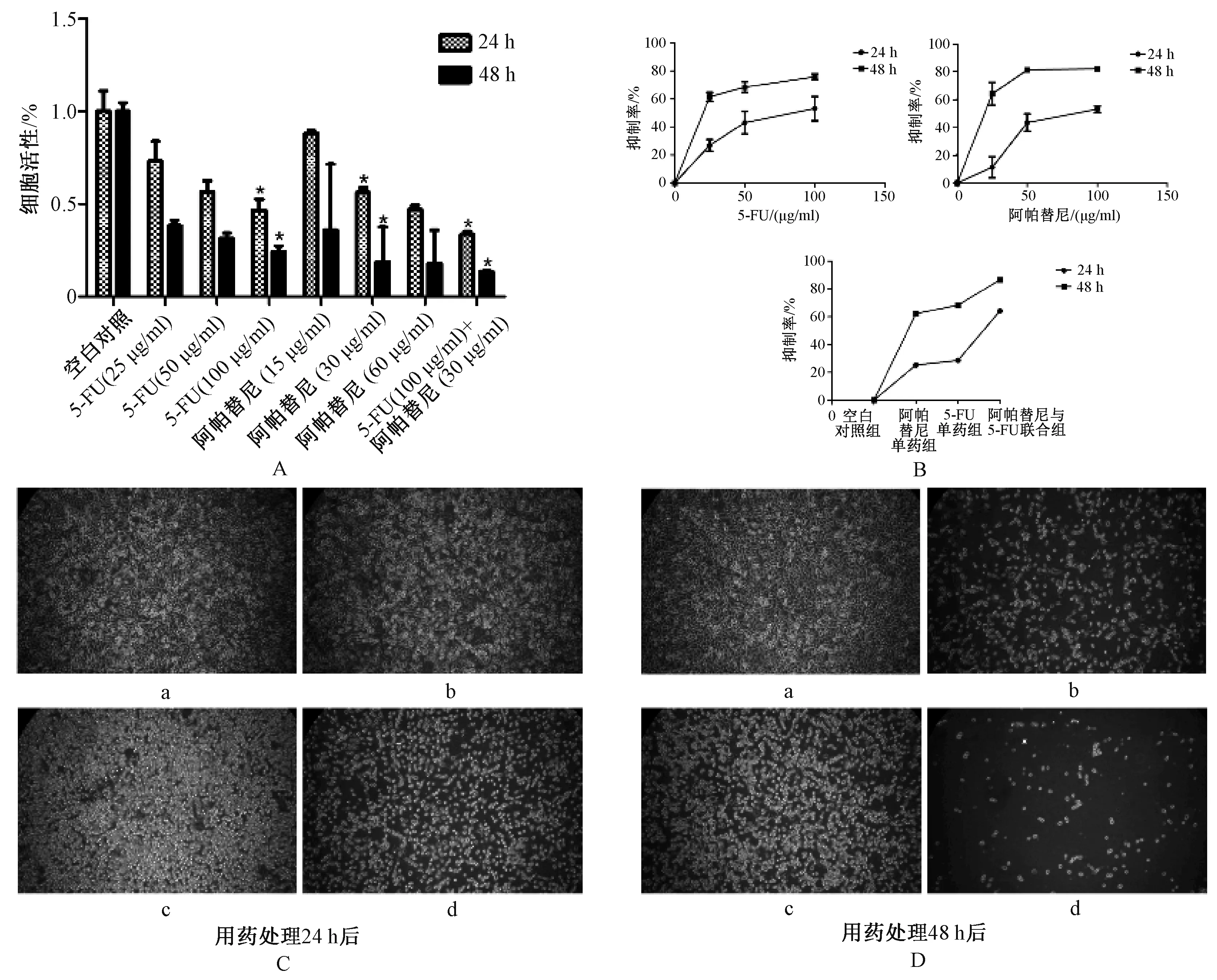
图2 MTS 法测定四组人胃癌细胞AGS 的增殖情况Fig 2 Proliferation of AGS cells of the four groups detected by MTS
2.3 Annexin V-FITC/PI 流式双染法检测人胃癌细胞AGS的凋亡
Annexin V-FITC/PI 流式双染法检测结果显示,与对照组比较,阿帕替尼30 μg/ml 单药组、5-FU 100 μg/ml 单药组处理人胃癌细胞AGS 24 h 后,人胃癌细胞AGS 总凋亡比例升高(14.1% vs.17.5%;14.1% vs.24.5%)[见图3(A、B)],以晚期凋亡(Q2)细胞为主(5.9% vs.11.7%;5.9% vs.16.9%)[见图3(C)],差异有统计学意义(P<0.001);阿帕替尼与5-FU 联合组人胃癌细胞AGS 总凋亡比例(45.8%)较单药组明显升高,仍以晚期凋亡细胞为主(37.3%),差异有统计学意义(P<0.001),见图3。
2.4 划痕试验测定四组人胃癌细胞AGS 迁移能力的变化
与对照组比较,作用24 h 后阿帕替尼30 μg/ml 单药组、5-FU 100 μg/ml 单药组人胃癌细胞AGS 的划痕愈合速度减慢,空白对照组为0.211 0 mm/h,5-FU 单药组为0.173 0 mm/h,阿帕替尼单药组为0.096 0 mm/h,见图4(A);阿帕替尼30 μg/ml与5-FU 100 μg/ml 联合组人胃癌细胞AGS 的划痕愈合速度进一步减慢,为0.020 7 mm/h;结果提示,与空白对照和阿帕替尼、5-FU 单药相比,5-FU 联合阿帕替尼对人胃癌细胞AGS 的迁移有明显抑制作用,差异有统计学意义(P<0.001),见图4(B)。
3 讨论
肿瘤血管生成与肿瘤发生、发展和转移密切相关[5-7]。 其中,血管内皮生长因子(vascular endothelial growth factor A,VEGF-A)及VEGFR2 与肿瘤血管新生最相关,后者约在36%~40%的胃癌组织中过表达[8]。 血管内皮生长因子受体1 或VEGFR2 起初被认为仅在血管内皮细胞表达,随后越来越多的研究结果证实,VEGFR2 不仅在血管内皮细胞表达,其在肿瘤细胞包括肝癌、胰腺癌、乳腺癌和肺癌细胞也有表达[9]。 Zhang等[10]研究结果显示,包括AGS 在内的多种人胃癌细胞系中可均见VEGFR2/KDR 基因扩增;胃癌组织免疫组化结果提示,除血管内皮细胞表达KDR 外,约70%的胃癌组织标本均可见KDR 表达阳性,且KDR 受体是有功能的。 本研究中,Western Blot 检测结果显示,以人脐静脉血管内皮细胞为阳性对照,人胃癌细胞AGS 可见VEGFR2 表达,而MKN-45 及SGC7901 未见VEGFR2 表达。
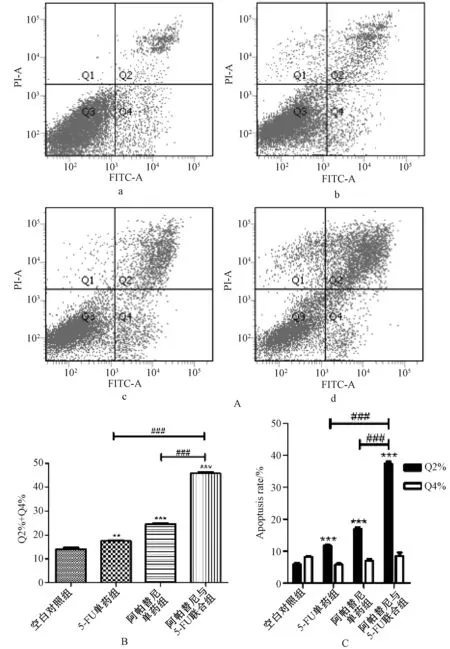
图3 Annexin V-FITC/PI 流式双染法检测四组人胃癌细胞AGS 的凋亡情况Fig 3 AGS cell apoptosis in the four groups detected by Annexin V-FITC/PI staining flow cytometry
在胃癌抗血管生成治疗中,靶向VEGF 单克隆抗体贝伐单抗联合化疗与单纯化疗相比并无生存获益[11]。 Ⅲ期RAINBOW 试验结果证实,晚期胃癌患者一线铂类药物+氟尿嘧啶类药物治疗失败后,二线应用抗VEGFR2 单克隆抗体雷莫卢单抗+紫杉醇可延长总生存期(overall survival,OS)2.2 个月[12]。 目前,雷莫卢单抗被美国食品药品监督管理局批准用于一线铂类药物+氟尿嘧啶类药物化疗失败后的晚期胃癌或胃食管结合部肿瘤患者的二线治疗。 多种化疗药(包括5-FU)用于胃癌标准一线或二线治疗,但化疗效果并不乐观,且二线治疗失败后缺乏标准治疗方案,而相当一部分患者二线治疗失败后体力状况尚良好,能耐受进一步治疗,仍需安全且有效的治疗手段延长患者的生存时间。 Li 等[13]的研究结果显示,与安慰剂相比,靶向VEGFR2 的小分子酪氨酸激酶抑制剂阿帕替尼作为三线治疗策略可以延长晚期胃癌患者无进展生存时间(progression-free survival,PFS)及OS,差异虽有统计学意义(P<0.05),但PFS 仅延长25 d,OS 仅延长55 d。 5-FU 是胃癌经典的标准治疗药物之一,为嘧啶类抗代谢药,主要通过阻止脱氧尿嘧啶核苷酸转变成胸腺嘧啶核苷酸,干扰DNA 的合成,导致细胞损伤和死亡。 目前,临床中已有关于阿帕替尼联合化疗药如替吉奥、多西他赛作为一线或二线方案治疗晚期胃癌的尝试[14-15]。 为探究阿帕替尼联合化疗药用于二线治疗失败后体力状况尚可的患者能否同雷莫卢单抗联合化疗药一样进一步改善晚期胃癌患者的生存结局,本研究进行了阿帕替尼联合5-FU 对人胃癌细胞AGS 增殖、凋亡及迁移影响的体外实验,进一步为阿帕替尼联合化疗药的应用临床提供理论基础。
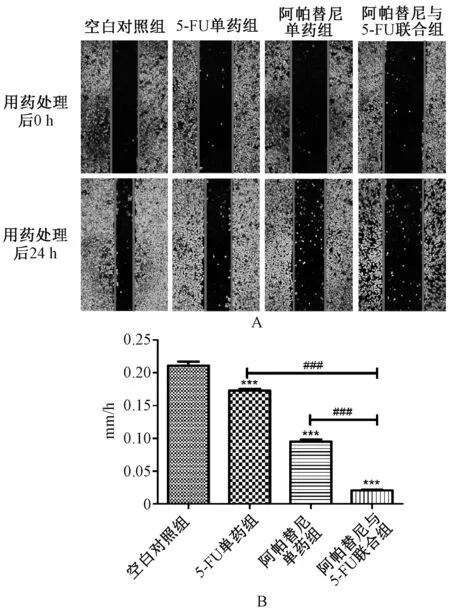
图4 划痕试验测定四组人胃癌细胞AGS 迁移能力变化情况Fig 4 Changes of AGS cells migration in the four groups detected by scratch test
本研究结果显示,与不同浓度的阿帕替尼单药、5-FU 单药相比,阿帕替尼30 μg/ml 与5-FU 100μg/ml 联合作用24 或48 h 后,可显著抑制人胃癌细胞AGS 增殖。 凋亡受阻是肿瘤发生、发展的重要机制之一,许多化疗药、活性成分和靶向药物均能够促进细胞凋亡从而抑制肿瘤生长[16]。 本实验中,Annexin V-FITC/PI 双染结果显示,经阿帕替尼30 μg/ml 与5-FU 100 μg/ml联合用药组人胃癌细胞AGS 的凋亡率较对照组明显升高,以晚期调亡细胞为主,且联合用药组人胃癌细胞AGS 的迁移能力明显降低。 梁树等[17]在研究阿帕替尼对白血病HL-60 细胞株抑制增殖作用及机制中发现,阿帕替尼可通过下调P-Erk1/2 及P-Akt 蛋白表达诱导HL-60 细胞凋亡,抑制其增殖。 Liu 等[18]的研究结果显示,体内及体外实验结果证实阿帕替尼可通过VEGFR2/STAT3/BCL-2 信号通路促进骨肉瘤细胞调亡和自噬。 Huang 等[19]的研究结果显示,阿帕替尼可通过阻断VEGFR2/RAF/MEK/ERK 和PI3K/AKT 通路,影响由VEGF 介导的胆管癌细胞增殖、迁移和侵袭。 本研究初步报道了阿帕替尼联合5-FU 对人胃癌细胞AGS 生物学表型的影响,但不足的是,本研究仅从单一细胞系进行实验,且尚未对相关机制进行探讨。 后续将对相关结果在其他细胞系中进行验证,并重点分析阿帕替尼联合5-FU 对细胞增殖、调亡及迁移影响的分子机制。
综上所述,在体外实验中,阿帕替尼联合5-FU 可显著抑制人胃癌细胞AGS 增殖、迁移,并可诱导其调亡。 本研究可为临床上二线治疗后疾病进展但体力状态评分尚好的晚期胃癌患者联合应用阿帕替尼与5-FU 提供一定的实验基础。
