非洲绿猴IFITM3基因的克隆及其组织特异性表达差异
2020-05-26邢焕微张素花白杰英
邢焕微,叶 莉,李 昌,张素花,白杰英
(1.河北工业大学理学院,天津 300401;2.北京大学分子医学研究所非人灵长类动物研究中心,北京 100871;3.军事医学研究院微生物流行病研究所,北京 100071;4.军事医学研究院军事兽医研究所,长春 130122)
干扰素诱导的跨膜蛋白(interferon inducible transmembrane proteins,IFITMs)是I型干扰素与配体结合诱导干扰素刺激基因(IFN-stimulated genes,ISGs)表达的一系列活性蛋白,IFITMs会针对不同病原体ISGs进行防御[1-2]。在人、山羊、牛、猪、小鼠等哺乳动物基因组中均发现有IFITMs基因家族成员存在,爬行类和鱼类中也发现有IFITMs基因的表达。目前已发现的IFITMs基因包括IFITM1、IFITM2、IFITM3、IFITM5、IFITM7和IFITM10等,其中人的IFITMs基因位于第11号染色体短臂对着端粒区26 kb处,小鼠的IFITMs基因位于7号染色体[3],鸡IFITMs基因集中在5号染色体,猪IFITMs基因存在于2号染色体。除IFITM10具有高保守性外,各物种间IFITMs基因在进化上保留了种属间序列差异性,但同一物种IFITMs基因簇均在同一染色体中;IFITMs蛋白大约含100~150个氨基酸。
非人灵长类动物IFITMs相关的研究,主要围绕SIV或者HIV的感染控制开展。当从非人灵长类动物细胞系中克隆到IFITMs基因时发现这些基因表达的蛋白与人类IFITMs具有相似的功能,能对HIV等一系列逆转录病毒产在抑制作用[4];非人灵长类动物IFITMs对SIV/HIV-1 viruses(SHIVs)具有抑制作用,而且,这种抑制作用具有膜蛋白识别特异性[5]。非人灵长类动物IFITMs的研究主要集中在其抗病毒作用方面,对非人灵长类动物IFITMs基因本身的遗传进化特点、表达特性、亚细胞定位等研究较少。而且,在诸多的IFITMs家族成员中,IFITM1、IFITM2和IFITM3被证明直接与机体免疫反映相关,其中IFITM3因其广泛的病毒抑制作用而得到了更加深入的研究[6]。因此,本研究选择IFITM3为代表,探讨非洲绿猴IFITM3基因的表达与功能。
非洲绿猴是一种重要的非人灵长类模型动物,在模拟人类疾病的发生过程中,具有与人类组织器官病变和遗传发育进程相似的特点,因此受到生物医学研究的广泛青睐[7],如应用非洲绿猴开展营养代谢方面的研究[8];应用非洲绿猴模型研究Nipah virus(NiV)感染,确定NiV气溶胶感染的最适微粒大小等[9]。非洲绿猴因其健全的免疫系统和病毒适应性,而被广泛用于人兽共患感染性疾病的研究[10],除艾滋病研究外,在神经生物学、心脑血管疾病、病毒感染等医学领域可作为稳定的评价模型[11]。但对于非洲绿猴强悍的免疫适应机制尚不明确,IFITMs是否也参与其中并起到重要作用尚不得而知。因此,本研究从非洲绿猴IFITMs基因的遗传多样性出发,探究其亚细胞定位,分析其与非洲绿猴抗感染免疫的关系,为揭示IFITMs蛋白家庭的抗病毒作用机制提供参考。
1 材料和方法
1.1 实验动物
本研究使用非洲绿猴组织器官样本获赠于军事医学研究院实验动物中心。所取样本来自3只非洲绿猴(1只雌性,2只雄性)。级别:普通级,体重∶约5 kg,年龄∶4岁。实验动物生产许可证编号[SCXK(军)2017-0014];实验动物使用许可证编号[SYXK(军)2017-0022]。实验程序经军事医学研究院实验动物中心“实验动物管理与使用委员会(IACUC)”和“实验动物福利伦理委员”审批,审批编号IACUC-2017-0018。实验过程中严格按照福利伦理要求,符合实验动物3R原则。
1.2 主要试剂与仪器
RNApure Tissue&Cell Kit(CW0584S)、Universal Genomic DNA Kit(CW2298S)购自中国江苏康为世纪生物科技有限公司;PrimeScriptTMRT reagent Kit(RR037 A)、TaKaRa Ex Taq®(RR001 A)、TB Green®Premix Ex TaqTMII(RR820 A)购自日本宝日医学生物技术(北京)有限公司;DNA marker(MD102-02)、质粒提取试剂盒(DP118-02)、DNA凝胶回收试剂盒(DP209-03)均购自中国天根生化科技(北京)有限公司;Trans10化学感受态细胞(CD101-01)购自中国全式金生物技术有限公司;T4 DNA ligase(M1801)、pGEM-T Vector(A3600)购自美国Promega生物公司;兔源IFITM 3多克隆抗体(11714-1-AP)购自美国Proteintech Group公司。
PCR仪器选用BioRad T100TMThermal Cycler(美国BioRad公司);荧光定量PCR仪采用BioRad CFX96 TouchTMReal-Time PCR Detection System(美国BioRad公司);紫外分光仪选用Thermo Scientific NanoDropTMOne超微量紫外分光光度计(美国Thermo Fisher Scientific公司);显微镜选用Nikon ECLIPSE TS100(日本尼康株式会社)。
1.3 实验方法
1.3.1 引物设计
根据GenBank中的基因序列(XM_007986748.1,LOC103229029)设计IFITM3基因扩增引物(见表1),引物由北京天一辉远生物科技有限公司合成。
1.3.2 总RNA、DNA提取与cDNA合成
将冻存的AGM心、肝、脾、肺、左肾、右肾、皮肤、大脑、淋巴结等组织用液氮研磨成粉末后,按照Universal Genomic DNA Kit(CW2298S)说明书提取组 织DNA,并按照RNApure Tissue&Cell Kit(CW0584S)说明书提取组织总RNA,检测所提核酸的完整性和纯度。按照PrimeScriptTMRT reagent Kit(RR037 A)说明书将得到的总RNA分离出mRNA后,反转录合成cDNA,作为模板存于冰箱待用。
1.3.3 非洲绿猴IFITM3基因的克隆
用RT-PCR方法,从cDNA模板中克隆IFITM3基因。反应条件:98℃3 min;98℃10 s,65℃30 s,72℃1 min,共30个循环;最后72℃延伸5 min。得到的PCR产物通过1%琼脂糖凝胶电泳检测片段大小,按照DNA凝胶回收试剂盒(DP209-03)说明书纯化目的片段,连接至pGEM-T Vector克隆载体后,转入Trans10化学感受态细胞并涂布含氨苄抗性的固体LB培养基。经过氨苄抗性筛选,挑取单克隆菌株扩大培养。经PCR鉴定后提取质粒送至天一辉远生物科技有限公司测序。
1.3.4 Real-time PCR检测
将1.3.2中取得的各组织cDNA按照TB Green®Premix Ex TaqTMII(RR820 A)说明书和表1中引物配制反应体系,以人β-actin基因作内参引物,每个样本重复3次,在BioRad CFX96 TouchTMReal-Time PCR Detection System中进行两步法PCR反应。条件如下:95℃,变性30 s;95℃5 s,65℃退火30 s,共39个循环。反应设置熔解曲线以观测引物特异性扩增情况,以0.5℃梯度从65℃加热至95℃,每梯度1 s采集荧光数据制作曲线。将得到的Cq值以相对定量法计算,用Graphpad Prism 6软件分析AGMIFITM3在各组织器官中的差异表达情况。
1.3.5 免疫组织化学方法检测IFITM3蛋白的表达
取甲醛固定好的组织蜡块,使用切片机切下厚度5μm的切片,用40℃温水展片后置于防脱片载玻片并在烤片机中炙烤30 min。室温下依次使用二甲苯、90%~70%酒精、蒸馏水、PBS液对组织切片脱蜡水化,配制抗原修复液并煮沸浸泡切片,甩干水分用3%过氧化氢灭活组织内源酶。用山羊血清封闭液封闭非特异性位点,IFITM3多克隆抗体作为一抗,辣根过氧化物酶标记的抗体作为二抗分别与组织切片反应。清洗后滴加链霉菌抗生物素过氧化物酶溶液标记,使用DAB溶液和苏木素染色与复染,脱水处理后中性树胶封片并在显微镜下观察。

表1 非洲绿猴IFITM3基因扩增用引物Table 1 Primers for cloning and quantification of IFITM3 transcripts in AGM
1.4 统计学方法
用DNAMAN对所获基因序列进行生物信息学分析,建立各物种间IFITM3基因的系统发育树;使用TMHMM 2.0和CSS Palm 2.0软件对IFITM3的氨基酸和蛋白质结构进行分析;用Graphpad Prism 6对Real-time PCR结果进行比较;用ImagePro Plus 6.0软件对病理图片进行阳性细胞计数和信号采集。
2 结果
2.1 非洲绿猴IFITM3基因的克隆
琼脂糖电泳显示,所克隆的IFITM3基因与目标片段大小相符,见图1;IFITM3的开放阅读框(open reading frame,ORF)约为440 bp(图1B),而编码框(code sequence,CDS)大约740 bp(图1A)。
2.2 IFITM3基因序列分析
测序结果显示,AGM-IFITM3 CDS序列与NCBI数据库中的序列一致,见图2,大小为740 bp,包括两个长度分别约为170 bp和130 bp的非编码区以及一个441 bp的ORF。来源于AGM各组织器官的IFITM3 ORF序列比对显示,各组织器官ORF序列存在核苷酸序列差异,见图3。氨基酸序列分析显示,第397位的胸腺嘧啶会造成精氨酸缺失外,其余组织IFITM3氨基酸与目标氨基酸序列完全一致。
所获得AGMIFITM3基因序列在进化上与猕猴属关系最近,同源性达到了93%,与灵长目动物(智人、大猩猩、黑猩猩等)属于共同来源;而与鳄鱼、斑马鱼等爬行纲和辐鳍鱼纲动物基因进化关系较远,见图4。
2.3 IFITM3的氨基酸序列分析
翻译后的AGM IFITM3蛋白质含有146个氨基酸,与人、猪、牛、鼠来源的IFITM3序列一致,见图5。利用跨膜区结构预测软件TMHMM 2.0分析AGM IFITM3蛋白跨膜结构,发现AGM的IFITM3蛋白同样存在五个高度保守的特异性结构域和CD225保护区,结合图3可以看出AGM各组织IFITM3 ORF间的差异主要集中在NTD与CTD结构域上CSS Palm 2.0软件分析发现,AGM的IFITM3蛋白存在高度保守的泛素化、棕榈酰化位点和YxxФ特异性结构。
2.4 IFITM3的组织特异性表达
Real-time PCR结果显示,AGMIFITM3在脾、肾和皮肤中表达量较高,在脑中表达量最低,见图6。免疫组化染色后,使用电子显微镜拍摄所观察到的切片,脑、肺、肝等组织中IFITM3蛋白的阳性信号较弱,见图7;用Image Pro Plus 6.0软件对所有图片进行阳性细胞计数和信号采集,结果显示在脾淋巴细胞、肾小球和肾小管上皮细胞、腹股沟淋巴结细胞及皮脂腺细胞中阳性细胞数量较多,信号较强,见表2。
3 讨论
IFITMs是宿主细胞抵御病毒感染的第一道防线[12],而IFITM3因为具有广泛的抗病毒和免疫调节功能,近年来受到感染与免疫研究的广泛关注。灵长目类人猿的IFITMs是猴免疫缺陷病毒(Simian immunodeficiency virus,SIV)的有效抑制剂,它甚至比人源IFITMs对HIV-1的抑制性更强[4]。用双链非洲猪瘟病毒(African swine fever virus,ASFV)感染绿猴肾异倍体细胞可引起IFITMs的表达,以限制核周区内吞途径从而影响病毒进入,IFITMs过表达能影响ASFV的脱壳作用[13]。

注:A:IFITM3 CDS区克隆电泳结果;B:IFITM3 ORF区克隆电泳结果。M:DNA marker;1:心脏;2:肝;3:脾;4:肺;5:左肾;6:右肾;7:皮肤;8:脑;9:淋巴结。图1 不同组织器官IFITM3基因克隆电泳图Note.A,Electrophoregram of IFITM3 CDS.B,Electrophoregram of IFITM3 ORF.M,DNA marker;1,Heart;2,Liver;3,Spleen;4,Lung;5,Left kidney;6,Right kidney;7,Skin;8,Brain;9,Lymph gland.Figure 1 Agarose electrophoresis of IFITM3 gene

图2 AGM-IFITM3 CDS与目标序列比对图Figure 2 The alignment between AGM IFITM3 and target sequence

图3 AGM各组织IFITM3 ORF比对Figure 3 The alignment of IFITM3 ORF in different organizations
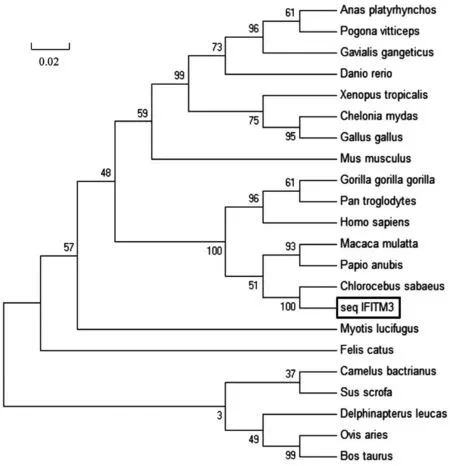
注:Seq IFITM3为样本序列。图4 AGM IFITM3系统发育分析Note.Seq IFITM3 is the sample sequence.Figure 4 The alignment of IFITM3 ORF in different organizations
本研究克隆了非洲绿猴的IFITM3基因,发现其基因和蛋白序列与灵长目动物和哺乳动物具有高度相似性和同源性(图2,3,4),证明非洲绿猴IFITMs也会在机体的免疫保护过程中发挥作用。非洲绿猴的IFITM3同样存在五个高度保守的特异性结构域和CD225保护区。IFITMs家族的CD225结构域是成员共享的一个高保守保护性区域,存在于内膜TM1和胞CIL区,该结构域对于发挥IFITMs的功能十分重要[14]。CSS Palm 2.0软件分析发现,AGM的IFITM3蛋白存在高度保守的泛素化、棕榈酰化位点和YxxФ特异性结构(图5)。这些特异性位点对于IFITM3的靶向输送具有至关重要的作用。研究表明,IFITMs主要表达于细胞膜表面、溶酶体、内质网、胞内囊泡等,其亚细胞定位与IFITMs的功能、类型及细胞种类相关[2,6]。在本研究中,IFITM3在非洲绿猴的心脏、肝、脾、肺、肾、皮肤、脑、淋巴结中均有表达,且其RNA在脾、肾和皮肤显示出高丰度(图6),免疫组化结果与Real-time PCR相似,在脾淋巴细胞、肾小球和肾小管上皮细胞、腹股沟淋巴结细胞等组织器官中检测到较强的IFITM3蛋白信号(图7,表2),该结果与张玉娟等[15]所研究的IFITMs在猪组织器官中的表达和亚细胞定位相似。IFITMs是一种内源基因,因此,如荧光实时定量PCR结果所示,其基因和转录后产物RNA广泛存在于非洲绿猴的各个组织器官中,但脾、肾和皮肤中的RNA丰度最高。通过转录后翻译和转运,IFITM3蛋白质则主要集中到非洲绿猴的免疫器官中,如脾、淋巴细胞、肾等(图7),这些组织器官在病原体入侵时发挥免疫功能,启动机会的免疫响应。本研究的结果显示,存在于免疫器官的IFITM3蛋白含量明显高于其他脏器,侧面说明IFITM3作为机体重要的免疫防御武器的原因所在。
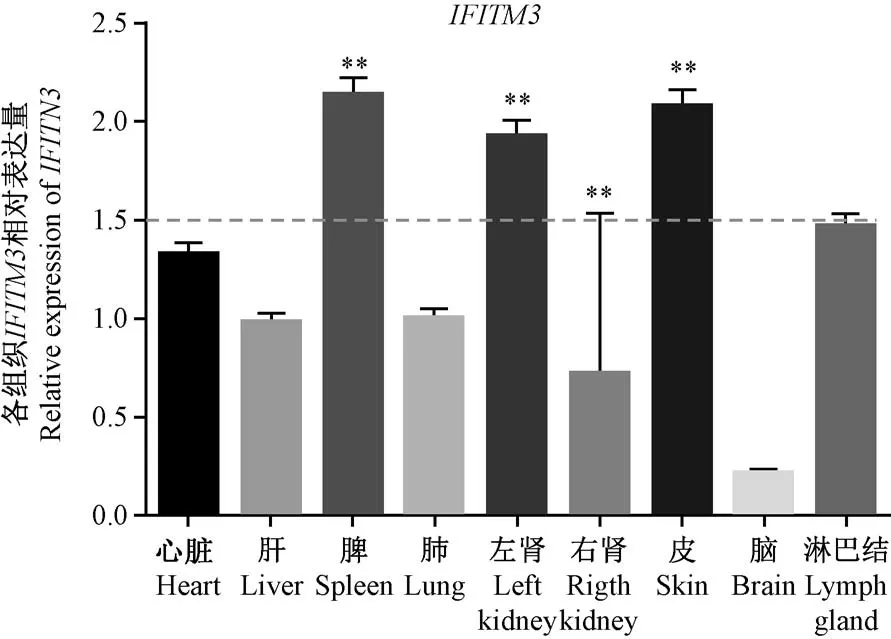
注:以心脏组织的PCR结果为对照组计算,**P<0.01。图6 各组织中IFITM3 Real-time PCR检测结果Note.The PCR results of heart were used as the control group for calculation.**P<0.01.Figure 6 AGM IFITM3 expression in different tissues by Real-time PCR

图7 各组织染色后病理切片Figure 7 The image of Immunohistochemical section

表2 非洲绿猴各组织器官的IFITM3表达情况Table 2 Expression of IFITM3 in various tissues
