鸢尾黄素对大鼠糖尿病肾病的治疗作用
2020-05-25李惠刘建林牛聪张威王慧超
李惠, 刘建林, 牛聪, 张威, 王慧超
(河南大学第一附属医院肾内科,河南开封 475000)
糖尿病肾病(diabetic nephropathy,DN)是终末期肾衰竭的主要原因[1],占全世界需要透析治疗的所有病例的35% ~40%。据世界卫生组织估计,全球有4.15 亿成年人患有糖尿病,到2040 年将增加到6.42 亿[2]。糖尿病发病率的上升使DN 成为当前最重要的公共卫生问题之一[3],迫切需要开发新的疗法来改善DN 治疗。目前,许多植物药被用作DN 的补充疗法。中药鸢尾科植物射干及鸢尾具有清热解毒、利咽消痰、散血消肿的功效[4],我国资源丰富。研究发现,射干和鸢尾的活性成分鸢尾黄素是一种天然异黄酮,结构图如图1所示。已有研究表明,鸢尾黄素具有抗增殖,抗炎,抗氧化[5-7],抑制醛糖还原酶、皮质胰岛素抵抗[7-8],有降血糖、降血脂[9-10]等广泛药理学作用。基于此,本研究旨在探讨鸢尾黄素对大鼠DN 的治疗作用,现将研究结果报道如下。
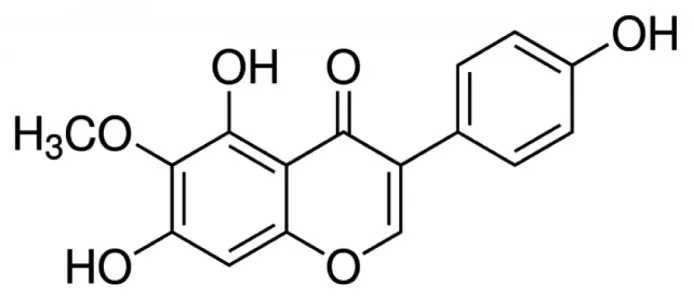
图1 鸢尾黄素结构式Figure 1 Chemical structure of tectorigenin
1 材料与方法
1.1 实验动物48只5周龄雄性SD大鼠,体质量(110±5)g,购自浙江中医药大学动物实验研究中心,许可证号:SYXK(浙)2018-0012。于河南大学医学院实验动物中心饲养,温控(22±1)℃,光控(200 lux,12 h 光暗循环),许可证号:SYXK(豫)2016-0006。
1. 2 主要药物与试剂鸢尾黄素(化学式:C16H12O6;分子量:300.26;批号:67356),美国Sigma-Aldrich 公司生产。盐酸二甲双胍,购自中国食品药品检定研究院,批号:100664-201805。链脲佐菌素,购自美国Sigma-Aldrich 公司;苏木素—伊红染液,尿蛋白(UP)、血清肌酐(SCr)、尿素氮(BUN)、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、还原型谷胱甘肽(GSH)、丙二醛(MDA)等测定试剂盒,购自南京建成生物工程研究所;肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)、白细胞介素1β(IL-1β)等酶联免疫吸附分析(ELISA)试剂盒,cleaved caspase-3 抗体,核转录因子κB p65(NF-κB p65)抗体,磷酸化NF-κB p65(P-NF-κB p65)抗 体、GAPDH 抗 体 购 自 美 国Abcam公司。
1.3 主要仪器2404948 血糖仪(罗氏血糖健康医护公司);AU5800 全自动生化分析仪(美国贝克曼库尔特有限公司);318C+酶标仪(中国上海沛欧分析仪器有限公司);723S 分光光度计(中国上海棱光技术有限公司);DS360 全自动糖化血红蛋白检测分析仪(美国Drew Scientific公司)。
1.4 分组、动物模型建立与给药将48只大鼠常规饲养7 d 后随机分为4 组,即正常组、模型组、二甲双胍组、鸢尾黄素组,每组12 只。造模[11]与给药方法:除正常组,其他3组大鼠给予高糖高脂饲料(质量分数配方为20%蔗糖、12%猪油、5%奶粉、2%鸡蛋和61%正常饲料)喂养3周后,一次性腹腔注射35 mg/kg 链脲佐菌素,构建DN 大鼠模型。造模期间,正常组大鼠正常饮食。模型建立1周后,检测大鼠血糖值,若血糖大于300 mg/dL即可判断造模成功[12]。判断造模成功后,开始给药。二甲双胍组大鼠给予腹腔注射二甲双胍(剂量为10 mg·kg-1·d-1),鸢尾黄素组大鼠给予腹腔注射鸢尾黄素(剂量为300 mg·kg-1·d-1),正常组大鼠给予腹腔注射生理盐水。共8周。给药期间,正常组大鼠继续正常饮食,其他组别大鼠继续给予高糖高脂饲料。
1.5 观察指标与方法
1.5.1 肾质量/体质量指数 给药结束后,称量大鼠质量。处死大鼠,采集肾脏组织进行称量。计算肾质量/体质量指数。
1.5.2 血糖、糖化血红蛋白 采用血糖仪检测大鼠血糖值,全自动糖化血红蛋白检测分析仪检测大鼠糖化血红蛋白含量。
1. 5. 3 肾功能指标 按照试剂盒说明书操作步骤,采用可见分光光度计测定大鼠24hUP、SCr、BUN 水平。在595 nm 波长处测定24hUP吸光度值,在546 nm 波长处测SCr 吸光度值,在640 nm 波长处测定BUN吸光度值。
1. 5. 4 血脂指标 按照试剂盒说明书操作步骤,采用可见分光光度计测定大鼠血脂指标TC、TG、LDL-C、HDL-C 水平。在546 nm 波长处测定LDL-C、HDL-C 吸光度值,在510 nm 波长处测定TC、TG吸光度值。
1.5.5 氧化应激指标 按照试剂盒说明书步骤操作。采用酶标仪测定SOD 活性,在450 nm 波长处测定SOD 吸光度值;采用可见分光光度计测定CAT、GSH 活性及MDA 含量,在405 nm 波长处测CAT吸光度值,在420 nm波长处测GSH吸光度值,在532 nm波长处测MDA吸光度值。
1. 5. 6 血清TNF-α、IL-6、IL-1β 水平 采用ELISA 法。在4 ℃下用50 mmol/L 的碳酸盐包被缓冲液溶解抗原,100 μL/孔(96 孔酶标板)。将抗原包被过夜,弃去包被液,用磷酸盐—Tween-20 磷酸盐缓冲液(PBST)洗涤3 次,每次5 min。每孔加150 μL 体积分数1%胎牛血清白蛋白(BSA)封闭1 h,PBST 洗涤3 次,加入100 μL 不同倍比稀释度的血清,并加入对照样品,37 ℃孵育2 h,PBST洗涤5 次。加入100 μL 稀释后的HRP 标记的二抗,37 ℃孵育1 h,PBST洗涤5次后以显色剂显色20 min,用酶标仪在450 nm波长处测吸光度值。
1. 5. 7 肾组织病理变化 采用HE 染色法。将新鲜肾组织用体积分数10%福尔马林固定,进行石蜡包埋,切片脱蜡,蒸馏水润湿组织,苏木素核染色5 min,水洗5 s,伊红浆染色30 s,水洗后,滤纸吸干,无水乙醇脱水2次后封片。在荧光显微镜下观察肾组织病理表现。
1. 5. 8 肾组织cleaved caspase-3 蛋白表达 采用免疫组织化学法。将肾组织切片先脱蜡处理后用PBST 冲洗2 次,40 g/L 多聚甲醛固定30 min,体积分数3%过氧化氢阻断内源性过氢化物酶活性,用体积分数10%正常山羊血清在TBS 中孵育30 min。然后用抗cleaved caspase-3 抗体孵育过夜。次日用PBS 冲洗3 次,每次5 min,加入辣根过氧化物酶(HRP)二抗孵育30 min,室温下用DBS显色。荧光显微镜下观察。
1. 5. 9 肾组织P-NF-κB p65、NF-κB p65 蛋白表达 采用Western Blot 法。取大鼠肾组织加入含蛋白酶抑制剂的细胞裂解液,以12 000 r/min 离心10 min,进行总蛋白提取,用二喹啉甲酸(BCA)试剂盒测定蛋白质含量。提取等量的蛋白质样品20 mg,在100 ℃条件下变性5 min。然后进行十二烷基硫酸钠(SDS)—聚丙烯酰胺凝胶电泳(PAGE)分离蛋白并转移至聚偏氟乙烯(PVDF)膜,分别加入P-NF-κB p65、NF-κB p65 抗体(1 000 倍稀释)4 ℃孵育过夜,清洗,然后加入辣根过氧化物酶标记的二抗,孵育2 h,最后加入电化学发光(ECL)液,曝光处理。应用Image J 软件测量蛋白条带灰度值。
1.6 统计方法采用统计软件SPSS 18.0对数据进行分析。实验结果均以均数±标准差(±s)表示。先对实验数据进行正态分布分析和方差齐性分析,符合条件的选用单因素方差分析或t 检验,不符合条件的选用秩和检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠肾质量/体质量指数、血糖值、糖化血红蛋白水平比较图2结果显示:模型组大鼠肾质量/体质量指数,血糖值、糖化血红蛋白水平显著高于正常组(P<0.01);二甲双胍组、鸢尾黄素组大鼠肾质量/体质量指数、血糖值、糖化血红蛋白水平显著低于模型组(P<0.01),且2 个治疗组肾质量/体质量指数、血糖值、糖化血红蛋白水平比较,差异均无统计学意义(P >0.05)。
2.2 各组大鼠BUN、SCr、24hUP 水平比较表1结果显示:模型组大鼠BUN、SCr、24hUP 水平显著高于正常组(P<0.01);二甲双胍组、鸢尾黄素组大鼠BUN、SCr、24hUP 水平显著低于模型组(P<0.01),且2 个治疗组BUN、SCr、24hUP 水平比较,差异均无统计学意义(P >0.05)。
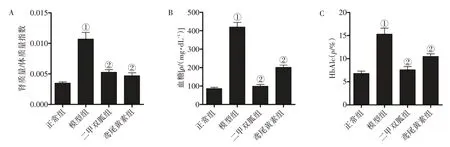
图2 各组大鼠肾质量/体质量指数、血糖值、糖化血红蛋白(HBA1C)水平比较(±s,N=12只)Figure 2 Comparison of renal mass/body mass index,blood glucose value,and glycosylated hemoglobin levels in various groups(±s,N=12)
表1 各组大鼠BUN、SCr、24hUP水平比较Table 1 Comparison of the levels of BUN,SCr,and 24hUP in various groups (±s)
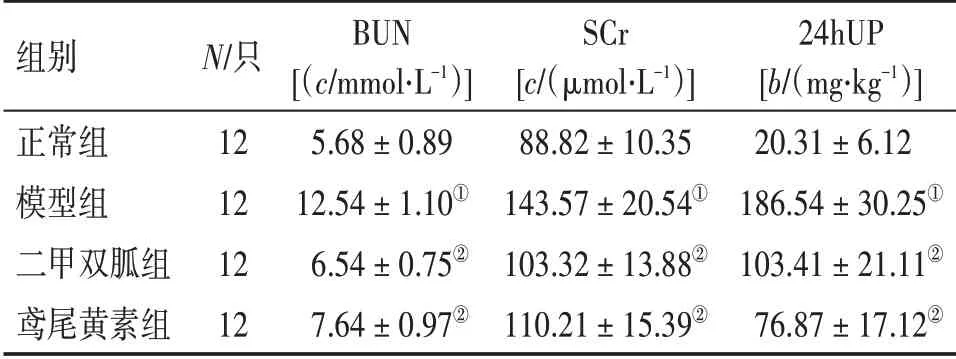
表1 各组大鼠BUN、SCr、24hUP水平比较Table 1 Comparison of the levels of BUN,SCr,and 24hUP in various groups (±s)
①P <0.01,与正常组比较;②P <0.01,与模型组比较
组别正常组模型组二甲双胍组鸢尾黄素组N/只12 12 12 12 BUN[(c/mmol⋅L-1)]5.68±0.89 12.54±1.10①6.54±0.75②7.64±0.97②SCr[c/(μmol⋅L-1)]88.82±10.35 143.57±20.54①103.32±13.88②110.21±15.39②24hUP[b/(mg⋅kg-1)]20.31±6.12 186.54±30.25①103.41±21.11②76.87±17.12②
2. 3 各组大鼠血清TC、TG、LDL-C、HDL-C 水平比较表2结果显示:与正常组比较,模型组大鼠血清TC、TG、LDL-C水平升高,HDL-C 水平降低(P<0.01);与模型组比较,二甲双胍组、鸢尾黄素组大鼠血清TC、TG、LDL-C 水平显著降低,HDL-C 水平显著升高(均P<0.01),且2 个治疗组大鼠血清TC、TG、LDL-C、HDL-C 水平比较,差异无统计学意义(P >0.05)。
表2 各组大鼠血清TC、TG、 LDL-C、HDL-C水平比较Table 2 Comparison of the levels of serum TC,TG,LDL-C and HDL-C in various groups[±s,c/(mmol·L-1)]
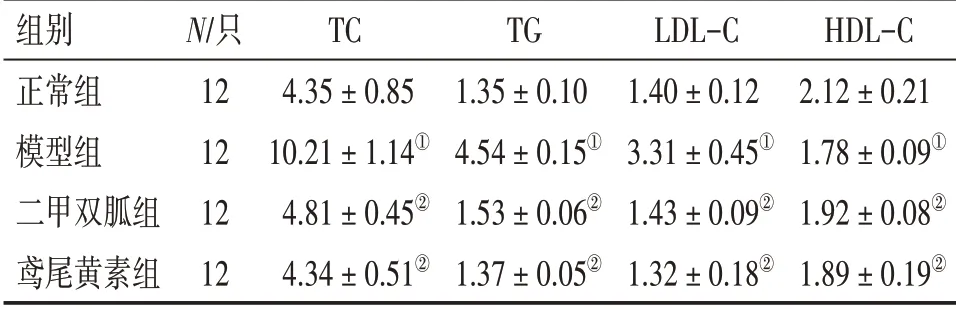
表2 各组大鼠血清TC、TG、 LDL-C、HDL-C水平比较Table 2 Comparison of the levels of serum TC,TG,LDL-C and HDL-C in various groups[±s,c/(mmol·L-1)]
①P <0.01,与正常组比较;②P <0.01,与模型组比较
组别正常组模型组二甲双胍组鸢尾黄素组N/只12 12 12 12 TC 4.35±0.85 10.21±1.14①4.81±0.45②4.34±0.51②TG 1.35±0.10 4.54±0.15①1.53±0.06②1.37±0.05②LDL-C 1.40±0.12 3.31±0.45①1.43±0.09②1.32±0.18②HDL-C 2.12±0.21 1.78±0.09①1.92±0.08②1.89±0.19②
2.4 各组大鼠SOD、CAT、GSH 活性及MDA 含量比较表3结果显示:与正常组比较,模型组大鼠血清SOD、CAT、GSH 活性显著降低,MDA 含量显著升高(均P<0.01);与模型组比较,二甲双胍组、鸢尾黄素组大鼠血清SOD、CAT、GSH 活性显著升高,MDA 含量显著降低(均P<0.01),且2 个治疗组SOD、CAT、GSH 活性及MDA 含量比较,差异均无统计学意义(P >0.05)。
表3 各组大鼠SOD、CAT、GSH活性及MDA含量比较Table 3 Comparison of the activity of SOD,CAT and GSH,and MDA content in various groups(±s)
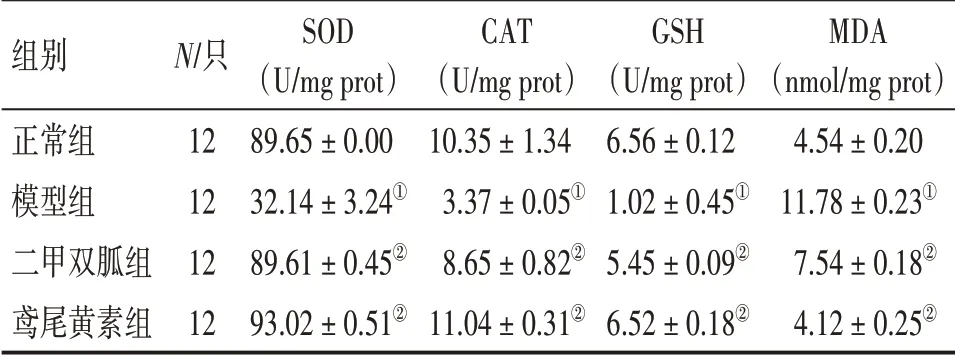
表3 各组大鼠SOD、CAT、GSH活性及MDA含量比较Table 3 Comparison of the activity of SOD,CAT and GSH,and MDA content in various groups(±s)
①P <0.01,与正常组比较;②P <0.01,与模型组比较
组别正常组模型组二甲双胍组鸢尾黄素组N/只12 12 12 12 SOD(U/mg prot)89.65±0.00 32.14±3.24①89.61±0.45②93.02±0.51②CAT(U/mg prot)10.35±1.34 3.37±0.05①8.65±0.82②11.04±0.31②GSH(U/mg prot)6.56±0.12 1.02±0.45①5.45±0.09②6.52±0.18②MDA(nmol/mg prot)4.54±0.20 11.78±0.23①7.54±0.18②4.12±0.25②
2.5 各组大鼠血清炎症因子TNF-α、IL-6、IL-1β水平比较表4结果显示:与正常组比较,模型组血清TNF-α、IL-6、IL-1β 水平显著升高(P<0.01);与模型组比较,二甲双胍组、鸢尾黄素组血清TNF-α、IL-6、IL-1β 水平显著降低(P<0.01),且2 个治疗组TNF-α、IL-6、IL-1β 水平比较,差异均无统计学意义(P >0.05)。
表4 各组大鼠血清炎症因子TNF-α、IL-6、IL-1β水平比较Table 4 Comparison of the levels of serum inflammatory cytokines TNF-α,IL-6,IL-1β in various groups [±s,ρ/(ng·mL-1)]
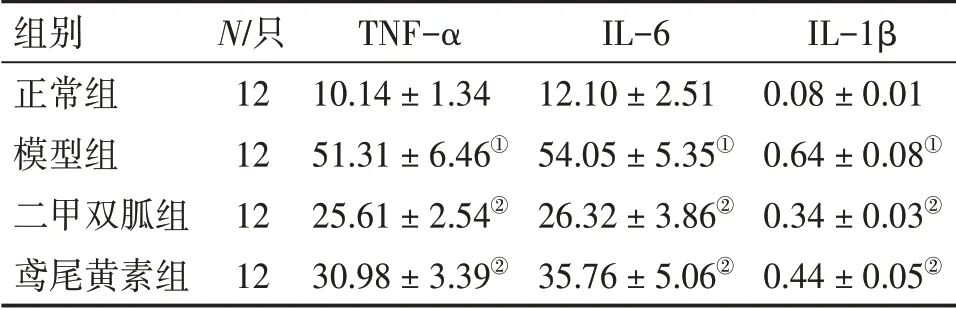
表4 各组大鼠血清炎症因子TNF-α、IL-6、IL-1β水平比较Table 4 Comparison of the levels of serum inflammatory cytokines TNF-α,IL-6,IL-1β in various groups [±s,ρ/(ng·mL-1)]
①P <0.01,与正常组比较;②P <0.01,与模型组比较
组别正常组模型组二甲双胍组鸢尾黄素组N/只12 12 12 12 TNF-α 10.14±1.34 51.31±6.46①25.61±2.54②30.98±3.39②IL-6 12.10±2.51 54.05±5.35①26.32±3.86②35.76±5.06②IL-1β 0.08±0.01 0.64±0.08①0.34±0.03②0.44±0.05②
2.6 各组大鼠肾组织病理表现比较图3 结果显示:与正常组比较,模型组大鼠肾组织表现出明显的病理损伤,可见肾小球数量减少,肾小管水肿、扩张,空泡化,炎性细胞浸润,纤维化,细胞充血,部分区域可见蛋白管型。与模型组比较,二甲双胍组、鸢尾黄素组大鼠肾组织病理损伤程度有所减轻。
2. 7 各组大鼠肾组织cleaved caspase-3 表达比较图4 结果显示:cleaved caspase-3 的免疫组织化学阳性染色主要位于细胞浆内,少数也见于胞核,呈棕褐色。模型组大鼠肾组织cleaved caspase-3 阳性表达率高于正常组(P<0.01);二甲双胍组、鸢尾黄素组大鼠肾组织cleaved caspase-3 阳性表达率低于模型组(P<0.01),且2 个治疗组cleaved caspase-3 阳性表达率比较,差异无统计学意义(P >0.05)。
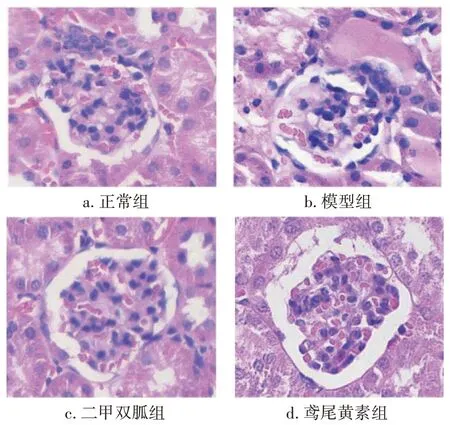
图3 各组大鼠肾组织病理表现比较(HE染色,×400)Figure 3 Comparison of the pathological features of kidney tissue of various groups(by HE staining,×400)
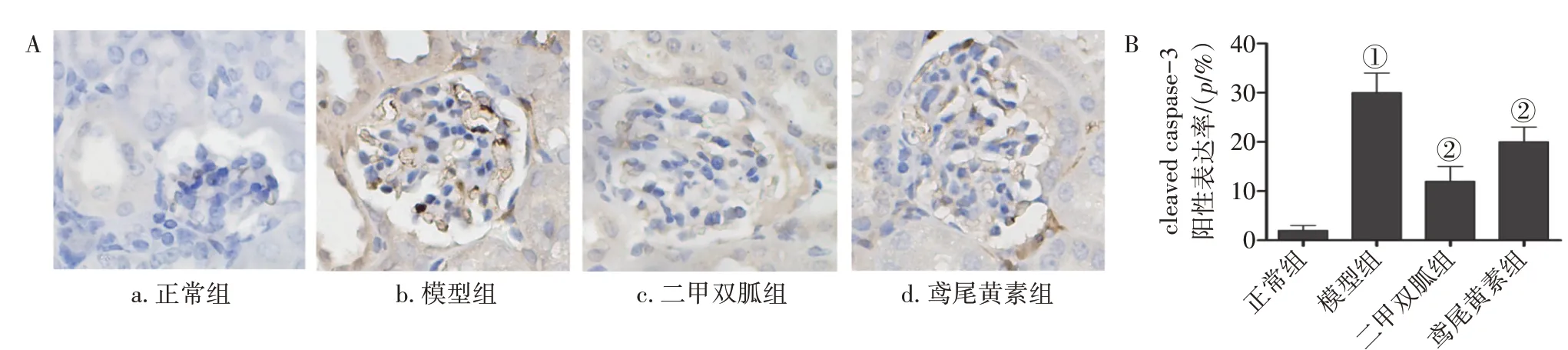
图4 各组大鼠肾组织cleaved caspase-3表达比较(±s)Figure 4 Comparison of the expression of cleaved caspase-3 in kidney tissue of various groups(±s)
2.8 各组大鼠肾组织P-NF-κB p65/NF-κB p65 表达水平比较图5 结果显示: 模型组大鼠肾组织P-NF-κB p65/NF-κB p65蛋白表达水平高于正常组(P<0.01);二甲双胍组、鸢尾黄素组肾组织P-NF-κB p65/NF-κB p65蛋白表达水平低于模型组(P<0.01),且2个治疗组P-NF-κB p65/NF-κB p65蛋白表达水平比较,差异无统计学意义(P >0.05)。
3 讨论
糖化血红蛋白是红细胞中血红蛋白与葡萄糖持续且不可逆地进行非酶促蛋白糖基化反应的产物,其水平可反映检测前120 d 内的平均血糖水平,是判断糖尿病患者长期血糖控制情况的良好指标[13]。本研究结果显示,鸢尾黄素可降低DN 大鼠血糖含量、糖化血红蛋白水平,表明鸢尾黄素具有降低DN大鼠血糖的作用。
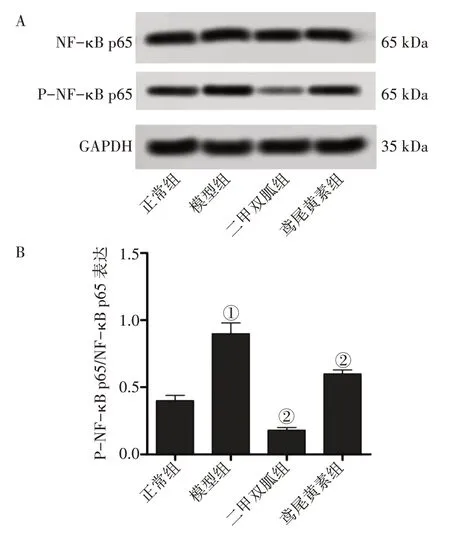
图5 各组大鼠肾组织P-NF-κB p65/NF-κB p65表达水平比较(±s)Figure 5 Comparison of the expression levels of P-NFκB/NF-κB p65 in kidney tissue of various groups(±s)
DN 患者的肾功能损害主要以肾功能下降为主要表现,作为常见的反应肾脏功能状态的指标,临床上可通过检测BUN、SCr、24hUP 水平,对患者的肾功能进行判断,从而判定患者是否为DN[14]。DN 患者中,BUN、SCr、24hUP 均呈现明显的升高趋势[15]。本研究结果显示,鸢尾黄素可降低DN 大鼠的BUN、SCr、24hUP 水平及肾质量/体质量指数,减轻肾组织病理损伤程度,表明鸢尾黄素有改善DN大鼠肾功能和结构的作用。
脂质代谢紊乱被普遍认为是糖尿病及其并发症的原发病理生理改变,血脂异常在DN 的发病机理中起作用,较低的LDL-C 和TG 水平与从中度白蛋白尿进展为严重白蛋白尿或终末期肾病的风险降低相关[16]。TC、TG、LDL-C 和HDL-C 水平的高低是反映胰岛素抵抗、氧化应激和动脉粥样硬化的有力指标[17]。改善脂质代谢是治疗DN 的有效方法。LDL-C 水平的持续升高和HDL-C 水平的降低会导致肾脏形态和功能的改变[18]。本研究结果显示,鸢尾黄素可降低DN 大鼠TC、TG、LDL-C 水平和升高HDL-C 的水平,表明鸢尾黄素可通过改善脂质代谢紊乱对DN大鼠肾功能起到保护作用。
研究[19]证明,抑制炎症细胞募集到肾脏中对实验性DN 具有保护作用。IL-6是一种26 kDa的细胞因子,在急性期反应物和慢性炎症的产生中具有调节作用,虽然不是典型的炎症性疾病,但DN现在被认为涉及慢性低度炎症[20]。随着DN 的进展,机体尿液和血清IL-6增加[21]。IL-1β有助于炎性细胞募集,TNF-α 是DN 的介质,在其发病机制中起重要作用。本研究结果显示,鸢尾黄素可降低DN 大鼠血清炎症因子TNF-α、IL-6、IL-1β 水平,表明鸢尾黄素可通过降低炎症因子对DN 大鼠起到保护肾功能的作用。
氧化应激已经成为DN 的重要新靶标。因过量产生活性氧(ROS)导致的不平衡氧化还原信号传导加剧了肾损伤。SOD、CAT、GSH 是体内抗击ROS的防线,是评价体内氧化应激的重要指标[22]。MDA 是前列腺素的代谢产物,高血糖和高血脂会导致脂质的过氧化及自由基的增加,促MDA 生成[23]。本研究结果显示,鸢尾黄素可升高DN 大鼠SOD、CAT、GSH 活性,降低MDA 含量,表明鸢尾黄素可通过调节氧化应激指标对DN 大鼠起到保护肾功能的作用。
DN 的病因是多因素的,以高血糖、氧化应激、晚期糖基化终产物和血管紧张素Ⅱ为主导因子,每一种因素都能激活NF-κB,这是控制宿主表达的主要转录因子[24]。NF-κB 可调节DN 中的慢性炎症、纤维化,组织重塑相关的粘附分子,并促炎症细胞因子和趋化因子的表达[25]。抑制NFκB可能为DN提供有效的治疗选择[26]。本研究结果显示,鸢尾黄素可降低DN 大鼠肾组织P-NF-κB p65/NF-κB p65 蛋白表达水平,表明鸢尾黄素可能通过抑制NF-κB通路改善大鼠DN。
Caspase-3 作为凋亡执行因子, 其活化后成为cleaved caspase-3 是细胞凋亡不可逆的标志[27]。本研究结果显示,鸢尾黄素可降低DN 大鼠肾组织cleaved caspase-3 阳性表达率,表明鸢尾黄素可通过抑制DN 大鼠肾组织细胞凋亡起到保护肾功能的作用。
综上所述,鸢尾黄素可有效改善DN 幼龄大鼠的高血糖、高血脂、肾组织病理损伤和肾功能异常,其机制可能与抑制体内氧化应激、炎症因子的释放和活化、细胞凋亡等有关。本研究探讨了鸢尾黄素对DN大鼠的治疗作用和鸢尾黄素治疗DN的潜力,为临床应用鸢尾黄素治疗DN 提供了实验依据。
