玉米醇溶蛋白复合纳米粒子的组装及稳定性研究进展
2020-05-24傅玉颖李泽亚陈国文巴楚洁李贞鹏
傅玉颖李泽亚 张 豪 陈国文 靳 冰 巴楚洁 张 超 李贞鹏
(浙江工商大学杭州商学院1,杭州 311508)(浙江工商大学食品与生物工程学院2,杭州 310018)
玉米醇溶蛋白(Zein),旧称米朊,是一种安全无毒的植物蛋白,已被FDA批准用于口服[1]。Zein分子中有3/4是亲脂性氨基酸,决定了其固有的疏水性[2]。此外,食品质构感官和独特的功能特性也取决于Zein的分子结构变化。Zein的两亲性氨基酸决定了其溶解度和结构的多变性,相分离(液-液分散、复凝聚、反溶剂沉淀)技术已被广泛用于构建Zein纳/微米粒子,已有研究指出Zein纳米粒子在一定的酸碱度、高盐浓度和热处理条件下是不稳定的[3],Patel等[4]使用Zein制备的胶体运载体系非常易于聚集,特别是在其等电点附近。利用Zein构建的复合纳米粒子稳定性差、包封率低、冻干后受损,存在应用局限性。本文概述Zein的分子模型、自组装机理以及近几年Zein的各种改性技术(物理改性、化学改性、酶法改性和冷等离子体改性)等方面,为改善 Zein本身及造粒性质提供参考,拓展Zein在食品、医药和化妆品行业的应用。
1 Zein基本性质与结构
1.1 Zein的理化性质
Zein是一种混合蛋白,生物相容性强,可生物降解,能够自组装[5],表1列举了Zein的基本物理化学性质。Zein属于一类分子质量不同的醇溶性多肽,根据溶解度和氨基酸序列的相似性,Zein被划分为4个组成部分,即α-Zein (19 000和22 000),β-Zein (14 000),γ-Zein (16 000和27 000) 和δ-Zein (10 000)[8],但这些蛋白分子质量会因不同的提取方法有所不同。在结构上,Zein主要由疏水和中性氨基酸组成仅含有少量的极性氨基酸残基(如谷氨酰胺)[9],Zein的氨基酸组成见表2,可以看出,疏水性氨基酸(如亮氨酸和丙氨酸)和酸性氨基酸(如谷酰胺)含量最高,因此Zein不溶于水(平均疏水力是白蛋白或纤维蛋白原的50倍)和稀盐溶液,但溶于60%~95%乙醇,高浓度的尿素,碱性溶液(pH≥11)和阴离子表面活性剂溶液(如SDS溶液)[10]。
商品化的Zein有2种颜色,即黄玉米蛋白(亮黄色)和白玉米蛋白(白色)。黄玉米蛋白因为含有玉米黄素(8%~9%,由叶黄素,玉米黄质素,β-隐黄素组成)而呈现淡黄色,此类蛋白的纯度通常为88%~90%,氧化程度随储藏时间延长而加深导致颜色变淡[11,12]。白色的Zein由黄玉米蛋白脱色得到,几乎不含玉米黄素,纯度一般在96%以上。研究表明,玉米黄素的存在与Zein的胶体性质密切相关,含有玉米黄素的Zein具有更好的界面吸附活性,赋予其更好的两亲特性,通过pH诱导脱除玉米黄素,发现Zein荷载姜黄素的能力明显下降[13]。
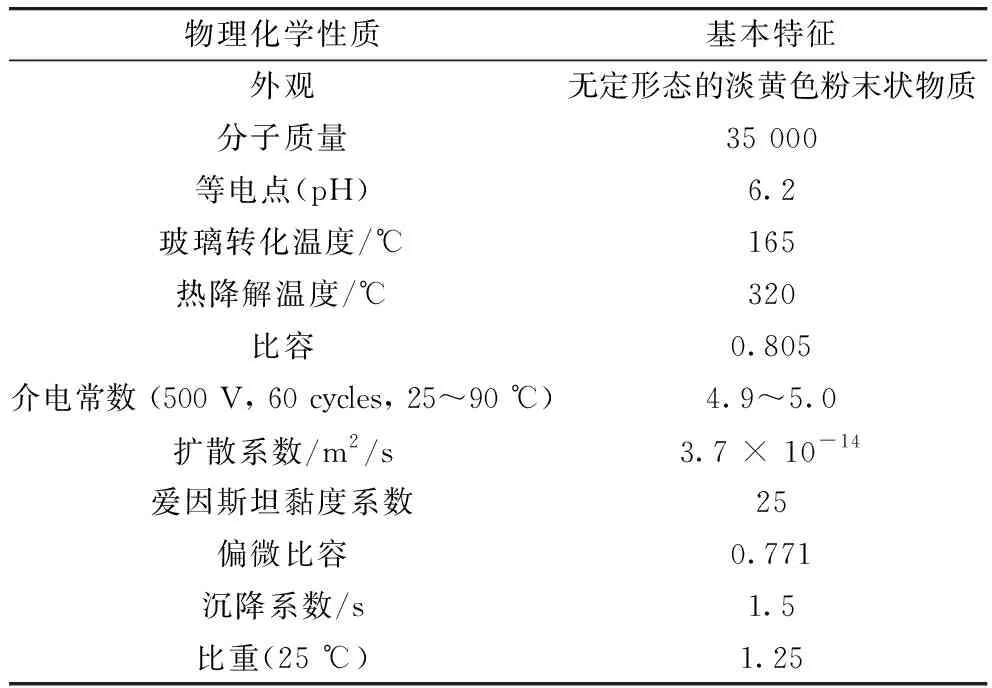
表1 玉米醇溶蛋白的基本物理化学性质[6,7]
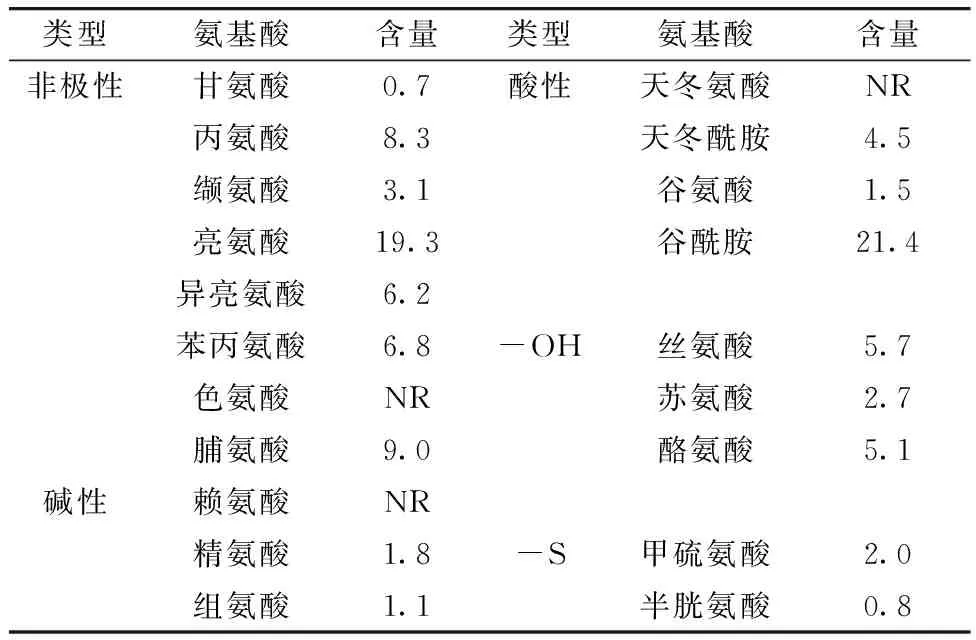
表2 玉米醇溶蛋白的氨基酸组成[6](g氨基酸/100 g玉米醇溶蛋白)
1.2 α-Zein的结构模型
研究表明,α-Zein是Zein的主要形式,具有大量α-螺旋,随温度、pH和溶剂组成等因素而变化[14]。Lee等[14]通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)得到了Zein多肽2种主要的表观分子质量为19 000和22 000(分别称为Z19和Z22),有研究提出Zein结构模型有阿螺旋轮模型[15]、长带状模型[16]、发夹模型[17]和开放的超螺旋模型[18]。
α-Zein由均一的重复单元组成,图1展示了4种可能的α-Zein的三维结构模型。图1 a是由Argos等[15]基于甲醇溶液中α-Zein的重复单元和α-螺旋含量分析提出的阿螺旋轮模型。在此模型中,9个相邻的拓扑反平行螺旋形成了由谷氨酰胺残基连接的圆柱形表面,此结构由范德华力和分子间氢键稳定,极性谷氨酰胺残基通过侧链间的相互作用促使分子间进一步堆积成平面。此模型提出了Zein的一个轴率为2∶1的球型自组装结构,与Tatham等[19]提出的细长不对称结构相反。Matsushima等[17]利用小角X射线散射(SAXS)研究了70%乙醇水溶液中Zein的构象特征,提出了由9~10个相邻拓扑反平行螺旋组成的尺寸为13 nm×1.2 nm×3 nm,轴率为6∶1的长带状模型(图1b)。二维的分子间疏水聚集使螺旋中伸出的侧链堆积成一个疏水的表面,形成了一个两端亲水(顶部与底部)而侧面疏水的结构,极大提高了α-Zein结构的稳定性。此带状模型常被用来解释Zein在亲水/疏水表面的取向行为与Zein自组装成纳米颗粒的行为过程[20-21]。但几位研究者在这种混合物中进行的构象研究相互矛盾,可能是受到了遗传或环境因素的影响。Forato等[18]通过傅里叶变换红外光谱(FTIR),核磁共振(NMR)和小角X射线散射(SAXS)分析了从BR451玉米品种中提取的Z19片段(无Z22蛋白),发现Z19含有46%的α-螺旋和22%的β-折叠且不是紧凑结构,并由此将Z19结构建模为由螺旋形、片状、转弯形和二级结构组成的发夹状,即短螺旋结构以延伸的方式排列,通过环、圈或片连接,符合13 nm × 1.2 nm × 3 nm的尺寸并且更稳定,区别于Tatham等[19]提出的在2个长螺旋节段的中间有1个转弯或环(图1c),并解释分子可以在水中形成纤维的原因。最近,有研究提出了3个超螺旋结构的模型,每个超螺旋结构由富含谷氨酰胺的转角连接3个反平行螺旋区段组成(图1d)[18]。
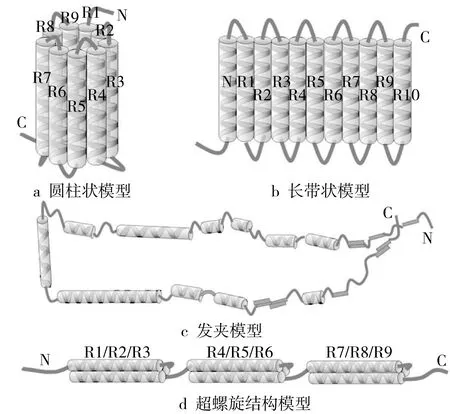
注:R代表重复单元[14]。图1 α-Zein的四种三维结构模型
2 Zein的自组装
2.1 Zein在乙醇水溶液中的自组装与流变特性
Zein的4个组分中α-Zein可溶于70%~95%乙醇,β-Zein可溶于60%乙醇,却不溶于95%乙醇,γ-Zein可通过还原剂溶解在乙醇中。商业Zein仅在水中溶解性差,可溶于含水乙醇,丙酮水溶液和pH≥11.5的碱性水溶液中[4 , 22]。
乙醇水溶液是Zein的常用溶剂,探究Zein在乙醇水溶液中的自组装行为及流变特性,对Zein的工业应用与构建Zein的新型胶体结构有重要指导意义。Wang等[23]发现乙醇浓度影响着溶液粒子的粒径和均一度,Zein溶液中粒子粒径和PdI值随着乙醇浓度的增加而降低。Kim等[24]也发现Zein在乙醇水溶液的聚集行为随乙醇浓度变化而变化。如图2所示,70%~93%乙醇浓度范围内,随着乙醇浓度增加(溶液极性减小),Zein的粒径先减小后增加,在乙醇浓度为90%时,粒径最小。
观察不同浓度乙醇水溶液中的Zein黏度变化能更好理解Zein的构象变化。Fu等[25]研究了Zein在乙醇水溶液中的流变行为,发现Zein表现出良好的牛顿流体行为,受Zein浓度、乙醇的质量分数和温度影响:温度对Zein的黏度的影响符合Arrhenius-type方程;Zein浓度增加,黏度以指数形式迅速增加;乙醇的质量分数增加,Zein的黏度减小。
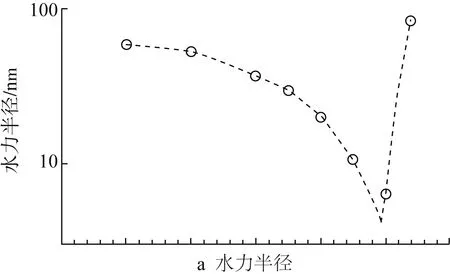
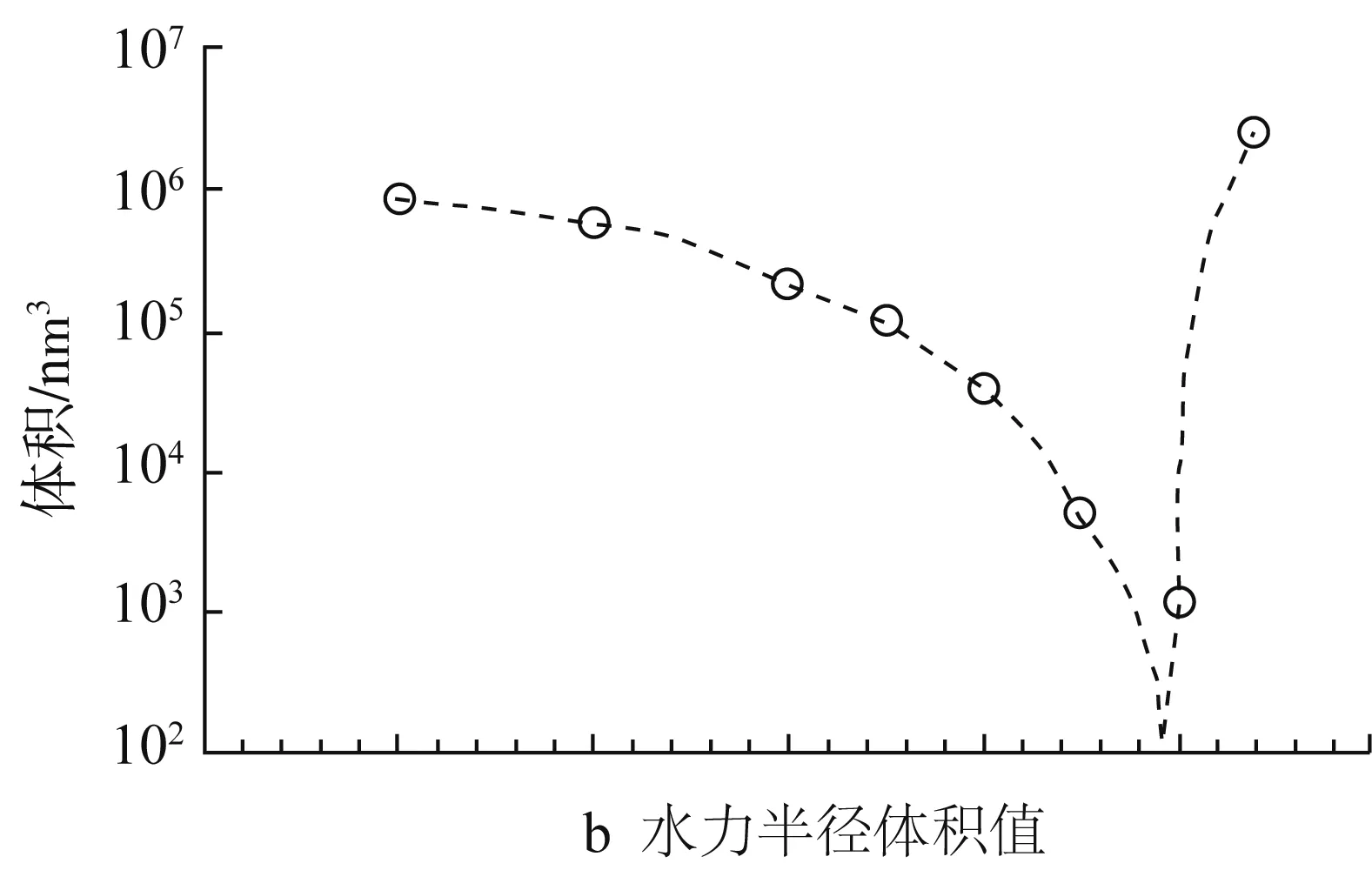
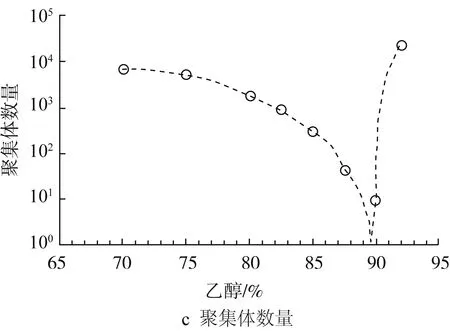
图2 玉米醇溶蛋白聚集体在乙醇水溶液中的尺寸变化[24]
2.2 Zein在反溶剂过程中的组装机理与相分离过程
已知Zein含有大量非极性和中性氨基酸[9],当Zein溶剂极性增加时,分子构象发生改变,溶解度降低,分子之间相互聚集,这个过程称为Zein的自组装。如Matsushima提出的α-Zein带状模型,Zein的两端亲水而表面疏水,赋予Zein两亲特性,这是Zein自组装的主要驱动力。基于Matsushima的模型,Wang等[21]研究了乙醇挥发条件下Zein结构的变化行为,根据高分辨率透射电镜(HRTEM)和圆二色谱(CD)的结果表明,随着乙醇的挥发溶液的极性逐渐增强,Zein分子中的α-螺旋减少而β-折叠增多,即α-螺旋向β-折叠转变;接着在疏水相互作用力的驱动下,β-折叠逐渐首尾相连,反向平行排列成条带,最后条带层层堆积、卷曲形成纳米颗粒。
Zein、乙醇和水混合后的三元相图如图3a所示。在三相(Zein、乙醇与水)混合过程中,乙醇浓度减小,过饱和的Zein在溶液中发生聚集和成核。同时,由于乙醇的相对挥发度高,在搅拌的过程中,乙醇浓度进一步减小,加剧了Zein的成核过程。产生的核心通过捕获游离状态的Zein分子或奥氏熟化不断生长,当Zein的初始浓度过高或出现大量核心时,核心主要通过已有粒子的无规则碰撞生长[26]。最后,粒子之间的聚集达到热力学平衡状态。而当溶液中Zein的浓度低于溶解度阈值时,粒子停止成长。Zein的溶解、成核和晶核生长等因素将会影响形成的粒子性质,载药量与释放性能。如乙醇、甲醇和异丙醇都可以用来构建Zein纳米粒子,但得到的纳米粒子大小不同,依次是乙醇 >异丙醇 >甲醇,这可能是Zein在溶剂中的溶解度不同和溶剂的挥发速率不同导致成核和晶核生长的速率不同[27]。除了溶剂类型,提高搅拌速率、增加溶剂浓度或减小Zein的浓度都可以得到尺寸较小的纳米粒子[28]。粒子在形成过程中,溶剂与非溶剂不同的混合方法对Zein的浓度影响如图3b、图3c所示。此外,pH、温度、添加剂等都会干扰Zein的溶解、成核与晶核生长过程,从而影响粒子的性质[5]。
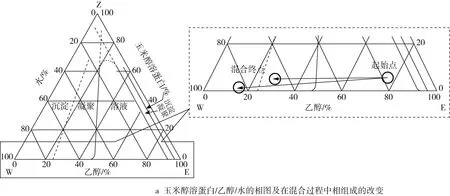
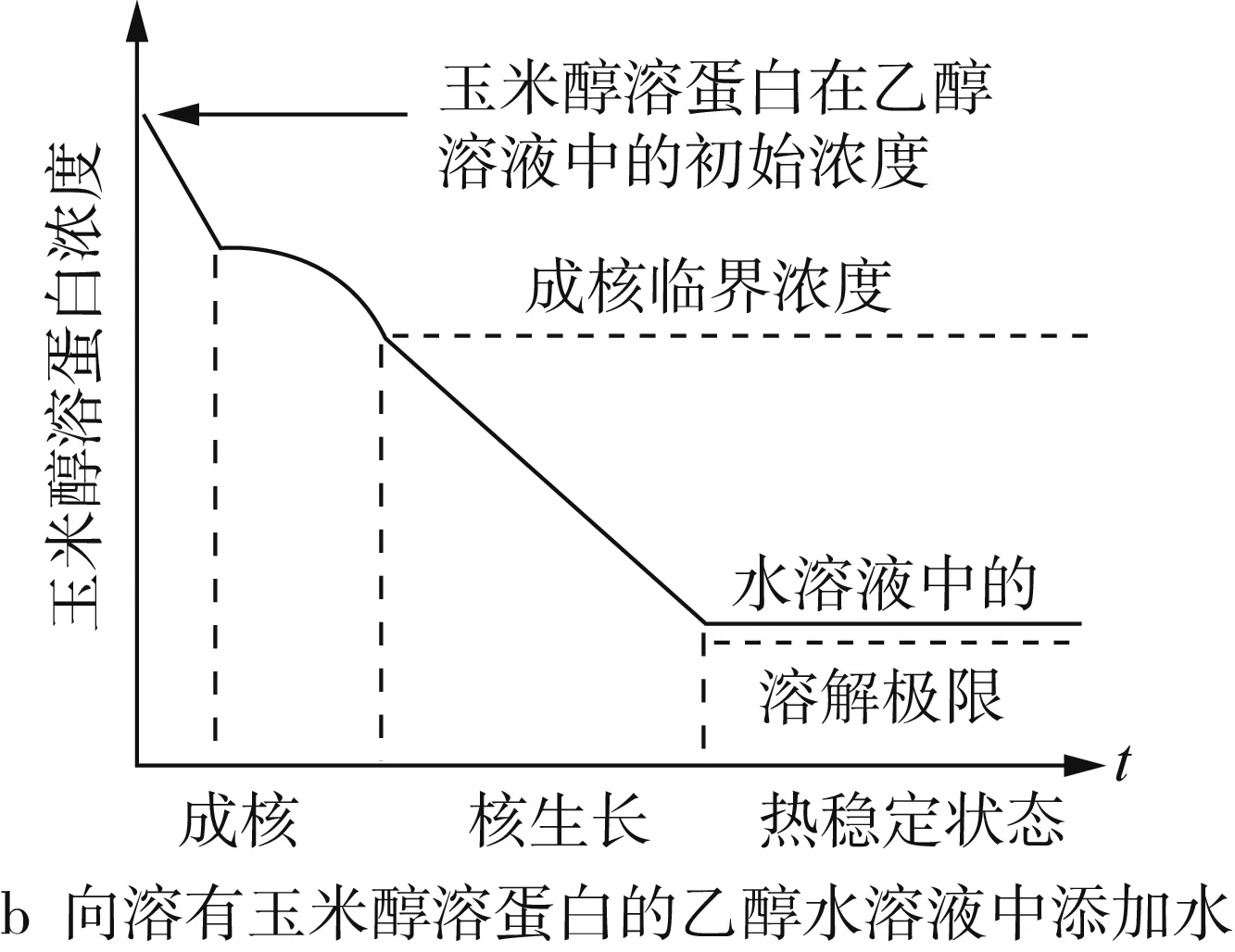
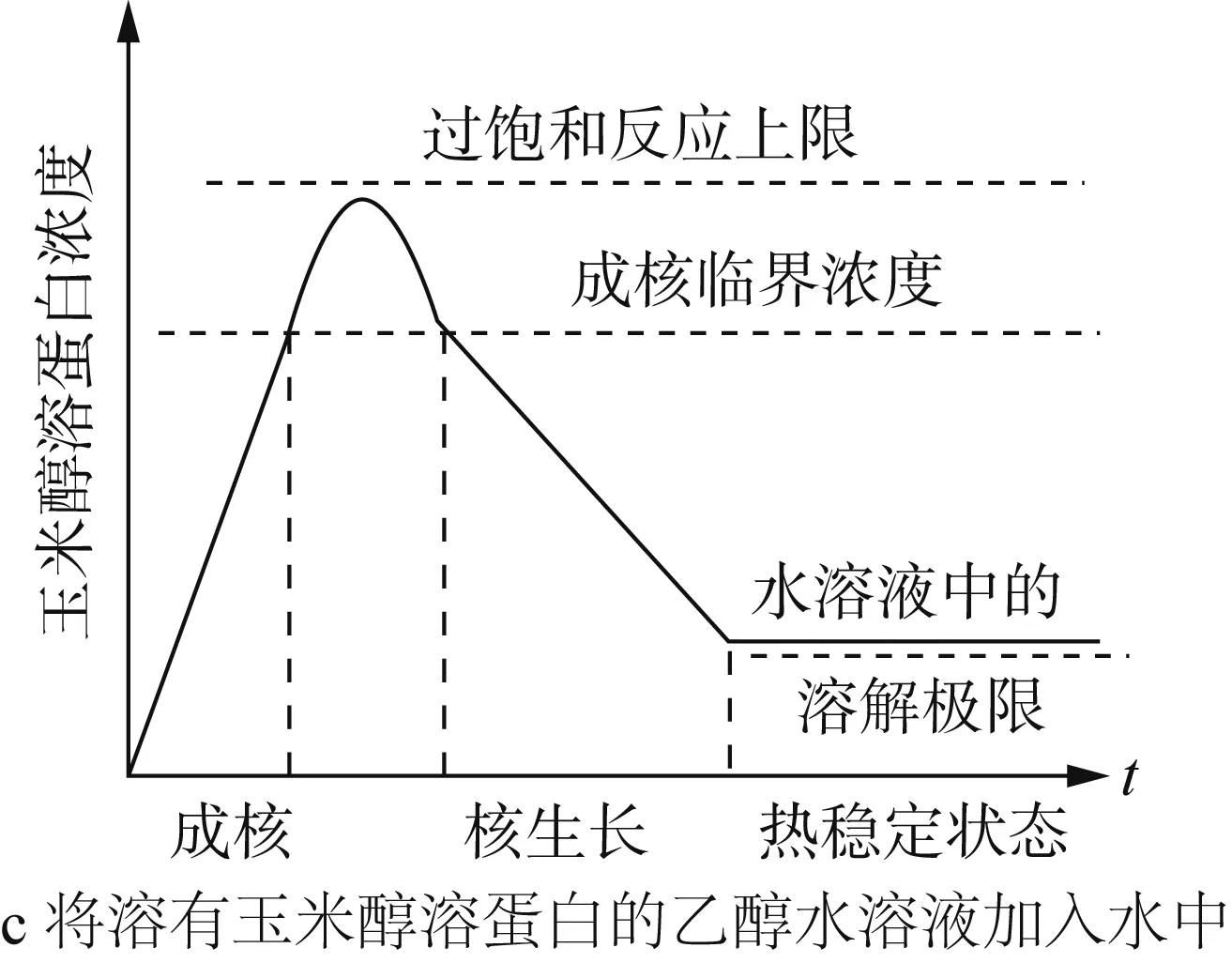
图3 Zein、乙醇和水混合后的三元相图[14]
3 Zein的改性研究
由单一Zein制备的纳米粒子存在包封率低、对环境敏感、胃肠控释性能差等局限性[29],难以在食品工业中大规模运用。本节介绍Zein的修饰和改性,改变Zein的结构和性质,改善其对生物活性物质的保护,以适应不同的应用需求。
3.1 物理改性
3.1.1 与多糖复合
Folter等[30]报道了用Zein胶体粒子制备O/W乳液,但乳液稳定性并不理想,这是因为Zein疏水性强,三相接触角大于100°,难以有效稳定O/W界面。Zein的等电点在pH 6.2左右,当pH值高于6.2时Zein带负电,反之带正电。因此,Zein可以与不同电性的多糖发生静电相互作用。另外,Zein与多糖之间还存在疏水和氢键相互作用力[31]。可以通过改变多糖的类型(如果胶有线性阴离子主链和中性的支链结构,大豆多糖是糖链上缀合有蛋白的糖蛋白)和浓度、环境pH值、离子强度和温度等因素调控蛋白多糖复合物的性质,从而达到对Zein改性的目的,提高Zein的稳定性和界面活性。例如,Zhou等[32]利用Zein与果胶的相互作用调控Zein的自组装成核过程和界面排布行为,从而构建不同的界面结构来稳定高内相乳液。结果表明,较高的Zein与果胶复合比例和低pH值能产生有序的界面结构从而促进油滴堆积成3D网络结构,得到的高内相乳液有较好的黏弹性和触变性,提高了高内相乳液的抗氧化和储藏稳定性。
3.1.2 与蛋白复合
Zein不溶于水,可自组装成纳米粒子,因此常用作良好的控释载体。但Zein在等电点附近会发生聚集,盐离子稳定性差,且干燥后的Zein纳米粒子不易复溶,这些缺点使Zein的应用受限。Patel等[33]利用反溶剂沉淀法制备Zein/酪蛋白酸钠复合粒子,把Zein溶液滴加到酪蛋白酸钠溶液中,Zein聚集成纳米粒子,带相反电荷的酪蛋白酸钠分子吸附在Zein的表面,形成了Zein/酪蛋白酸钠核壳结构的纳米粒子。结果表明,Zein/酪蛋白酸钠纳米粒子在NaCl浓度为0.015~1.5 mol/L范围内仍保持稳定,显著提高了Zein的盐离子稳定性。另一项研究中,Pan等[34]采用pH循环法制备Zein/酪蛋白酸钠杂化粒子。结果表明,不同于反溶剂沉淀法,pH循环法得到两种蛋白互相杂化的纳米粒子,该方法避免了乙醇的加入且得到的纳米粒子在中性pH下仍保持稳定,也有效提高了Zein的复溶性。
3.1.3 与表面活性剂复合
有些表面活性剂与蛋白质可通过静电或疏水相互作用紧密结合,改变Zein的表面电荷及亲/疏水特性,提高复合纳米粒子的稳定性。Deo等[35]利用十二烷基磺酸钠(SDS)探究表面活性剂对疏水蛋白的改性行为。结果表明,在SDS存在下Zein的变性分为两步:SDS浓度在4~200 mmol/L之间,SDS与Zein内部的氨基酸相结合,形成小的疏水微区;SDS浓度大于200 mmol/L时,Zein的结构完全展开,呈现棒状结构。Dai等[36]将Zein和卵磷脂复合包埋姜黄素得到复合纳米粒子,卵磷脂的加入改变了Zein的表面电荷和分子结构,大大提高姜黄素的包埋率及紫外光照和热稳定性。
3.1.4 与多酚复合
单宁酸是一种富含羟基的多酚,能与许多生物大分子如蛋白、多糖和其他合成的聚合物发生相互作用。Zou等[37]证明单宁酸易与脯氨酸丰富的蛋白质发生疏水、氢键和静电相互作用,并用单宁酸与Zein之间的氢键相互作用非共价修饰Zein纳米粒子,并用改性后的Zein纳米粒子制备乳液凝胶。结果表明,用单宁酸改性后的Zein纳米粒子能显著提高乳液的稳定性,单宁酸的加入影响反溶剂过程中Zein的自组装行为,调控Zein纳米粒子的表面润湿性使Zein纳米粒子的三相接触角为86°左右。
3.2 化学改性
3.2.1 Zein的磷酸化改性
磷酸化改性是蛋白质化学改性常用的方法之一,常用的试剂有三氯氧磷、三聚磷酸钠和焦磷酸盐。磷酸化改性的机理为磷酸盐特异性选择蛋白侧链的活性基团(如色氨酸或苏氨酸的-OH及赖氨酸的ε-NH2)与其发生酯化反应,磷酸根基团的引入增加了蛋白质的电负性,从而改变蛋白质的功能性质[38]。在蛋白磷酸化过程中,磷酸的氢离子与氨基酸残基提供的氢氧根离子通过消除反应形成酯键(-H2PO4),然后与其他氨基酸残基进一步发生消除反应,使蛋白质链交联,形成单酯、双酯或三酯化合物,反应过程如式(1)、式(2)所示[39]。Wu等[40]用磷酸化技术将磷酸基团引入Zein,提高了Zein在水中的溶解度;改性后的蛋白成膜性好,延伸率高,避免了塑化剂的加入,使Zein蛋白膜的应用范围更广更灵活。
Protein-NH2+ POCl3→ Protein-NH-POCl2+ HCl
(1)
Protein-NH-POCl2+ HOOC-Protein → Protein-NH-CO-Protein+HOPOCl2
(2)
3.2.2 Zein的糖基化改性
糖基化是蛋白质常用的改性手段,主要是将糖类化合物与蛋白质共价相连,得到兼具蛋白质和多糖功能特性的产物。糖基化改性包括美拉德途径和转谷氨酰胺酶途径。但美拉德途径的糖基化反应常伴随一些副反应如形成有毒和致突变物质,产生褐变和不好的风味物质,而且糖化程度也不易控制。酶催化的糖基化途径反应条件温和也增加了安全性,具有研究和开发的前景。蛋白质分子中谷氨酰胺残基与赖氨酸残基的ε-氨基在转谷氨酰胺酶的催化下发生反应,形成分子内或分子间ε-赖氨酸(γ-谷氨酰基)异肽键,使蛋白质分子发生交联。Wang等[41]用转谷氨酰胺酶催化壳聚糖(Mw1 500)与Zein共价结合,糖基化后的Zein溶解性和表面疏水性显著提高,抗氧化性能提高,有效抑制猪肉糜的脂质氧化。Yin等[42]用美拉德反应途径,得到去酰胺的Zein多肽与多糖的共价产物,该产物在酸性条件下能很好地稳定乳液,适合食品饮料体系的应用。
3.2.3 Zein的去酰胺改性
蛋白质去酰胺是将蛋白质的中性氨基酸即谷氨酰胺(Gln)或天冬酰胺(Asn)水解成亲水的谷氨酸(Glu)和天冬氨酸(Asp),同时蛋白质结构展开从而提高蛋白的功能性质[42]。去酰胺有酶法和化学法,化学法是通过酸/碱处理使蛋白质去酰胺,间接使蛋白质的肽键发生裂解,导致蛋白质水解,这个过程受反应时间影响。适度水解能增加蛋白质的柔韧性,暴露出一些活性基团,改善蛋白的功能特性;但过度水解会产生一些苦味肽,影响蛋白的应用[43]。Cabra等[43]采用碱法、酸法和酶法对Zein进行去酰胺处理,发现只有碱法去酰胺时没有出现沉淀,且产物能很好地分散在中性水溶液中,Zein的乳化性和亲水性大大提高。
3.2.4 Zein与多酚共价结合
多酚的化学结构复杂,含有许多反应活性基团,容易通过非酶/酶促反应被氧化[44]。在非酶促反应中,多酚被氧化成醌,进一步与蛋白质的游离氨基、赖氨酸、半胱氨酸和色氨酸发生亲核加成反应[44]。多酚的酶促氧化通常用多酚氧化酶或漆酶来催化反应。在氧气存在的条件下,处于邻位的羟基可形成O-醌,进一步与蛋白质发生亲核加成[45-46]。Liu等[47]用EGCG共价修饰Zein,然后用反溶剂法制备纳米粒子共包埋姜黄素和白藜芦醇。结果表明,改性的Zein纳米粒子能有效保护姜黄素和白藜芦醇并保留了它们的抗氧化活性。
3.3 酶法改性
利用酶将蛋白质水解成多肽,可以改善蛋白质的功能性质。酶具有特异性,可以选择性裂解蛋白肽链的特定位点,改变酶或底物浓度,酶解时间和温度可以控制蛋白质的水解程度,从而得到分子质量不同的多肽[48]。两亲性多肽自组装是近年来的研究热点,它可以自组装成不同的纳米结构,如胶束、纳米管、纳米纤维等[49]。这些纳米结构因可作为功能性活性物质的运载体而颇具研究潜力。
众所周知,蛋白或多糖可以稳定Zein胶体粒子,但复合Zein纳米粒子粒径较大(> 100 nm),水溶液在外观上浑浊不透明,限制了其在透明饮料中的应用。Zein经蛋白酶处理后,水溶性明显增加,玉米肽的可解离基团数量增多,形成可溶性肽,酸性条件下不易凝聚,等电点处不易沉淀[50]。Wang等[51]用蛋白酶(Alcalase 2.4 L)水解Zein得到两亲性的蛋白肽,进一步与姜黄素复合形成纳米复合物,得到的复合物粒径小(<50 nm)且溶液透明。
3.4 冷等离子体改性
冷等离子体作为一种表面处理技术已被证明是一种改善聚合物粘附性和功能性而不损害整体性能的有前景的方法[52]。冷等离子体由于其非热性质,在改性Zein基薄膜方面具有附加的效益,等离子体暴露在空气中会形成过氧化氢和过氧化物,这些物质对在薄膜表面沉积极性基团具有积极的作用[53]。Dong等[54]研究了介质阻挡放电(DBD)大气冷等离子体(ACP)技术对Zein粉末的理化性质和结构性质的影响:Zein的平均粒径显着降低,即ACP处理后聚集体解聚;Zein溶液中游离-SH浓度增加,pH值降低;蛋白分子构象重排。改性后的Zein膜相比于未处理的膜,抗拉强度和表面亲水性都有所提高。Chen等[55]对Zein膜进行了两步改性:复合壳聚糖后介质阻挡放电(DBD)冷等离子体改性,成功地改善了润湿性、热稳定性、机械和阻隔性能。
4 结论与展望
Zein特殊的氨基酸组成和分子结构决定了其性质和功能,影响着复合纳米粒子的稳定性和运载效率。通过凝胶电泳获得Zein的Z19和Z22两种多肽可呈现阿螺旋轮、长带状、发夹和开放的超螺旋四种模型。本文从分子结构层面探讨了Zein的自组装、流变特性和相分离过程,即Zein在乙醇水溶液(不同的溶剂极性)的聚集行为随乙醇浓度(溶液极性)变化而变化。但单一Zein构建的纳米粒子会形成疏松的介孔结构,对环境敏感,存在诸多弊端,随之出现多种Zein改性技术,包括物理改性、化学改性、酶法改性和冷等离子体改性,物理改性是Zein和其他分子之间存在静电、氢键或疏水等非共价作用;化学改性使蛋白质分子结构改变,可能发生交联、氨基酸水解等化学反应,蛋白-多酚可产生不可逆的共价键或发生亲核加成反应;酶法改性即通过特定的酶将蛋白质水解为不同分子质量的多肽;冷等离子体改性技术就是不借助其他物质,在不损害原有优质性能的前提下改善其部分不良性质。然而,对于改性后的Zein在体内是否存在毒性或是否污染环境必须在其应用于食品等领域之前确定,但这方面的潜在风险尚不清楚。在人体内作用于不同靶器官的控释问题也是将来热门研究的话题之一。
